4例体外膜肺氧合辅助治疗先天性膈疝病人的围术期护理
蔡玉桃,钟 微,张思苑
先天性膈疝(congenital diaphragmatic hernia,CDH)是由于膈肌发育不良而导致腹腔脏器经膈肌缺损疝入胸腔的一种先天性疾病,其发病率在活产婴儿中占0.033%~0.042%。CDH的病死率约为30%,重症CDH病死率达60%以上[1]。适时手术是治疗CDH最有效的方法[2],对于围术期生命体征不稳定,常规方法治疗失败的重症膈疝,体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)用以帮助维持生命体征平稳,度过呼吸衰竭和肺动脉高压的危险期十分重要[3]。现将2018年1月—2018年6月,本院4例ECMO辅助治疗CDH的围术期护理总结如下。
1 临床资料
1.1 4例患儿出生时情况
4例患儿均为左侧膈疝,产前排除心脏畸形及染色体异常。病例4于妊娠29周时行胎儿镜下气管球囊阻塞术(fetal endoscopic tracheal occlusion,FETO),出生时行子宫外产时处理(ex-utero intrapartum treatment,EXIT)取出球囊。患儿出生情况见表1。
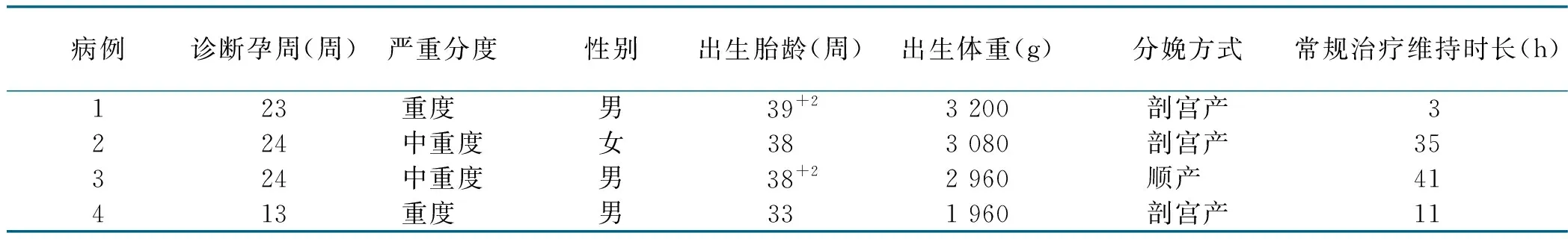
表1 4例患儿出生情况
1.2 4例患儿手术情况
ECMO支持均使用静脉-动脉模式(V-A),右侧颈内动静脉置管,详见表2。

表2 4例患儿手术情况
1.3 4例患儿结局(见表3)

表3 4例患儿结局
2 护理
2.1 术前护理
2.1.1 生命体征监测
ECMO置管操作及准备行膈肌修补术患儿均置于辐射台保暖方便操作。专人护理,观察患儿反应、瞳孔、皮肤情况、ECMO动静脉置管的渗血情况,每小时记录患儿生命体征及出入量情况1次。注意尿量及尿颜色,尿量反映肾血流灌注情况,如出现尿少或无尿,需及时通知医生,调整血管活性药物使用,必要时联合应用连续肾脏替代治疗;一般早期发现血尿及血红蛋白尿,提示溶血发生,4例患儿在置入ECMO早期出现短暂血尿,其中3例在48 h后自然改善;1例早产患儿血尿经更换膜肺及重新经升主动脉置入8 Fr(原颈内动脉置管为6 Fr)动脉置管才有改善。持续对患儿进行经皮血氧饱和度(SpO2)监测,分别监测右上肢及下肢,4例患儿均使用右侧颈内动静脉置管,因此右上肢的SpO2能较好地反映膜肺氧合血的血氧情况,下肢的SpO2能较好地反映膜肺氧合血及患儿肺氧合血混合的血氧情况。
2.1.2 建立动静脉通路
ECMO辅助治疗的CDH患儿全身肝素化下容易出血,故需同时应用多种血管活性药物、血制品,外周静脉不适合采用,因此,中心静脉导管是必需的。4例患儿均在我院进行产前检查,出生时均留置了3.5 Fr脐静脉导管,其中3例足月患儿在ECMO静脉置管同时置入4 Fr双腔中心静脉导管,3条中心静脉通路能满足膈肌手术需要;但1例早产儿病例,因颈内静脉管径太小不能与ECMO置管同时置入,膈肌手术前置入左侧颈内/锁骨下中心静脉导管失败,导致手术期间仅有单腔的脐静脉通路及外周静脉通路。提示:①不要在全身肝素化情况下进行颈部深静脉穿刺留置中心静脉导管,容易失败且出血难以控制。②中心静脉导管穿刺可在ECMO置入全身肝素化前进行。③必要时脐静脉置管时置入4 Fr双腔中心静脉导管。
动脉置管主要作用为监测血压及采血。术前首选脐动脉,其方便置入及管理,使用管道为3.5 Fr脐静脉导管。值得注意的是,在动脉采血化验时,为了避免动脉监测管路中肝素的影响,应在从动脉置管抽取>10 mL血(采血后回输)后才进行化验血的采集,采血时不能过快,新生儿尤其早产儿血容量少,采血过快会导致容量不足,血压下降,ECMO流量报警。
2.1.3 呼吸系统管理
当ECMO回路血流量达到100 mL/(kg·min)以上时,调节呼吸机参数:较低呼吸频率为每分钟10~15次,较长吸气时间0.7~0.8 s,较高呼气末正压(positive end expiratory pressure,PEEP)6~10 cmH2O(1 cmH2O=0.098 kPa),较低吸气峰压(peak inspiratory pressure,PIP)15~20 cmH2O,避免进一步肺损伤,同时保持肺泡开放[4]。气道护理主要保持气道通畅,根据患儿痰液情况决定吸痰频率,重视呼吸机湿化,以免痰液黏稠不易吸出而导致肺不张。严格无菌操作,如出现痰液颜色改变,需留取标本送病原学检查,及时调整抗生素。
2.1.4 ECMO运行管理
①置管周围皮肤:ECMO导管留置处皮肤使用无菌纱块覆盖,每天换药及检查导管位置、固定情况并做好交接班。如果纱块渗血多,及时更换、称重估计出血量,并通知医生做相应处理。4例患儿采用颈内动静脉ECMO置管,通过观察皮肤情况,有1例置管后出现头颈部、上肢、胸壁静脉淤血,颈静脉怒张,腹部及下肢皮肤发白,出现上腔静脉综合征(superior vena cava syndrome,SVCS),予调整ECMO静脉置管后改善。②管道观察:4例患儿ECMO置管后至手术时间为(60.8±45.8)h,这段时间内,没有发生管道血栓形成、膜肺渗漏等情况。常见情况为管道抖动、血流量下降,其主要原因为机体容量不足,导管位置偏移,尤其病例4早产儿出生体重不足2 kg,ECMO流量仅为0.20~0.24 L/min,对容量丢失非常敏感,应及时分析原因,补充有效容量或调整管道位置。③出凝血监测:3~6 h监测1次血气分析、活化凝血时间(activated clotting time,ACT),6~12 h监测1次活化部分凝血活酶时间(activated partial thromboplastin time,APTT),调整肝素用量。在膈肌修补术前,控制ACT在160~220 s,纤维蛋白原>1.5 g/L,APTT 50~80 s,血小板>100×109/L,红细胞比积>30%。
2.1.5 术前备血、药物准备
2.1.6 患儿家属心理护理
在ECMO辅助、全身抗凝情况下行膈肌修补术,风险极大。术前应鼓励患儿家属床边探视,告知其大概治疗过程及可能出现的情况,减轻家属的忧虑,使其积极配合治疗。
2.2 术后护理
2.2.1 密切注意手术部位引流情况
在ECMO辅助下进行经腹膈肌修补术,4例患儿因膈肌缺损大,均需要补片修补,术后胸腹腔均放置引流管,引流管应妥善固定,避免扭曲受压,保证通畅。术后应密切注意引流液体的颜色、形状及量,每小时记录胸/腹腔引流量、生命体征。病人术后出血量较多,应密切监测引流量及生命体征,早期识别血容量不足,及时干预,输血和调整肝素维持量。病例1术中发现一段肠管闭塞,行肠切除吻合术,术后腹腔引流管见胆汁样液引出,考虑吻合口瘘,通过充分引流等治疗后治愈。如无引流液1 d或2 d,可复查超声,确定无积液后再拔除引流管。
2.2.2 术后长时间运行ECMO的观察
根据国际体外生命支持组织(Extracorporeal Life Support Organization,ELSO)的统计,ECMO辅助治疗CDH,平均运行时长为256 h,最长2 549 h[7]。本研究4例病例中,ECMO辅助时长为(513.5±384.4)h,术后需较长时间运行ECMO,因此除术前注意事项外,还应注意管道血栓形成、膜肺渗漏及膜肺效能下降,及时更换膜肺。每班手电照射观察ECMO管道及氧合器,血栓通常表现为管道局部颜色深暗且不随血液流动的区域,右上肢SpO2持续下降通常反映膜肺效能下降,4例患儿中未发现膜肺渗漏,因膜肺效能下降及红细胞机械性破坏,分别更换膜肺5次、0次、0次、3次。
2.2.3 主要并发症的识别与处理
①颅内出血:每班观察患儿瞳孔、肌张力及反应情况。如患儿出现瞳孔不等大、对光反射消失,突然反应转差,肌张力低下,甚至抽搐,需高度警惕颅内出血发生,尽快行头颅超声;如发现出血,在监测凝血功能及血小板同时,必须每隔12~24 h复查超声。病例2在术后约48 h突然反应差,肌张力低,超声发现颅内出血,在其后12 h及24 h时复查超声提示颅内出血进展,家人放弃治疗,患儿死亡。②消化道出血:观察胃管引流情况及大便情况,当患儿出现胃管引流血性液增多或排血便及时向医生反映,胃管内注入生理盐水5 mL+凝血酶100 U,以及调整凝血情况,必要时输注血小板,监测X光片,了解腹部情况。③感染:严格采取院内感染防控措施,监测感染指标(C反应蛋白、降钙素原和血培养)。ECMO运行中,如出现不明原因的乳酸增高、血小板减低,需警惕感染发生,合理选择抗生素,在支持过程中根据微生物学证据随时调整[8]。④肝、肾功能衰竭:病例1、病例4患儿,因术后长时间禁食、静脉营养及感染,出现谷丙转氨酶、γ-谷氨酰转肽酶、血清直接胆红素和总胆红素等进行性升高,考虑出现胃肠外营养相关性胆汁淤积(parenteral nutrition associated cholestasis,PNAC)并肝功能衰竭。病例2、病例4患儿出现血尿、少尿甚至无尿,肌酐及尿素氮持续升高,并发肾衰竭。病例1进行血浆置换(plasma exchange,PE),血浆置换量为200~250 mL/kg,病例2使用连续肾脏替代疗法治疗,病例4应用血浆置换+连续肾脏替代疗法治疗。机器使用Fresenius Multifiltrate,连接方法为与ECMO管路并联,ECMO离心泵前依次连接静脉端和动脉端,可精确控制血流速度及连续肾脏替代疗法的超滤速度,值得注意的是滤器先使用肝素盐水预充,随后血浆置换使用血浆预充,连续肾脏代替疗法使用红细胞悬液预充,减少并联管道对患儿容量及循环影响。
2.2.4 手术切口护理
ECMO辅助下实施CDH手术,患儿禁食时间长、脏器回纳腹腔导致腹压增加,皮肤水肿等影响,手术切口愈合慢。护理上需注意伤口渗血及渗液情况,及时换药,使用肌松药减轻腹压、镇静药物减少患儿躁动。如切口分泌物异常,及时行细菌培养,使用抗生素。4例患儿无伤口裂开,但渗血、渗液超过1周。
2.2.5 营养支持
CDH患儿术后腹腔压力增大,需ECMO辅助的重症患儿易出现消化道出血及全身水肿,肠内喂养延迟可能导致正常肠道菌群建立受阻,胃肠道的缺氧缺血易导致坏死性小肠结肠炎(NEC)的发生[9]。肠内营养使用微量持续管饲开始,患儿耐受后增加奶量,逐步过渡为经口喂养。存活的病例1术后3 d开始肠内微量喂养,但出现了腹胀,腹腔引流管引出消化液,术后45 d才达到全肠内营养。病例3术后7 d开始喂养,也出现早期NEC表现,因此奶量应缓慢增加,术后31 d达全肠内营养。
肠外的营养供给方案是:输葡萄糖速度为8~10 mg/(kg·min),氨基酸3g/(kg·d),脂肪乳1 g/(kg·d),脂肪乳用量较正常少,为了防止ECMO系统内脂肪栓塞的发生,甚至有学者认为ECMO期间不必静脉输入脂肪乳。长时间静脉营养的使用,要切实做好医院感染防控工作,避免导管相关感染发生[10]。
2.2.6 出院前评估及出院后随访
胃食管反流、营养不良常发生在存活的CDH患儿中,出院前医护人员应指导家长喂养时的注意事项,观察患儿有无呼吸困难。吃奶后有无腹胀、呕吐及排便情况,有异常情况及时返院检查[11]。有ECMO支持病史的患儿存在神经发育风险,建议行头颅核磁共振检查,并长期随访[12]。
3 小结
通过产前诊断中心、产科、新生儿外科重症监护室、手术室等多学科的共同合作,常规呼吸及循环支持无效的CDH患儿通过ECMO辅助治疗,有了存活的希望。但ECMO辅助下手术治疗技术专业性强,并发症多,围术期管理及临床护理工作要求高、难度大。通过细致的治疗及护理,及时发现并发症并采取有效的干预措施,有望改善患儿预后。