棉花黄萎病菌细胞壁几丁质和壳聚糖构成分析
张博森,赵汗青,高峰
(新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室/石河子大学农学院,新疆 石河子 832003)
几丁质是真菌细胞壁的重要组分,同时也是自然界中存在最丰富的天然多糖之一[1]。细胞壁作为真菌的细胞外骨架结构不仅在维持细胞形态、帮助细胞抵抗外界不良环境发挥重要作用[2],同时也在病原真菌的生长发育、入侵新的生态域、启动宿主免疫反应中也起重要作用[3-5]。因此,细胞壁组分是开发抗真菌药物的理想靶标[6,7]。
棉花黄萎病是由半知菌亚门真菌大丽轮枝菌引起土传维管束病害,该菌可以侵染包括棉花、向日葵、马铃薯在内的200多种重要经济作物[8]。由于棉花黄萎病菌具有变异快、抗逆性强、陆地棉中缺乏抗原等特点,目前没有有效的防治手段[9],被广大棉农称为“棉花癌症”。
壳聚糖是几丁质在几丁质脱乙酰酶作用下脱掉乙酰基后的产物[10],多项研究[11,12]表明几丁质和壳聚糖在真菌和果蝇不同发育阶段的细胞壁构成中是一个动态变化的过程。例如稻瘟菌分生孢子萌发产生芽管的细胞壁主要成分并不是几丁质而是壳聚糖[12]。本课题组前期研究[13]发现,大丽轮枝菌基因组中编码6个几丁质脱乙酰酶,但是大丽轮枝菌不同发育阶段的细胞壁中几丁质和壳聚糖的构成尚未见报道。
卡尔科弗卢尔荧光增白剂染液(Calcofluor White Stain,CFW)能与含β-1,4-糖苷键的几丁质结合,可吸收紫外光,使菌丝和孢子发出明亮的荧光,其荧光强度与结合几丁质的量成正比,在荧光显微镜下可直接进行观察[14,15]。壳聚糖抗体是近期开发的一种特异性结合壳聚糖的抗体,因其与Alexa 488耦合,可被488 nm的激光激发出明亮的荧光,其荧光强度与结合壳聚糖的量成正比,可在荧光显微镜下直接观察[11]。因此使用CFW染色和壳聚糖抗体标记技术研究大丽轮枝菌棉花黄萎病菌不同发育阶段细胞壁中几丁质和壳聚糖的构成具有技术可行性,同时本研究对于深入了解其发育生物学具有重要意义。
1 材料与方法
1.1 试验材料
供试野生型菌株为强致病力大丽轮枝菌菌株V592(由石河子大学植物病理教研室提供)。
壳聚糖抗体(偶联Alexa Fluor fluorophore 488)由本实验室制备;Calcofluor White Stain购自Sigma-Aldrich(CAS:18909);纤维素膜购自索莱宝(CAS:YA0620),NaNO3、K2HPO4和柠檬酸等其他常用试剂均为国产或者进口分析纯试剂。
1.2 实验所需培养基
PDA(potato dextrose agar)培养基、Czapek′s液体培养基参照Zhao[16]的方法配置。
M0固体培养基:NaNO32 g,KH2PO41 g,MgSO4-7H2O 0.5 g,KCl 0.5 g,柠檬酸 10 mg,ZnSO4-7H2O 10 mg,FeSO4-7H2O 10 mg,NH4Fe(SO4)2-12H2O 2.6 mg,CuSO4-5H2O 0.5 mg,MnSO4-H2O 0.1 mg,H3BO30.1 mg,Na2MoO4-2H2O 0.1 mg,葡萄糖 2 g,1.5%琼脂,加蒸馏水至1 L,113 ℃,高压灭菌20 min[17]。
1.3 样品准备
分生孢子:将6~8块直径为约为1 cm的V592菌株的菌饼接种于Czapek′s液体培养基中,26 ℃,200 rpm避光摇培2 d,经4层纱布过滤收集孢子。将收集好的孢子悬浮于20%的甘油中,终浓度为1×108 cfu/ml。
芽管:将制备的分生孢子滴在载玻片上,26 ℃避光孵育2 h,使孢子在载玻片上萌发形成芽管,期间通过显微镜观察确定其萌发状态。
菌丝:用无菌刀片在V592菌株的菌落边缘划取直径约为5 mm的菌饼,倒置于载玻片上,将载玻片置于培养皿内,26 ℃避光保湿培养72 h。
侵染结构的诱导:将纤维素膜平铺于M0培养基上,将制备好的V592孢子接种于纤维素膜上,然后26 ℃避光培养72 h后,用手术刀切取部分长有菌丝的纤维素膜置于载玻片上备用。
1.4 几丁质和壳聚糖的标记和观测方法
探针孵育:将壳聚糖抗体母液按照1∶1000的比例稀释于PBS中,然后将待观测样品在稀释好的探针中室温、避光孵育15 min后,用PBS溶液漂洗3遍,确保将非结合状态的抗体冲洗干净[11]。
检测使用激光共聚焦显微镜Leica SP8使用100倍油镜,Alexa Fluor fluorophore 488使用488 nm激光激发,最大发射波长为617 nm。被壳聚糖抗体标记上的壳聚糖,在488 nm下可激发出绿色荧光。
CFW染色:将待观测放置于含有10% KOH的Calcofluor White Stain中,盖上盖玻片室温、避光孵育1 min[18]。
检测使用激光共聚焦显微镜Leica SP8使用100倍油镜,CFW使用UV 405 nm 激光激发,最大发射波长为500 nm。被CWF标记上的几丁质,在405 nm下可激发出蓝色荧光。
2 结果与分析
2.1 大丽轮枝菌分生孢子细胞壁中几丁质和壳聚糖的观测
分别用CFW和 壳聚糖抗体对分生孢子细胞壁进行染色和观测,结果见图1,在没有萌发的孢子的细胞壁中含有几丁质(图1 A);通过特异性结合壳聚糖的探针标记没有检测到分生孢子的细胞壁上具有壳聚糖(图1B)。这些结果表明,在大丽轮枝菌的分生孢子的细胞壁的组分中只含有几丁质,而没有壳聚糖。
2.2 大丽轮枝菌萌发状态下的分生孢子细胞壁几丁质和壳聚糖的检测
分别用CFW和壳聚糖抗体对萌发状态下的分生孢子细胞壁进行染色和观测,结果如图2所示。大丽轮枝菌的分生孢子除萌发点细胞壁没有几丁质外,其它位置均含有几丁质(图2 A);而抗体标记的壳聚糖主要存在于分生孢子的萌发点位置(星号标记的位置)(图2B)。上述结果表明,在大丽轮枝菌分生孢子萌发过程中,萌发点位置细胞壁的几丁质需要被脱乙酰化形成壳聚糖。

A—CFW染色分生孢子细胞壁几丁质;B—壳聚糖抗体标记分生孢子细胞壁壳聚糖。图1 大丽轮枝菌分生孢子染色和探针标记Fig.1 Conidia staining and labeling in V.dahliae
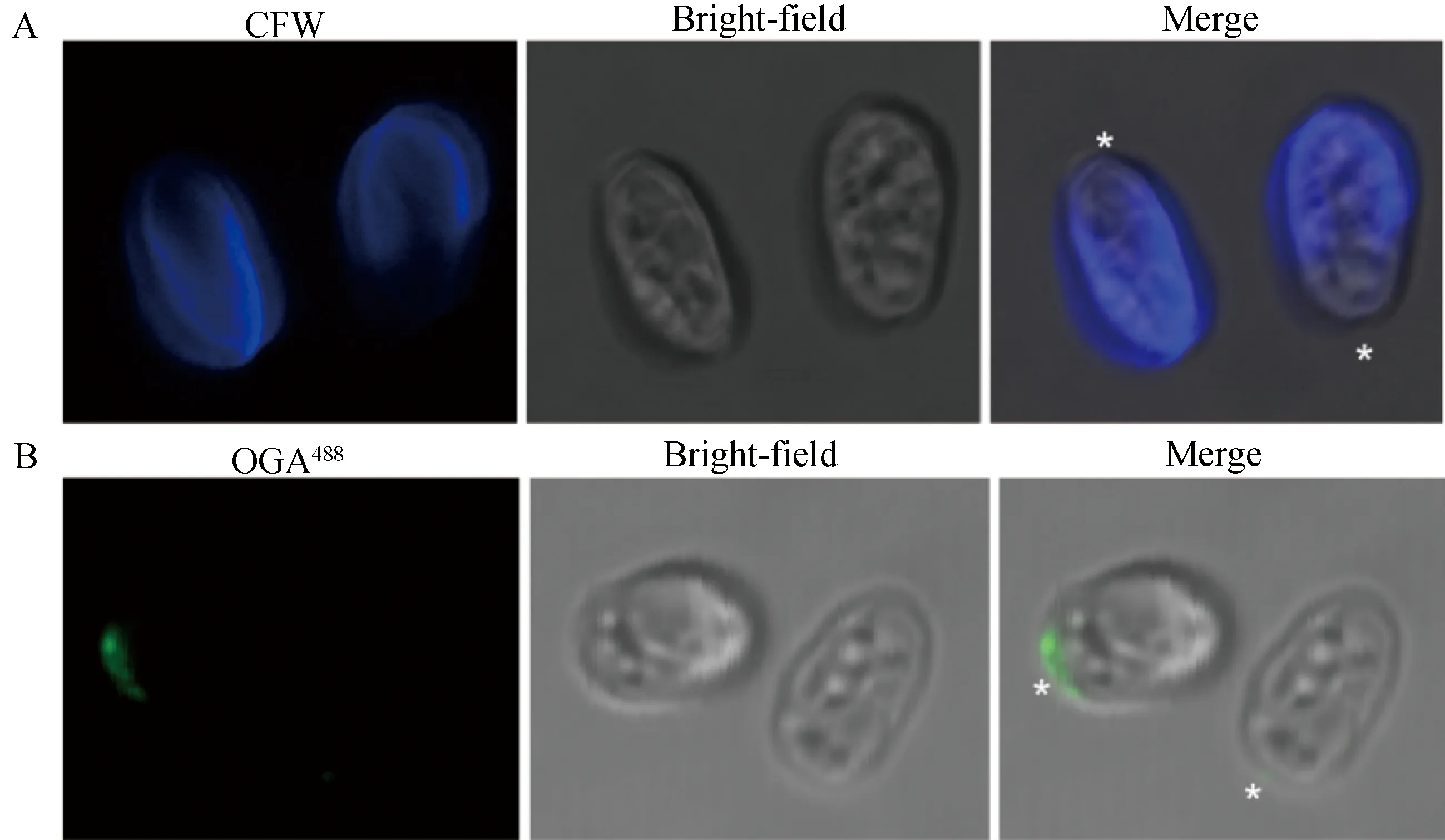
A—CFW染色分生孢子萌发细胞壁几丁质;B—壳聚糖抗体标记分生孢子萌发细胞壁壳聚糖;星号*指示萌发点。图2 大丽轮枝菌孢子萌发染色和探针标记Fig.2 Conidia germinationstaining and labeling in V.dahliae
2.3 大丽轮枝菌芽管细胞壁几丁质和壳聚糖的检测
大丽轮枝菌的芽管细胞壁的染色和观测结果见图3。经CFW染色后,大丽轮枝菌芽管细胞壁上出现蓝色荧光,但强度弱于分生孢子,说明芽管细胞壁上存在几丁质但含量低于分生孢子细胞壁(图3A);经壳聚糖抗体标记后,观测发现芽管细胞壁中存在壳聚糖(图3B)。这些研究结果表明,芽管细胞壁组分中几丁质和壳聚糖是同时存在的。
2.4 大丽轮枝菌菌丝细胞壁几丁质和壳聚糖检测
大丽轮枝菌的菌丝细胞壁的标记和观测结果见图4,大丽轮枝菌菌丝细胞壁上存在几丁质(图4A)的同时也存在壳聚糖(图4B),但隔膜上只存在几丁质而不存在壳聚糖(图4B)。
2.5 大丽轮枝菌侵染结构的细胞壁几丁质和壳聚糖检测
大丽轮枝菌侵染结构细胞壁染色和标记的结果见图5,侵染结构细胞壁组分中是几丁质与壳聚糖是一种共存状态。

A—CFW染色芽管细胞壁几丁质;B—壳聚糖抗体标记芽管细胞壁壳聚糖。图3 大丽轮枝菌芽管染色和探针标记Fig.3 Germ tubestaining and labeling in V.dahliae

A—CFW染色菌丝细胞壁几丁质;B—壳聚糖抗体标记菌丝细胞壁壳聚糖。图4 大丽轮枝菌细胞壁的染色和探针标记Fig.4 Myceliumstaining and labeling in V.dahliae

A—CFW染色侵染钉细胞壁,星号指示的是侵染钉;B—壳聚糖抗体标记附着枝细胞壁,星号指示的是附着枝。图5 大丽轮枝菌侵染结构细胞壁的染色和探针标记Fig.5 Hyphopodia and penetration pegsstaining and labeling in V.dahliae
3 结论与讨论
本文对大丽轮枝菌不同发育阶段细胞壁中几丁质和壳聚糖的构成进行了研究,研究结果表明,不同发育阶段的细胞壁中几丁质和壳聚糖的含量是一个动态变化过程。
在实验操作过程中,因为Alexa 488是一种化学荧光染料,在室温和光照条件下容易降解和猝灭,所以在使用壳聚糖抗体过程中要注意缓冲体系的PH值,在储存探针和标记过程中要全程避光并且在冰上操作,标记完成后要使用干净的PBS溶液进行多次冲洗,这样才能得到比较理想的观测结果。
我们观测发现,大丽轮枝菌分生孢子萌发前,萌发点位置细胞壁中几丁质转换成了壳聚糖,产生的芽管细胞壁中几丁质含量相比壳聚糖也明显偏低,这与稻瘟菌的研究[12]相一致。在酵母(S.cerevisiae)及隐球菌(C.neoformans)的研究[19,20]中发现,在缺少壳聚糖的情况下,分生孢子的生长并没有受到影响,但细胞壁的稳定性受到了很大的破坏,说明壳聚糖对细胞壁的稳定性有着至关重要的影响。因此,我们推测在壳聚糖出现在芽管和萌发点位置的细胞壁上可能与细胞结构的稳定性相关。侵染结构是病原与寄主互作的最主要界面,在大丽轮枝菌的侵染结构细胞壁中存在一定量的壳聚糖,我们推测这可能与轮枝菌逃避寄主来源的几丁质酶对细胞壁的剪切相关。

