一株强致病力软腐病菌鉴定与室内药剂筛选
李苗苗 伍翔 严准 吴中军 高春生 刘新宇 程毅


摘要 通过对从湘西武陵山区感病萝卜分离的一株软腐病菌进行致病力测定,结合萝卜软腐病菌的培养特性、菌体形态观察、生理生化测定及6个看家基因(gapA, icdA, pgi, rpoS, mdh, proA)的多位点序列分析(MLSA),结果表明,病原细菌Secpp 1600属革兰氏阴性菌,呈杆状,致病力强,可侵染分属8科13个属的多种经济作物;与迪基氏菌Dickeya fangzhongdai菌株高度同源。选用7种药剂通过抑菌圈法对Secpp 1600进行了抑菌效果初步测定,结果表明,农用链霉素、SPP3和SPP4 可抑制病菌生长,药剂间抑菌率存在显著差异,其中,SPP4的直接抑菌效果最好,最小抑制浓度为900 μg/mL。
关键词 软腐病菌; 看家基因; 迪基氏菌属; MLSA; 最小抑菌浓度
中图分类号: S 436.31
文献标识码: A
DOI: 10.16688/j.zwbh.2018365
细菌性软腐病菌主要来自于欧文氏菌属Erwinia、果胶杆菌属Pectobacterium 和迪基氏菌属Dickeya,其中许多属于强致病性软腐细菌,Dickeya在国际上被列为十大植物病原细菌之一[1],这些致病菌可导致多种作物及园艺产品软腐病的发生,其中,Pectobacterium和Dickeya属可以侵染50%的被子植物,寄主范围非常广泛,比如水稻、玉米、马铃薯、甘薯、番茄和萝卜等[23]。当软腐病菌不引起疾病时,可以作为内生菌、附生菌和腐生菌生存,全世界农业区的植物、土壤、新鲜地表水、地下水和昆虫中均有发现。软腐病的发生和发展受环境因素的调节,比如温度、低氧等。
近年来,以萝卜、白菜及结球甘蓝等喜爱冷凉气候的十字花科大宗蔬菜为主的高山蔬菜因其独特的地理环境产地和优良品质而逐渐兴起,可以弥补南方地区的“伏缺”,种植面积逐年增加。但是由于连年种植和结构单一,导致近些年病害日趋严重,大大影响了高山蔬菜的产量及品质[45]。其中,软腐病对萝卜的危害主要发生在根茎、叶柄及叶片,多发生在其生长后期及采后贮藏期;在生长期,一般从根尖发病蔓延至整个根部软腐,呈烂泥状,然后向上蔓延致叶片变黑褐色软腐;萝卜染病部位呈烂泥状,发出难闻的恶臭。连种、雨水多、湿度大、根部开裂及地下害虫等可加重软腐病的发生。
本研究通过细菌形态观察、致病力测定、生理生化鉴定结合MLSA-多位点序列分析鉴别了一株来自湘西高山地区的软腐病致病菌,并对该病菌进行了室内防治药剂筛选,旨在为生产中萝卜软腐病的防治提供参考。
1 材料和方法
1.1 试验材料
供试菌株Secpp 1600从湖南湘西武陵山区高山感病萝卜分离得到。
供试药剂:6%春雷霉素可湿性粉剂(上海立邦农化有限公司),80%波尔多液可湿性粉剂(通州正大农药化工有限公司),72%农用链霉素可湿性粉剂(山东百士威农药有限公司)和以噻唑锌为主要有效成分的复配高效杀菌组合物SPP1~SPP4(北京图为生物科技有限公司)。
1.2 病原菌回接与侵染试验
基于柯赫氏法则,常温无菌条件下将该菌株回接至萝卜活体中,观察发病特征。为进一步了解该菌株致病力大小与侵染范围,将该菌株依次接入白菜Brassica pekinensis、结球甘蓝B.oleracea、紫薯Ipomoea batatas、杏鲍菇Pleurotus eryngii、马铃薯Solanum tuberosum、蒜(地上及地下部分)Allium sativum、葱A.fistulosum、冬瓜Benincasa hispida等分属于8科13个属的作物植株,约16 h后观察症状并统计发病情况,软腐病病情分级如下:0级,无病斑;1级,病斑占样品体积1/4及以下;2级,病斑占样品体积1/2及以下且大于1/4体积;3级,病斑占样品体积3/4及以下且大于1/2体积;4级,病斑占样品体积3/4以上,但是并未达到全部软腐;5级,样品全部软腐[6]。
1.3 病原鉴定
1.3.1 菌体形态观察及生理生化鉴定
将纯化培养的菌株Secpp 1600划线接种于LB培养基,34℃培养过夜,观察并记录菌株生长状况及形态特征[7]。参照Suharjo等文献进行革兰氏染色、葡萄糖氧化发酵鉴定、在Kings B培养基上产生荧光色素的鉴定[8]、细菌氧化酶试验[9]、酪蛋白水解[10]、硝酸还原反应、过氧化氢酶、明胶液化、卵磷脂酶活性鉴定、硫化氢的产生、利用包含甲基绿和酚酞二磷酸酯的LB培养基鉴定致病菌磷酸酶活性[1112]、吲哚产生及MR-VP试验,利用Ayers等基础培养基鉴定28种含碳有机物是否可作为该菌株的碳源[13],所有生理生化试验至少设置3次重复,并设置对照试验。
1.3.2 MLSA-多位点序列分析
从本课题组已获得的Secpp 1600全基因组注释信息以及NCBI数据库中提取gapA, icdA, pgi, rpoS, mdh和proA 6个看家基因的序列信息[14]。通过BLASTn与GenBank中数据进行比对获取同源序列,或者从ASAP数据库获取Dickeya, Erwinia和Pectobacterium 属相关同源序列,用Mega X软件进行多重比对,用Sequence Maxtrix 軟件联合各位点序列[15],再转到Mega X中采用邻接法(neighbor-joining method,NJ) 构建系统发育树,利用iTOL在线工具制作进化树[16],根据多位点进化树结果来分析Secpp 1600与同属其他菌株及其他属菌株的亲缘关系,以确定分类地位。
1.4 不同药剂对Secpp 1600的室内防效测定
Secpp 1600于LB液体培养基34℃培养过夜,按菌悬液与液体培养基1∶10(V∶V)的比例,将菌悬液加入到约30~40℃的LB固体培养基,制成含菌平板。
供试药剂均设置为400倍、700倍和1 000倍3个浓度梯度,其质量浓度分别约为2 500、1 500和1 000 μg/mL,以无菌去离子水处理作为对照,每个浓度均设置3次重复。
以抑菌圈法进行药剂初选,用打孔器在新鲜的含菌平板上垂直、均匀地打出8个直径0.5 cm的孔,分别注入约40 μL相同浓度的供试药剂,加入等量的无菌水作为空白对照,34℃培养24 h,以十字交叉法测量抑菌圈直径,计算抑菌率,并利用IBM SPSS 21进行了两因素单变量的方差分析。
抑菌率=处理抑菌圈直径-对照抑菌圈直径处理抑菌圈直径×100%
利用比浊法进行有效药剂毒力测定,药剂均设置至少5个梯度,以倍比法稀释得到,按药液与LB液体培养基1∶4 (V∶V)的比例将药液加入培养基,并加入10 μL菌悬液,每个浓度梯度重复3次,设置阴性及阳性对照,37℃培养,当阳性对照OD600为0.5时,用酶标仪测所有处理吸光度,计算抑菌率,抑菌率接近1的最低浓度为最小抑菌浓度。
2 结果与分析
2.1 致病菌形态观察
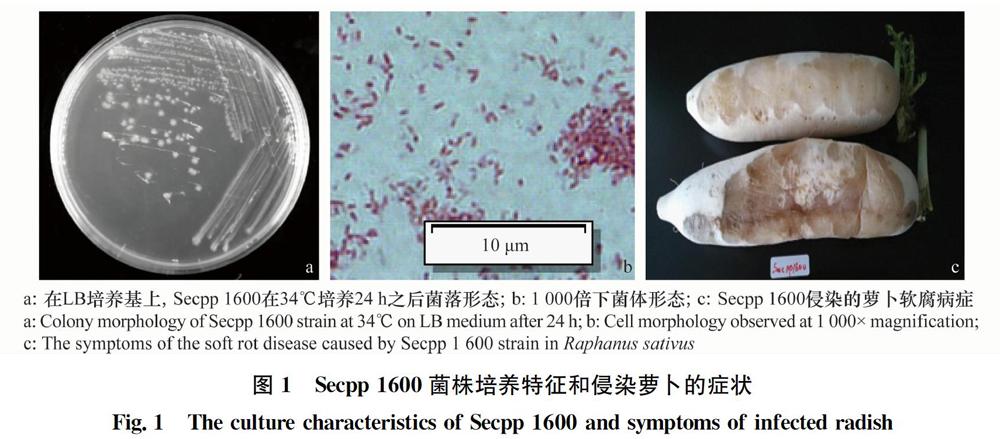
Secpp 1600在LB固体培养基上34℃培养24 h,菌落多呈圆形,全缘,淡奶油色,中间突起,质地均匀,表面光滑稍透明(图1a),经革兰氏染色鉴定为革兰氏阴性细菌,呈杆状(图1b)。
2.2 侵染范围与致病力测定
结果显示,回接到萝卜的Secpp 1600致病力明显,受侵染的萝卜全部软腐甚至变软流水(图1c),与田间症狀一致。通过观察侵染其他蔬菜病症及统计致病力,发现Secpp 1600不侵染紫薯、杏鲍菇;对其他的蔬菜侵染较明显,能重度侵染蒜、葱、白菜,对上述蔬菜具有强致病力(表1)。
2.3 生理生化指标分析
通过生理生化指标测定与分析,发现Secpp 1600能氧化发酵葡萄糖,在Kings B培养基上不能产生荧光色素,在硝酸还原、卵磷脂试验、吲哚产生、MR-VP试验、氧化酶活性和酪蛋白水解试验中均表现为阳性。在硝酸还原试验中,Secpp 1600直接还原NO3-到氮气;Secpp 1600不能产生过氧化氢酶;Secpp 1600能利用D-(-)果糖、α-D-乳糖、D-(+)-棉籽糖等,不能利用D-(+)-海藻糖、D-(+)-松三糖、β-龙胆二糖等,能微弱地利用D-(+)-麦芽糖、糊精(表 2)。以上结果显示,在重要的含碳有机物代谢的种间差异指标上,根据Samson等展示的结果,Secpp 1600与“Phenon1”的测定结果类似,该菌株能代谢β-龙胆二糖[3];根据Van der Wolf等展示的结果,该菌株与D.solani和D.dadantii subsp. dadantii结果类似[17];根据Parkinson等展示的结果,该菌株与D.dadantii subsp. dadantii NCPPB 898T的结果类似[18],不同的是Secpp 1600能水解酪蛋白;根据胡白石等展示的结果,该菌株与D.dadantii subsp. dadantii NCPPB898、 D.fangzhongdai、D.solani NCPPB4479T和D.zeae NCPPB3531特征类似,不同之处在于β-龙胆二糖代谢和酪蛋白的水解[19]。因此,根据以上结果可以初步明确Secpp 1600属于Dickeya属,但是由于含碳有机物代谢上的差异还不足以确定其种名。
2.4 MLSA-多位点序列分析
通过BLASTn比对,从GenBank中获取Secpp 1600、D.dadantii DSM 18020、D.dadantii 3937、D.zeae Ech586等菌种的同源基因同源序列,部分序列号如表3所示,从ASAP数据库获取其他菌株部分相关序列如表3所示。
通过6个看家基因gapA, icdA, pgi, proS, mdh和proA联合系统进化树结果分析(图2),Dickeya、Erwinia和Pectobacterium属的菌株分别以较高的Bootstrap value聚在不同分支,说明同属的菌株亲缘关系较近。Dickeya sp.Secpp 1600和D.fangzhongdai DSM 101947聚类在亲缘关系最近的一个分支,Bootstrap value达100,序列同源性较高,两个菌株亲缘关系较近,与生理生化结果基本统一。
2.5 杀菌剂的室内防效测定
预筛选药效试验表明,春雷霉素、波尔多液、SPP1和SPP2对病原菌没有抑菌作用;农用链霉素、SPP3和SPP4可抑制病菌生长,其中农用链霉素与SPP4抑菌效果较好,与SPP3药剂抑菌效果差异显著(P<0.05);在这3种药剂处理中,不同梯度间抑菌效果无显著差异(表4);抑菌圈效果如图3所示。
选取农用链霉素、SPP3及SPP4通过比浊法进行了最小抑制浓度(MIC)测定。结果显示(表5),MIC分别为1 080、1 800和900 μg/mL,SPP4 MIC最低,毒力最强,其次为农用链霉素,最后为SPP3。
3 结论与讨论
Dickeya是由Samson等于2005年对 “E.chrysanthemi complex”重新分类成立的新属[3],其中一些菌种的分类地位一直在修订,新种也在不断加入。Brady、Van der Wolf、Parkinson等先后利用生理生化鉴定方法、DNA杂交、16S rDNA序列比对、多基因联合系统发育分析和核苷酸一致性分析等鉴定方法丰富了D.dadantii、D.solani、D.aquatica等菌种[1718,20]。胡白石等利用以上类似方法及脂肪酸分析等成立了包含3个菌株的D.fangzhongdai新种[19]。当前Dickeya属主要包括D.dadantii, D.chrysanthemi, D.solani和D.zeae等8个种[21]。微生物分类的动态发展大大促进了高度同源的Dickeya属菌种鉴定方法体系的形成,以上研究为软腐病菌的鉴别、鉴定提供了重要的理论依据和技术支持。但是该种种水平的分类仍然存在一定的争议。
对Secpp 1600进行生理生化鉴定的结果表明,Secpp 1600与D.dadantii、D.fangzhongdai, D.solani和D.zeae菌株特征非常类似,主要差异在于β-龙胆二糖代谢和酪蛋白的水解。从多序列比对的结果来看其聚类在Dickeya属,与 D.fangzhongdai、D.solani和D.dadantii关系最近。
当前,化学防治仍为细菌性病害防治的主要手段,铜制剂和抗生素为代表性药剂。目前抑菌效果显著的农用链霉素因禁用现已退市,随着软腐病情的加剧及病菌抗性增强,新药开发及筛选迫在眉睫;而且对于突发性病害,化学防治手段十分必要[22]。本研究为了筛选Dickeya sp. Secpp 1600防治药剂,选用了传统药剂及新药共7种药剂进行室内防效测定,结果显示春雷霉素、波尔多液、SPP1和SPP2对该病原菌无直接抑制作用,农用链霉素、SPP3和SPP4可直接抑制该病菌的生长。SPP4的最小抑制浓度远小于农用链霉素,也表明其有替代农用链霉素和进一步开发的潜力。通过回接到萝卜及对其他蔬菜的致病力检测,该菌株能严重侵染多种经济作物,易感寄主主要为十字花科和百合科蔬菜,因此,该菌株具有潜在的危害多种经济作物的能力,应重视对该病害的预防,防治上要有侧重和策略,作物轮作应避开易感作物,并及时清洁田园。
参考文献
[1] MANSFIELD J, GENNIN S, MAGORI S, et al. Top 10 plant pathogenic bacteria in molecular plant pathology [J]. Molecular Plant Pathology, 2012, 13(6):614629.
[2] MA B, HIBBING M E, KIM H, et al. Host range and molecular phylogenies of the soft rot enterobacterial genera Pectobacterium and Dickeya[J]. Phytopathology, 2007, 97(9):11501163.
[3] SAMSON R, LEGENDRE J B, CHRISTEN R, et al. Transfer of Pectobacterium chrysanthemi (Burkholder et al. 1953) Brenner et al. 1973 and Brenneria paradisiaca to the genus Dickeya gen. nov. as Dickeya chrysanthemi comb. nov. and Dickeya paradisiaca comb. nov. and delineation of four novel species, Dickeya dadantii sp. nov., Dickeya dianthicola sp. nov., Dickeya dieffenbachiae sp. nov. and Dickeya zeae sp. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(4):14151427.
[4] 邱正明,郭凤领,聂启军,等.我国高山蔬菜产业可持续发展对策[J].长江蔬菜,2006(11):14.
[5] 别之龙.高山蔬菜发展的背景和可持续发展的建议[J].长江蔬菜,2006(11):56.
[6] 王文峰,张秀玲,司東霞,等.钾对大白菜软腐病发生及保护酶活性的影响[J].安徽农业科学,2017,45(33):3941.
[7] 邹婧泽,严准,程毅,等.三个萝卜主产区软腐病病原菌的分离与鉴定[J].湖北农业科学,2016,55(23):61306133.
[8] KING E O, WARD M K, RANEY D E, et al. Two simple media for the demonstration of pyocyanin and fluorescin[J]. Translational Research, 1954, 44(2):301307.
[9] KOVACS N. Identification of pseudomonas pyocyanea by the oxidase reaction [J]. Nature, 1956, 178(4535):703.
[10]MOSCA C O, MORAGUES M D, LLOVO J, et al. Casein agar: A useful medium for differentiating Candida dubliniensis from Candida albicans [J].Journal of Clinical Microbiology, 2003, 41(3):12591262.
[11]SATTA G, GRAZI G, VARALDO P E, et al. Detection of bacterial phosphatase activity by means of an original and simple test [J].Journal of Clinical Pathology,1979,32(4):391395.
[12]FALGUNI P, SHARMA M C. Study on microbial alkaline phosphatase production from north gujarat field soils [J]. International Journal of Institutional Pharmaceutical Sciences, 2014, 4:8391.
[13]RADIX S, SAWADA H, TAKIKAWA Y. Phylogenetic study of japanese Dickeya spp. and development of new rapid identification methods using PCR-RFLP[J]. Journal of General Plant Pathology, 2014, 80(3):237254.
[14]晋知文, 宋加伟, 谢学文, 等. 芹菜细菌性软腐病病原的分离与鉴定[J]. 植物病理学报, 2016, 46(3):304312.
[15]VAIDYA G, LOHMAN D J, MEIER R. SequenceMatrix: concatenation software for the fast assembly of multi-gene datasets with character set and codon information [J]. Cladistics, 2011, 27(2):171180.
[16]LETUNIC I, BORK P. Interactive tree of life (iTOL) v3: an online tool for the display and annotation of phylogenetic and other trees [J].Nucleic Acids Research,2016,44(W1):242245.
[17]VAN DER WOLF J M, NIJHUIS E H, KOWALEWSKA M J, et al. Dickeya solani sp. nov., a pectinolytic plant-pathogenic bacterium isolated from potato (Solanum tuberosum) [J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(PART 3):768774.
[18]PARKINSON N, DEVOS P, PIRHONEN M, et al. Dickeya aquatica sp. nov., isolated from waterways [J]. International Journal of Systematic and Evolutionary Microbiology, 2014,64(PART 7):22642266.
[19]TIAN Yanli, ZHAO Yuqiang, YUN Xiaoli, et al. Dickeya fangzhongdai sp. nov., a plant-pathogenic bacterium isolated from pear trees (Pyrus pyrifolia) [J].International Journal of Systematic and Evolutionary Microbiology,2016,66:28312835.
[20]BRADY C L, CLEENWERCK L, DENMAN S, et al. Proposal to reclassify Brenneria quercina (Hildebrand and Schroth 1967) Hauben et al.1999 into a new genus, Lonsdalea gen. nov., as Lonsdalea quercina comb. nov., descriptions of Lonsdalea quercina subsp. quercina comb. nov., Lonsdalea quercina subsp. iberica subsp. nov. and Lonsdalea quercina subsp. britannica subsp. nov., emendation of the description of the genus Brenneria, reclassification of Dickeya dieffenbachiae as Dickeya dadantii subsp. dieffenbachiae comb. nov., and emendation of the description of Dickeya dadantii[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(7):15921602.
[21]馮洁. 植物病原细菌分类最新进展[J]. 中国农业科学, 2017, 50(12):23052314.
[22]晋知文, 谢学文, 马墨, 等. 蔬菜细菌性软腐病防治药剂活体组织筛选技术[J]. 植物保护学报, 2017, 44(2):269275.
(责任编辑:田 喆)

