醋酸纤维素薄膜电泳法分离血清蛋白质实验方法优化
汪艳杰,许国权,郭 瑞,胡志辉
(江汉大学 生命科学学院,湖北 武汉 430056)
电泳法是生物化学中非常重要的一项技术。醋酸纤维素薄膜电泳由于其微量、快速、简便、分辨力高等优点,被广泛应用于血清蛋白、糖蛋白等生物大分子的分离与检测。其中醋酸纤维素薄膜电泳分离血清蛋白实验是采用醋酸纤维素薄膜为支持物的电泳方法,醋酸纤维素是纤维素的羟基乙酰化所形成的纤维素醋酸酯,将其溶于有机溶剂(如丙酮、氯仿、氯乙烯、乙酸乙酯等)后,涂抹均匀的薄膜即为醋酸纤维素薄膜[1]。醋酸纤维素薄膜具有均一的泡沫状结构,具有以下优点:对蛋白质样品的吸附极少,分离条带清晰。由于醋酸纤维素薄膜亲水性比滤纸小,薄膜中所容纳的缓冲液也少,电泳时的电流是由样品传导的,分离速度快,所需时间短,一般60 min左右即可。染色后的薄膜可用乙醇和冰醋酸溶液浸泡透明,可以制成透明的干板,便于保存和定量分析。
用醋酸纤维素薄膜电泳法分离血清蛋白的主要原理是:血清中的各种蛋白组分分子量不同,以及在同一缓冲体系下所带净电荷也存在差异(当蛋白质的pH大于等电点时,该蛋白质带负电荷,在电场中向正极移动[2]),在同一电场下其泳动速率就不同,从而使血清中的各种蛋白组分得以分离[3]。但是,在醋酸纤维素薄膜电泳实验过程中,实验步骤相对较多,受人为操作因素和环境因素影响较大,因此,需对实验进行不断改进和完善,从而提高实验质量和效率。
1 材料与方法
1.1 试剂、薄膜及电泳槽
1.1.1 试剂配制 染色液:氨基黑B:0.5 g,甲醇50 mL,冰醋酸10 mL,蒸馏水40 mL,混匀。漂洗液:95%乙醇45 mL,冰醋酸5 mL,水50 mL。透明液:无水乙醇∶冰醋酸=7∶3。健康人血清(新鲜,无溶血现象)。
1.1.2 醋酸纤维素薄膜准备 取2 cm×8 cm的薄膜条若干,将薄膜小心地放入盛有缓冲液的培养皿内,使它漂浮在液面,用镊子轻压,使它全部浸入缓冲液内,待膜完全浸透(约30 min)后待用。

图1 实验中所用的醋酸纤维素薄膜
1.1.3 制作“滤纸桥” 剪裁尺寸合适的滤纸条,双层贴附在电泳槽的支架上,使滤纸条的一端与膜支架的前沿对齐,而另一端浸入电泳槽的缓冲液内。此电泳槽中间为负极,两端为正极。此外,一定要注意清除气泡,使滤纸紧贴在膜支架上。见图2。

图2 实验中所用的水平电泳槽及滤纸桥
1.2 点样
用镊子取出醋酸纤维素薄膜,夹在干净的滤纸中间,轻轻吸去多余的缓冲液,在膜的无光泽面上作好标记。把薄膜铺在载玻片上(无光泽面朝上),将盖玻片在血清中轻轻划一下(量薄薄一层最好),再在膜条无光泽面的一端1.5~2 cm处轻轻地水平落下并迅速提起,即在膜条上点上细条状的血清样品。见图3。
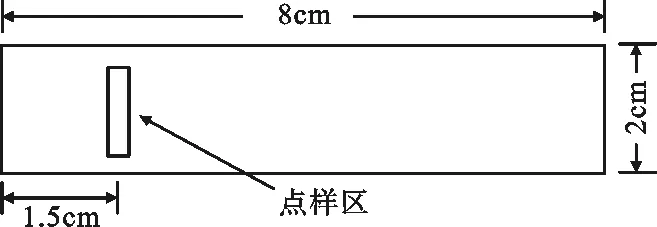
图3 醋酸纤维素薄膜点样位置
1.3 电泳
将已点样的薄膜使无光泽面向下,贴于电泳槽支架的“滤纸桥”上,薄膜一定要绷直,中间不能塌陷,盖上电泳槽盖之后,平衡10 min。以薄膜每厘米长度电压为10 V左右,薄膜每厘米宽的电流强度为 0.4~0.6 mA,通电时间为60 min。
1.4 染色
电泳完毕立即取出薄膜,直接浸入染色液中,染色10 min。
1.5 漂洗
将染色完毕的薄膜自染液中取出,自来水下冲洗除去多余的染色液后,直接放入漂洗液中,连续更换几次漂洗液,直到薄膜背景几乎无色为止。取出薄膜放在滤纸上,用吹风机将薄膜吹干。
1.6 透明
将脱色吹干后的薄膜进入透明液中,浸泡2~3 min后,取出紧贴于洁净玻璃板上,两者间不能有气泡,干后即为透明薄膜图谱。
2 结果与分析
2.1 点样质量控制
醋酸纤维素薄膜电泳实验中,点样非常关键,会直接影响电泳图谱的好坏。经过几年的教学实践,笔者对学生强调了几点细节,可以提高学生电泳图谱的成功率。主要有以下几个方面:①点样前薄膜要充分浸透缓冲液,笔者认为过夜浸泡更合适;②将薄膜夹在双层滤纸中轻压吸去表面的多余水分,一定要注意不要将薄膜水分吸至过干(薄膜发白),从而影响薄膜对血清蛋白的吸收,标准是薄膜表面没有明显的液体,如果薄膜发白则重新取一张新的薄膜;③自制点样器:有些教材使用的点样器是盖玻片,在实验中盖玻片点样量较大,电泳图谱效果不好。笔者选择的点样器是X光片裁制而成,边缘清晰,厚度适中,点样量适中,不能重复点样,点样结束后,点样处形成一条粗细均匀的淡黄色直线。见图4。
2.2 改善透明过程
用镊子将薄膜取出,贴在容器壁上(烧杯壁或培养皿上等),注意不可有气泡,用吹风机稍吹干薄膜,用胶头滴管淋洗薄膜,将每组20 mL透明液淋洗玩即可,再用吹风机将薄膜彻底吹干,此时薄膜透明,小心将薄膜自容器壁上取下,则成为可长期保存的血清蛋白醋酸纤维薄膜电泳图谱。
透明过程直接影响到电泳图谱的好坏,故对学生强调以下几点:将薄膜贴在平整的玻璃器皿表面,例如培养皿背面、烧杯外壁等等位置,注意薄膜与玻璃之间贴合紧密,无气泡存在。用胶头滴管将透明液滴在薄膜上,滴透明液的过程中易产生气泡,故对学生强调,将玻璃器皿稍微倾斜,倾斜角度不要过大,将透明液滴在薄膜表面。当薄膜呈现胶状时,停止滴加透明液,用吹风机热风吹干即可。
2.3 电压的影响
见图5,相同的血清样品在不同电压条件下,醋酸纤维素薄膜电泳的图谱有一定的差异,电压110 V时,条带清晰,电压90 V时,条带有些弥散。故在本实验条件下,110 V电压,电泳时间1 h,能够得到更为清晰的条带。

图4 自制点样器点样效果
图5 左侧电压110 V,右侧电压90 V
2.4 优化后的醋酸纤维素薄膜电泳图谱
一般透明后的薄膜上可显现清楚的5条区带,从正极端起,依次为清蛋白、α1球蛋白、α2球蛋白、β球蛋白和γ球蛋白。如图5所示,笔者对实验过程进行改进后,电泳图谱条带分离清晰,无拖尾现象,实验结果较为理想。

从上之下依次为:清蛋白、α1球蛋白、α2球蛋白、β球蛋白、γ球蛋白
3 实验中经常出现的错误结果及原因分析
3.1 条带拖尾现象严重
见图6,醋酸纤维素薄膜电泳图谱条带出现拖尾现象,原因是血清样品不是新鲜的,或者电泳时电流过大。
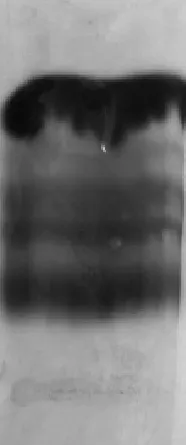
图7 条带拖尾的薄膜
3.2 条带未分开
有的醋酸纤维素薄膜电泳图谱条带未分开,但是其他同时进行的图谱条带正常分离,可能的原因是样品量过多,或者醋酸纤维素薄膜上的水分未用滤纸吸干,或者在点样完成后,样品未完全被薄膜吸收而发生位移或者迅速扩散,浓度降低而导致区带分散不集中[4]。
3.3 条带断裂不整齐
醋酸纤维素薄膜电泳图谱可以出现5条带,但是每条带中间出现断裂现象,如图7所示,是因为血清样品量较少,点样不均匀。故用点样器点样前,要确保点样器已经清洁干净,均匀沾取血清样品,观察点样器边缘的血清样品是否均匀完整。在实验正式开始前,让学生不断地练习正确点样过程,点样效果达到图4的效果后,再正式点样。否则会直接影响实验的最终结果。

图8 条带断裂
图9 条带歪斜
3.4 条带歪斜
见图8,醋酸纤维素薄膜电泳图谱歪斜,不整齐,出现这种现象的原因是点样时的点样区歪斜,或者将薄膜放置在电泳槽中时放置歪斜。
要想取得醋酸纤维素薄膜电泳实验的成功,对实验的每一步都应严格控制,尤其是点样和透明环节的控制与熟练程度,是实验成败的重要条件。控制好这两点,就会得到质量合格的电泳图谱,从而提高实验效率。

