没食子儿茶素没食子酸酯对脂肪细胞吸收葡萄糖的影响
张伟云,张 勇,徐晶晶,向云亚,陈全成
(1.厦门医学院药学系,福建 厦门 361023;2.厦门医学院机能与临床转化福建省高等学校重点实验室,福建厦门 361023;3.厦门大学 药学院,福建 厦门 361102)
降血糖作用是衡量某活性物质是否具有防治2型糖尿病能力的重要标准之一,选择快速、直接、客观、严谨的细胞葡萄糖吸收检测方法用以评估待测化学成分的降血糖活性具有十分重大的意义。葡萄糖荧光示踪剂2-[N-(7-硝基苯-2-氧代-1,3-重氮基-4-基)氨基]-2-脱氧-D-葡萄糖(2-NBDG)在467 nm波长被激发时,于542 nm波长处产生强烈的荧光,采用2-NBDG作为葡萄糖示踪剂,利用流式细胞仪直接检测单细胞吸收葡萄糖的方法[1],不但克服了放射性示踪剂无法测定单细胞吸收葡萄糖的缺点,同时也避免了放射性废物处理的问题[2],并且能够客观、快速、高效地获取试验数据。
3T3-L1前脂肪细胞被诱导分化为成熟的脂肪细胞后能促进外部环境中的葡萄糖消耗。胰岛素、胰岛素类似物与不同酶和受体相互作用,通过激活细胞和细胞核中的多个信号通路,进而加速成熟脂肪细胞对周围葡萄糖的吸收、运输、消耗,最终使细胞培养基中葡萄糖浓度降低。因而,3T3-L1前脂肪细胞系已被广泛应用于降糖药物筛选模型[3-5]。
研究表明,油茶醇提取物可在一定程度上降低2型糖尿病小鼠的血糖浓度[6],前期研究提示油茶醇提取物中的没食子儿茶素没食子酸酯很可能会在一定程度上加快细胞吸收葡萄糖。因此,本研究以罗格列酮为对照药,对没食子儿茶素没食子酸酯在3T3脂肪细胞中对葡萄糖吸收的影响及其对3T3-L1前脂肪细胞分化的作用进行了考察。
1 材料与仪器
1.1 药品
葡萄糖、胰岛素、罗格列酮均购买于Sigma-Aldrich; 没食子儿茶素没食子酸酯(纯度>98%)购买于成都瑞芬思生物科技有限公司。
1.2 试剂
油红O、苏木精-伊红溶液均购自Sigma-Aldrich;葡萄糖荧光示踪剂2-NBDG购自Molecular Probes。其他化学试剂均为分析纯。
1.3 仪器
试验中使用的主要仪器包括全波长酶标仪(Multiskan Go,美国赛默飞世尔科技有限公司); 流式细胞仪(FACS Calibur flowcytometer,美国Becton Dickinson公司); CO2恒温培养箱(IFS-110-8,新加坡Esco Micro Pte有限公司)。
1.4 细胞
小鼠源3T3-L1前脂肪细胞购自美国菌种保藏中心(ATCC),用10%胎牛血清DMEM在5%CO2加湿空气的细胞培养箱中于37℃进行培养,第5~9代细胞用于实验。
2 方法
2.1 细胞活力测定
使用MTT法检测,采用含有0.5 μM和1 μM没食子儿茶素没食子酸酯或罗格列酮的无血清DMEM处理48 h后,观察3T3-L1前脂肪细胞的生长及增殖的情况,于酶标仪490 nm波长下测定各组光密度值,设置空白对照组细胞对应的光密度值为100%。
2.2 没食子儿茶素没食子酸酯对脂肪细胞吸收葡萄糖的影响
参照文献方法操作[7-15],通过流式细胞仪测定没食子儿茶素没食子酸酯对葡萄糖荧光示踪剂2-NBDG吸收的影响。以1×104个细胞/孔的密度,将分化的3T3-L1脂肪细胞种于96孔细胞培养板,于含1 μM胰岛素的无血清高浓度葡萄糖(30 mM)的DMEM中培养24 h,再分别用0.5 μM和1 μM的没食子儿茶素没食子酸酯及罗格列酮和10 μM 2-NBDG处理1 h,对照组则用无血清DMEM处理1 h。将收集的各组细胞悬浮于预冷的500 μL无血清但含高浓度葡萄糖(30 mM)的DMEM中,保持在4 ℃,用流式细胞仪分析细胞吸收葡萄糖的情况,记录各组细胞吸收2-NBDG的荧光强度值。用没食子儿茶素没食子酸酯或罗格列酮处理但未加2-NBDG进行处理的对照组的细胞荧光强度分别作为其测量背景值,以排除假阳性。统计药物处理组的荧光强度值与背景值之差,以作后续数据分析。
2.3 油红O染色和脂积累量测定
参照文献[7-15]诱导3T3-L1前脂肪细胞分化。按照4×103细胞/孔的密度,将3T3-L1前脂肪细胞种于96孔细胞培养板,培养24 h后,再用含1 μM胰岛素和0.5 μM及1 μM的没食子儿茶素没食子酸酯或罗格列酮的培养基继续培养3 d,对照组细胞则用含1 μM胰岛素的培养基培养3 d,12天后,进行油红O染色和脂含量测定。用10%福尔马林溶液固定各组细胞1 h后,在室温下用油红O溶液染色2 h,接着用苏木精-伊红染色15 min。为了去除游离染料,用60%异丙醇溶液轻柔清洗各组细胞3次。应用全波长酶标仪在510 nm波长下测定各组细胞的脂积累量。在光学显微镜下拍摄(400×)各组细胞油红O的染色情况,用以对比和评估没食子儿茶素没食子酸酯对3T3-L1前脂肪细胞分化过程的影响。
2.4 统计学方法
3 结果
3.1 没食子儿茶素没食子酸酯对3T3-L1前脂肪细胞活力的影响
以空白对照组细胞光密度值为100%,与空白对照组相比,没食子儿茶素没食子酸酯和罗格列酮在0.5 μM和1 μM浓度下均对3T3-L1前脂肪细胞的生长和增殖没有显著影响,提示没食子儿茶素没食子酸酯和罗格列酮对3T3-L1前脂肪细胞无细胞毒性,不破坏细胞的生长和增殖。如图1所示。

图1 没食子儿茶素没食子酸酯对3T3-L1前脂肪细胞活力的影响(n=6)
3.2 没食子儿茶素没食子酸酯对葡萄糖吸收的影响
采用3T3-L1前脂肪细胞分化模型,测定没食子儿茶素没食子酸酯在3T3-L1脂肪细胞中对胰岛素刺激的葡萄糖荧光示踪剂2-NBDG吸收的作用。与对照组相比,0.5 μM和1 μM罗格列酮可显著促进在高浓度葡萄糖(30 mM)条件下3T3-L1脂肪细胞中胰岛素刺激的葡萄糖吸收(图2)。没食子儿茶素没食子酸酯在1 μM的浓度下也可显著增加3T3-L1脂肪细胞对胰岛素调节的2-NBDG吸收,并且比1 μM罗格列酮体现出更强的趋势。

注:n=6, 与对照组比较,** P< 0.01。
3.3 没食子儿茶素没食子酸酯对3T3-L1前脂肪细胞分化的影响
相对于空白对照组3T3-L1前脂肪细胞(图 3A),对照组细胞(图 3B)受到胰岛素的影响出现了少量成熟的脂肪细胞,新生成的成熟脂肪细胞被油红O染成红色。与对照组细胞(图 3B)相比,1 μM罗格列酮可明显加速脂肪分化,出现了较多成熟的脂肪细胞(图 3D),还可促进脂积累(图4)。在1 μM的浓度下,没食子儿茶素没食子酸酯也体现出与罗格列酮相似的活性,可明显促进脂肪分化(图3F),显著增加脂含量(图4)。

注:(A)空白组;(B)胰岛素处理组;(C)0.5 μM罗格列酮处理组;(D)1 μM罗格列酮处理组;(E)0.5 μM没食子儿茶素没食子酸酯处理组;(F)1 μM没食子儿茶素没食子酸酯处理组。
图3 没食子儿茶素没食子酸酯对3T3-L1前脂肪细胞分化的影响
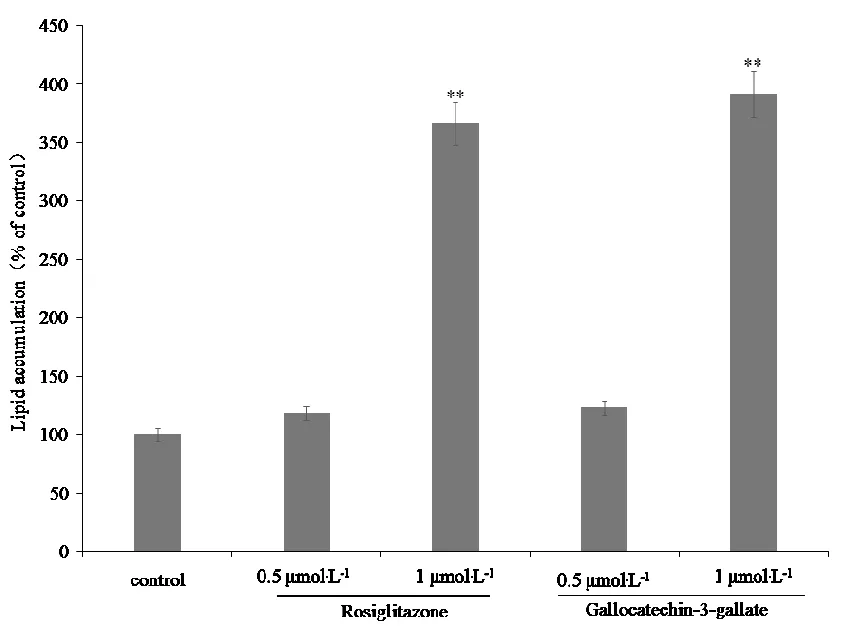
注:n=6,设定对照组中脂的含量为100%;与对照组比较,**P<0.01。
图4 没食子儿茶素没食子酸酯对3T3-L1前脂肪
细胞分化过程中脂含量的影响
4 讨论
没食子儿茶素没食子酸酯可显著提高分化的3T3-L1脂肪细胞在高浓度葡萄糖条件下对胰岛素刺激条件下的葡萄糖吸收,这表明没食子儿茶素没食子酸酯可能具有降低血糖的潜能,但需要深入研究其作用机制。
上调过氧化物酶体增殖物激活受体(PPARγ)表达能显著提高胰岛素敏感性[16-18]。PPARγ2选择性表达于脂肪细胞中,其表达离不开脂肪细胞分化过程[19]。因此,能够促进脂肪细胞分化的化合物很可能具有改善胰岛素敏感性和提高胰岛素刺激的葡萄糖吸收的潜力[7-15]。试验结果提示没食子儿茶素没食子酸酯促进了3T3-L1前脂肪细胞的分化过程,这可能是没食子儿茶素没食子酸酯加快脂肪细胞中胰岛素刺激的葡萄糖吸收的一个原因,但这仍需进一步研究。
5 结语
综上所述,没食子儿茶素没食子酸酯不仅促进了分化的3T3-L1脂肪细胞对胰岛素刺激的葡萄糖吸收,而且加速了3T3-L1前脂肪细胞的分化过程。因此,没食子儿茶素没食子酸酯可能具有降低血糖和改善胰岛素抵抗的潜能,这对于预防或辅助治疗2型糖尿病具有重要意义。

