三工河流域琵琶柴群落凋落物对土壤有机碳固定的影响
田思惠,柳 鑫,金宝成,陈玉连,汪依妮,田晓龙,赵学春,*
1 贵州大学动物科学学院, 贵阳 550025 2 中国科学院植物研究所, 北京 100093 3 贵州省草地技术试验推广站, 贵阳 550025
土壤有机碳是土壤碳库的重要组成部分,对生态系统生产力和全球碳循环具有重要作用。据估计,土壤有机碳储量为1500 Pg[1],是陆地生物量的2.4倍[2],大气碳库的2倍[1],土壤有机碳储量的轻微变化会对大气CO2浓度产生显著影响[3]。面对全球变暖,减缓大气CO2的增速成为科学界的重要研究主题[4]。热带和温带地区的生产力虽然较高,但其持续固碳的潜力较为有限[5]。面积广阔的干旱区一方面可以通过盐碱土本身的中和反应吸收大量CO2,以无机碳的形式贮存在土壤中;另一方面以植被恢复的方式固定数量可观的CO2,以有机碳的形式较为稳定的存在土壤中[1, 6]。
凋落物作为有机质和养分的重要储存库[7],分解释放的有机碳是土壤碳库的重要来源之一,植物90%以上的净生产量均以凋落物形式返回地表[8],通过分解作用进入土壤的有机碳占地上净生产量的50%以上[9]。干旱区生态系统植被稀疏、生物多样性低、土壤盐碱化程度高,凋落物分解和有机碳释放对改良贫瘠土壤显得尤为重要。由于土壤有机碳储量巨大,在短期内很难检测到土壤有机碳明显的变化。而通过人为改变凋落物输入方式和量化凋落物量可以解决这一难题。
因此,本研究采用DIRT法(添加和去除凋落物法)[10],人为改变土壤有机碳输入,实现在短期内观察土壤有机碳和碳循环的变化,并辅以野外土壤、凋落物定位连续观测等实验方法,探究三工河流域两个不同琵琶柴群落凋落物动态及其对土壤有机碳的贡献,分析土壤有机碳变化与生态因子的关系,为深入理解我国干旱区荒漠生态系统碳循环过程及其对全球气候变化的响应提供理论基础。
1 材料与方法
1.1 研究区概况
研究区位于新疆维吾尔族自治区阜康市中国科学院阜康荒漠生态系统国家野外科学观测研究站,地理坐标为87°43′—88°44′E,43°45′—45°29′N。气候类型属典型温带大陆性气候,冬季寒冷,夏季酷热。年均温度6.6℃,最高气温42.6℃,最低气温-41.6℃;年降水量164 mm,冬季冻土深度1 m以上。土壤类型为荒漠盐碱土,成土母质以冲击物为主,生物过程较弱,有机质含量低(<4.0 g/kg),pH>8.5。植被类型为荒漠植被,以柽柳科(Tamaricaceae)琵琶柴属(Reaumuria)、柽柳属(Tamarix),蒺藜科(Zygophyllaceae)白刺属(Nitraria)、霸王属(Sarcozygium),藜科(Chenopodiaceae)梭梭属(Haloxylon)、猪毛菜属(Salsola)、碱蓬属(Suaeda)等为主要建群种。
1.2 样地设置与野外控制实验
在研究区选取两个分布距离较近,但外貌结构具有显著差别的琵琶柴群落,基本情况见表1。

表1 两个琵琶柴群落的基本情况
于2012年5月初开始,分别在两个琵琶柴群落选取3个25 m×25 m的样地,在每个样地内设置5个50 cm×50 cm的凋落物收集器(网孔1 mm×1 mm),收集器用支架支起,距离地面15—20 cm,每月(6—10月)定期收集收集器内凋落物,带回实验室,捡出凋落物中的石子、昆虫等杂质,置于烘箱,于65℃下烘干48 h,称重。
采用DIRT法进行凋落物控制实验,在上述每个样地中分别设置对照处理(LCK)、去除凋落物处理(NL)、添加凋落物处理(DL),样方大小1 m×1 m,重复3次。其中,允许凋落物正常凋落到LCK的样方内,每月月初将NL样方内的凋落物清理干净,并均匀撒在DL的样方内,DL每月添加量为凋落物产量,添加量见图2。同时在处理样方内每月随机选取3个样点,用土钻依次钻取0—5 cm、5—10 cm、10—20 cm、20—30 cm土层的土壤,用于测定有机碳含量。
同时,每月在每个25 m×25 m的样地内,随机选取3个样点进行土壤样品采集,去除地表凋落物,用土钻依次钻取0—5 cm、5—10 cm、10—20 cm、20—30 cm土层的土壤各约300 g,用于分析土壤含水量、pH值、电导率、全碳、全氮等指标。并在每个样方内挖掘土壤剖面,用土壤环刀(内径50.46 mm,高50.02 mm)每隔10 cm分层垂直采集用于测定土壤容重的样品,采用Em50长期固定监测以上土层的土壤温度。
1.3 室内分析
用于测定土壤容重的样品在105℃烘干至恒重,同时测定土壤含水量。用于测定其他指标的土壤样品,置于干燥阴凉处风干,挑去石块、根系、未分解的有机质,过100目土壤筛。采用pH计和DDSJ-308型电导仪测定土壤(水土为5∶1的混合液)pH值和电导率。用K2Cr2O7外加热法测定土壤有机碳含量。使用Vario El III元素分析仪测定土壤全碳、全氮含量。
1.4 数据处理
土壤有机碳总量TOC(kg/hm2)按公式(1)计算[11]:
TOC=Cs×h×ρ×104
式中:Cs为样品的C含量(%),h为土层厚度(m),ρ为土壤容重(g/cm3)。
数据分析均在SPSS 16.0中进行,采用方差分析、线性回归、二次项拟合和逐步回归的方法进行数据分析。
2 结果与分析
2.1 土壤理化性质
由图1可见,群落2的土壤含水量、电导率和土壤pH值基本均高于群落1,群落2的土壤容重、温度和土壤全氮、全碳含量均低于群落1。群落1和群落2的土壤含水量随土壤深度的增加而增大,在20—30 cm土层达到最大,最大值分别为7.18%和9.68%。群落1和群落2的土壤电导率随土壤深度的增加呈先增加后降低的趋势,在10—20 cm和5—10 cm处达到最大,最大值分别为3.90 ms/cm和6.33 ms/cm。群落1的土壤容重随土壤深度的增加呈逐渐下降的趋势,群落2呈逐增大的趋势。在0—5 cm和20—30 cm土层达到最大值,最大值分别为1.43 g/cm3和1.29 g/cm3。群落1的pH值呈现先增加后减小再增加的趋势,变化范围为8.10—8.78,平均pH为8.63;群落2的pH值呈先减小后增加的趋势,范围变化为9.04—9.67,平均pH为9.36。群落1和群落2的土壤温度随土壤深度的增加均呈现先升高后降低的趋势,群落1的各土层的温度显著高于群落2,群落1和群落2的土壤均温分别为26.65℃和21.54℃。群落1和群落2的全氮含量随着土壤深度的增加均呈降低的趋势,在20—30 cm土层处达到最小,最小值分别为0.47 g/kg和0.49 g/kg,平均值分别为0.59 g/kg和0.53 g/kg。群落1和群落2全碳含量随着土层深度的增加呈降低的趋势,在土层0—5 cm和10—20 cm处均差异显著,平均值分别为11.26 g/kg和10.01 g/kg。
2.2 凋落物产量和现存量
由于自然条件的限制,从11月到翌年5月,凋落物产量非常有限,本研究以2012年6—10月的凋落物产量代替全年凋落物产量[12]。由图2可知,群落1和群落2的凋落物产量季节变化趋势相同,在10月份达到最大值,7或8月份达到次大值,均呈“N”型分布。其中,群落1的8月和10月凋落物产量分别占总产量的25.23%和31.85%,群落2的7月和10月凋落物产量分别占总产量的27.89%和30.88%。群落1和群落2的凋落物现存量差异显著,群落2的凋落物现存量显著大于群落1。群落1的凋落物现存量呈“N”型变化,在10月份达到最大值,为30.65 g/m2;群落2的凋落物现存量呈“W”型变化,亦在10月份达到最大值,为57.87 g/m2。

图2 凋落物产量和现存量随季节的变化(平均值±标准误差)Fig.2 Season changes in litter productivities and litter amount(mean±SE)不同字母表示在相同时间下两个群落凋落物产量和现存量存在显著差异(P<0.05)
2.3 凋落物处理对土壤有机碳的影响
如图3所示,整个野外控制实验期间,群落1NL处理的土壤有机碳与LCK相比,在30 d、90 d和150 d后依次降低了1.10%、5.66%和6.97%;DL处理的土壤有机碳在30 d、90 d和150 d后依次增加了6.87%、10.67%和19.64%。同样,与LCK相比,群落2NL处理的土壤有机碳与LCK相比,在30 d、90 d和150 d后依次降低了11.28%、16.82%和18.38%;DL处理的土壤有机碳在30 d、90 d和150 d后依次增加了14.44%、1.38%和13.66%。

图3 琵琶柴群落不同凋落物处理的土壤有机碳随时间变化(平均值±标准误差)Fig.3 Changes of soil organic carbon at the three treatments of two Reaumuria soongorica communities(mean±SE)不同字母表示相同时间下琵琶柴群落不同凋落物处理的土壤有机碳存在显著差异(P<0.05)
在三种凋落物处理下,群落1的土壤有机碳(图4所示)随土壤深度的增加均呈逐渐降低的趋势。从0—5 cm到5—10 cm土层,土壤有机碳在NL、LCK和DL处理下,分别下降了61.76%、62.39%和61.73%。群落2的土壤有机碳呈现与群落1相同的趋势,从0—5 cm到5—10 cm土层土壤有机碳下降稍缓,土壤有机碳在NL、LCK和DL处理下,分别下降了23.24%、25.84%和18.24%。
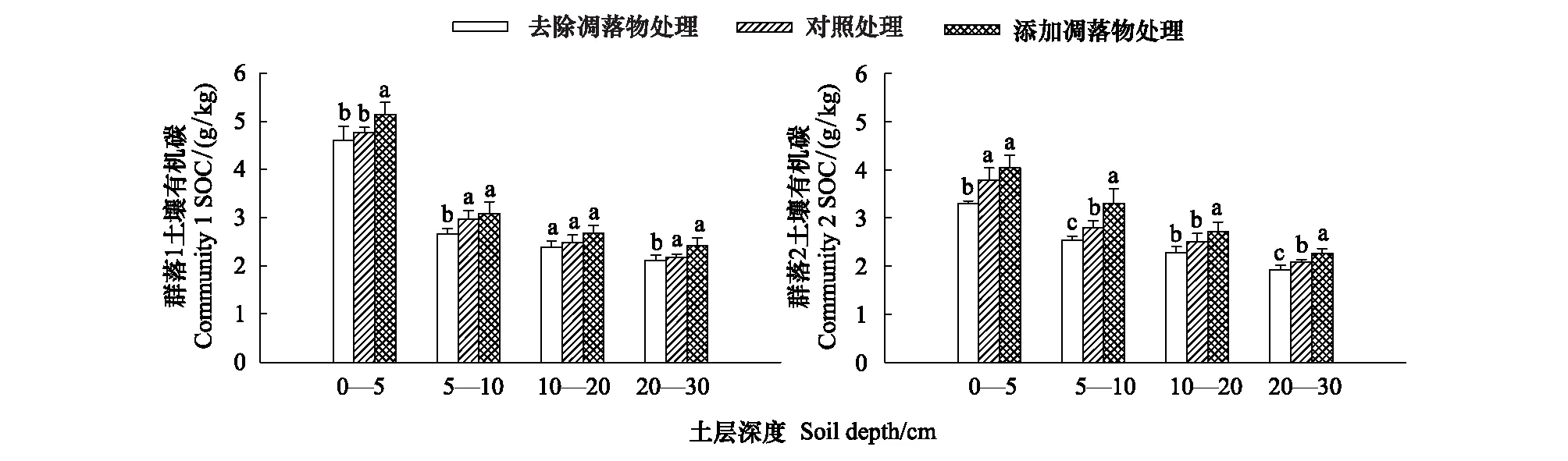
图4 两琵琶柴群落土壤有机碳随土壤深度的变化(平均值±标准误差)Fig.4 Changes of soil organic carbon of two Reaumuria soongorica communities at different soil depth(mean±SE)不同字母表示同一土层琵琶柴群落不同凋落物处理的土壤有机碳存在显著差异(P<0.05)
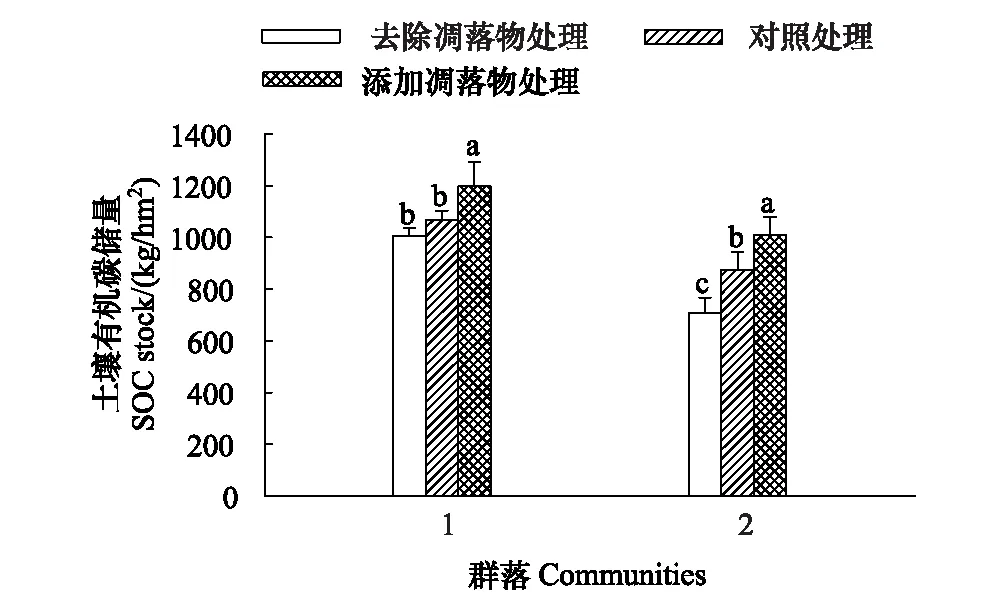
图5 两琵琶柴群落的土壤有机碳储量(平均值±标准误差) Fig.5 Soil organic carbon stock in two Reaumuria soongorica communities(mean±SE)不同字母表示同一琵琶柴群落不同凋落物处理的土壤有机碳储量存在显著差异(P<0.05)
群落1和群落2的土壤有机碳储量(见图5)在DL处理下达到最大,分别为1197.88 kg/hm2和1010.78 kg/hm2;在NL处理下最低,分别为1007.36 kg/hm2和709.30 kg/hm2。
2.4 凋落物和生态因子对土壤有机碳的影响
线性回归分析可知(表2),群落1的土壤有机碳随凋落物产量的增加呈逐渐降低的趋势,随凋落物现存量的增加均呈逐渐增大的趋势,且相关性显著。与群落1相比,群落2的土壤有机碳随凋落物产量和现存量的增加均呈逐渐增加的趋势,且相关性显著。
由表3可见,群落1和群落2的土壤有机碳与土壤水分、容重、全氮和全碳关系均显著,与土壤电导率和土壤温度的关系均不显著。群落1和群落2中土壤有机碳随土壤含水量的增加呈先减少后增加的趋势,当土壤含水量分别为6.19%和16.5%时,土壤有机碳达到最小值。在可视范围内,群落1的土壤有机碳随土壤容重的增加而增加,当容重为1.19 g/cm3时,土壤有机碳最小,群落2中土壤有机碳随土壤容重的增加而减小,当容重为2.17 g/cm3时,土壤有机碳最小。群落1的土壤有机碳随土壤pH的增加先减小后增加的趋势,在土壤pH为8.58时,土壤有机碳达到最小;与群落1相比,群落2表现出相反的趋势,在土壤pH为9.60时达到最大。在可视范围内,群落1和群落2的土壤有机碳随全氮和全碳含量增加均呈增加的趋势。

表2 土壤有机碳与凋落物产量和现存量的回归方程
显著性水平Significance levels:**,P<0.01;*,P<0.05
由表4可见,土壤含水量、电导率、土壤容重、pH值和土壤温度进入群落1土壤有机碳的逐步回归方程中,是影响群落土壤有机碳的主导因子。土壤含水量、电导率、pH值和土壤温度进入群落2土壤有机碳的逐步回归方程中,是影响群落2土壤有机碳的主导因子。
土壤深度和凋落物处理对土壤有机碳的交互作用如表5所示,单因素(土层深度、凋落物处理)对群落1和群落2的土壤有机碳均有极显著作用;土层深度×凋落物三种处理对群落2的土壤有机碳具有明显的交互作用,对群落1的交互作用不明显。

表3 土壤有机碳与土壤含水量、电导率、土壤容重、pH值、土壤温度、全氮和全碳的回归方程
y,土壤有机碳,Soil organic carbon(g/kg);SWC,土壤含水量,Soil water content(%);pH,土壤pH;SBD,土壤容重,Soil bulk density(g/cm3);SEC,土壤电导率,Soil electrical conductivity(ms/cm);ST,土壤温度,Soil temperature(℃);TN,全氮,Total nitrogen content(g/kg);TC,全碳,Total carbon content(g/kg); 显著性水平Significance levels:**,P<0.01;*,P<0.05

表4 土壤有机碳与生态因子的逐步回归分析
B,土壤有机碳,Soil organic carbon(g/kg);SWC,土壤含水量,Soil water content(%);pH,土壤pH;SBD,土壤容重,Soil bulk density(g/cm3);SEC,土壤电导率,Soil electrical conductivity(ms/cm);ST,土壤温度,Soil temperature(℃);显著性水平Significance levels:**,P<0.01;*,P<0.05

表5 土壤有机碳与三种处理和不同土层之间的双因素方差分析
显著性水平Significance levels:**,P<0.01;*,P<0.05
3 讨论
3.1 凋落物产量与现存量
研究表明,凋落物产量和现存量主要因温度、降水和土壤质地的不同而产生较大差异[13]。湿润地区,温度是控制凋落物生产和分解的主要因素[14];干旱和半干旱地区,水分则成为主要因素。不同生态系统类型的凋落物产量和现存量有较大出入[13-14],受极端环境的影响,干旱区植被稀疏、植株低矮、生物量较低,致使凋落物产量普遍较低[15]。本文以琵琶柴为建群种的三工河流域两个荒漠群落凋落物年产量为24.3 g/m2和27.72 g/m2,处在相同气候条件下优势木本凋落物产量的范围内(7.43—194.27 g/m2),明显低于索诺兰荒漠生态系统的凋落物产量(60—375 g/m2)[16]。凋落物产量的高峰出现在生长季节末期(10月),7月、8月为次高峰。受月均温、月降水和土壤因子的影响,生长季后期凋落物量较高占全年凋落物量的大部分,本研究在7月和8月出现了较高的凋落物量,10月出现了凋落物产量和现存量最大值,凋落物月变幅较大,主要是由于夏季的高温少雨和秋冬季节的低温等极端恶劣气候所致,琵琶柴通过脱落大量的叶片和枯死组织来维持正常的生命活动[17-18]。
凋落物的不断生产和分解,决定了凋落物地面现存量[19]。本文中两处琵琶柴群落的凋落物现存量分别为30.65 g/m2和57.87 g/m2,高于中国西北地区草地生态系统凋落物的现存量(9.00—25.00 g/m2),接近草地生态系统的凋落物现存量(60 g/m2)。琵琶柴群落凋落物产量虽然不高,但三工河流域气候干燥,降水稀少,冬季漫长,特殊的自然环境条件限制了土壤动物和微生物活动,凋落物分解周期长,地表凋落物更容易积累,因而凋落物现存量相对较高。
3.2 凋落物对土壤有机碳的影响
土壤有机碳储量的形成与变化是一个长期的过程,地表凋落物的积累和分解为土壤有机碳储量提供了更为快速和重要的有机碳源[20-21]。土壤有机碳与凋落物量呈正相关关系[18,22-26],去除凋落物使土壤有机碳降低[27-28];增加凋落物能够改善土壤理化条件和微生物活性,促进凋落物分解和土壤有机碳输入。本研究表明,去除凋落物使两个琵琶柴群落土壤有机碳降低了6.97%和18.39%,国内外去除凋落物降低有机碳的范围多在18%—24%[25-26,29]。但也有研究得出去除凋落物处理的表层土壤有机碳未发生显著变化[26],可能是因为土壤有机碳来自地下根系的输入[30]。群落1和群落2细根在0—10 cm土层仅占17.95%和11.49%,而在10—30 cm土层内占比达67.78%和52.66%[31],表层(0—5 cm)根系极少,土壤有机碳的变化主要受凋落物分解的影响。两个群落的凋落物产量相差不大,但群落2的凋落物现存量却比群落1高出近1倍,因此群落1的凋落物分解速率要快于群落2,导致群落1表层土壤有机碳含量升高。本研究中,倍添凋落物使两个琵琶柴群落土壤有机碳增加了19.64%和13.66%,与多数研究结果一致[29,32-34]。但也有学者得出添加凋落物促进土壤有机碳的损失[35],添加的凋落物提高了土壤微生物和酶活性,促进了土壤有机碳的矿化,因而降低土壤有机碳含量。
此外,凋落物对土壤有机碳的作用除了受地带性气候条件影响外,微环境条件也是起直接作用的重要因素,土壤表层微生物、湿度、温度、盐分、酸碱度、质地等是对土壤有机碳起重要影响的因子。本研究也得出了影响两个琵琶柴群落的土壤有机碳动态的主导因子为土壤水分、电导率、pH、容重和土壤温度。群落2相对较高的pH和盐分含量抑制了凋落物的分解,导致其凋落物现存量较高、土壤有机碳含量较低;群落2的土壤具有盐胀现象,表层疏松,容重较小[31],加上土壤含水量较高,更利于土壤生物的活性和土壤有机碳的矿化,进一步降低了土壤有机碳含量。

