和田密植红枣果实发育中高维生素C积累与相关酶活性及独特环境协同作用的关系

摘要:对4个和田红枣品种果实发育过程中维生素C含量和半乳糖内酯脱氢酶、抗坏血酸氧化酶、抗坏血酸过氧化物酶、单脱氢抗坏血酸还原酶、脱氢抗坏血酸还原酶的活性以及果实鲜干质量和糖积累进行测试分析,结果显示,维生素C含量的积累在发育过程中呈“S”形的模式,其中120、140 d是维生素C积累最快和最重要的2个时期。半乳糖内酯脱氢酶活性与维生素C积累速率及糖的变化趋势相似,二者在60~120 d呈明显的线性正相关关系。维生素C分解酶抗坏血酸氧化酶和抗坏血酸过氧化物酶只在发育前期短时间内表现活性,从而使维生素C极少被氧化分解,这是枣果实能积累高水平维生素C的重要原因;單脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶的活性则主要表现在生育后期,结果显示,3个制干枣品种中维生素C含量主要受半乳糖内酯脱氢酶活性调节,同时维生素C代谢酶抗坏血酸氧化酶也对维生素C积累起到了重要作用,而单脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶活性对维生素C积累的作用主要在生长晚期,制干品种生育期比鲜食品种延长55~65 d,果实成熟采收期比其他区域延迟30~45 d,此时制干枣品种果实维生素C积累明显高于鲜食枣品种。
关键词:枣品种;抗坏血酸;半乳糖内酯脱氢酶;抗坏血酸氧化酶;抗坏血酸过氧化物酶
中图分类号: S665.101 文献标志码: A 文章编号:1002-1302(2019)05-0090-05
收稿日期:2017-11-06
基金项目:新疆生产建设兵团产学研重大专项(编号:2010ZX02);科技部富民强县专项(编号:2011KJ008)。
作者简介:徐胜利(1964—),男,上海人,博士,教授,研究方向为园林资源与利用研究。E-mail:xusl0997@163.com。
维生素C是植物体内合成的一类己糖内酯化合物,不仅是维持人体健康的必需物质,而且对植物在维持细胞光合和代谢的氧化还原平衡方面具有特殊功能[1]。它广泛存在于各类新鲜果和干果中,是人体必需的维生素之一,且由于人类缺乏其合成关键酶而只能从食物中获取,因此,维生素C含量已成为衡量果品品质的重要指标,果品维生素C的合成途径和代谢机理等方面的研究在刺梨、白菜、猕猴桃等中已有报道[2-4],而有关和田红枣维生素C积累与相关酶活性方面鲜见报道。
植物体内维生素C含量受合成和再生能力的调控。维生素C-谷胱甘肽循环是维生素C再生的主要途径。在该途径中,抗坏血酸过氧化物酶以维生素C为电子供体清除H2O2的同时,将维生素C氧化成单脱氢抗坏血酸,单脱氢抗坏血酸一部分可在单脱氢抗坏血酸还原酶的催化下还原为维生素C,一部分可通过非酶歧化反应生成维生素C和脱氢抗坏血酸,而脱氢抗坏血酸在脱氢抗坏血酸还原酶和谷胱甘肽参与下可被还原为维生素C。若脱氢抗坏血酸不能及时被还原,进一步会被氧化降解为草酸和酒石酸而被丢失[5]。
和田具有独特的小气候、光热和立地栽培条件,其出产的制干红枣品质在我国干枣中一枝独秀,成为特色区域性干枣中的极品,近年来和田制干红枣发展迅猛,畅销全国及东南亚,和田已发展成为我国最优制干枣生产基地[6]。红枣果实具有丰富的营养价值,尤以其高维生素C含量而被誉为“维C之王”,但迄今对和田密植红枣果实维生素C积累机制研究尚未见报道。对于研究维生素C的合成代谢机制而言,红枣因其童期很短、边花芽分化边开花边结果,维生素C含量极高而成为理想的果树维生素C代谢机制研究材料。本研究中以和田主栽制干品种骏枣、金昌一号、灰枣和鲜食品种冬枣果实为试材,研究密植红枣不同生长发育时期维生素C含量及代谢相关酶活性的变化,探讨在果实生长发育过程中它们与维生素C积累的关系,为揭示和田密植红枣果实高维生素C内外协同关系提供理论依据。
1 材料与方法
1.1 试验材料
供试红枣材料为5年生制干品种骏枣、金昌一号、灰枣和鲜食品种冬枣,于2010年建园直播酸枣种植于和田农十四师224团,2011年同时嫁接上述品种,每个品种按照标准化种植面积46 690 m2,行株距为0.5 m×0.7 m×1.5 m的宽窄行模式,株高1.3 m,南北行向,个体树形为超矮3~4短枝篱壁树形,树势和大小一致。在花期,选取15棵长势基本一致的植株,与生产同花期(6月初)喷洒GA3 1~2次,使每棵树的坐果量基本一致,于2011年3月嫁接(花后20、40、60、80、100、120、140、160、180、200 d),每个品种随机采取果实100 g,取部分用于直接测定鲜质量和干质量,剩余样品用液氮处理并保存于-70 ℃待用。取未去皮的果肉测定相关生理指标。
1.2 红枣果实鲜质量和干质量的测定
每次分别于花后10个时期4个红枣品种随机取30个果实直接称量鲜质量并计算平均单果质量;之后立刻于115 ℃杀酶20~30 min,并于65 ℃下烘干至恒质量,计算平均单果干物质质量,重复3次。
1.3 水溶性总糖、还原糖及蔗糖含量的测定
测定时对花后10个时期4个红枣品种各称取约4 g红枣果肉,水溶性总糖、还原糖及蔗糖含量按林炎坤的方法[7]测定。
1.4 维生素C和脱氢抗坏血酸含量的测定
分别于花后10个时期,4个红枣品种各称取5 g枣,取其果肉在5 ℃下于5%偏磷酸中研磨成匀浆以防止维生素C的氧化和脱氢抗坏血酸的降解,然后在5 ℃、1 910 r/min离心20 min,收集上清液用于测定维生素C和脱氢抗坏血酸含量。测定时,反应体系中分别加入浓度为1.25 U/mL的抗坏血酸氧化酶和2 mmol/L的二硫苏糖醇用于氧化维生素C和还原脱氢抗坏血酸,用紫外分光光度计测定其在265 nm的吸光度变化。用已知浓度的维生素C和脱氢抗坏血酸溶液以相同的方法作标准曲线。总维生素C含量=维生素C含量+脱氢抗坏血酸含量[8-9]。
1.5 半乳糖内酯脱氢酶活性测定
分别于花后10个时期每个红枣品种称取4 g红枣果肉在5 mL含400 mmol/L蔗糖的100 mmol/L磷酸钾缓冲液(pH值7.4)中研磨成匀浆,然后2层纱布过滤;滤液在26 r/min下离心10 min,收集上清;于477 r/min离心20 min后收集沉淀。将沉淀轻轻悬浮于0.5 mL含400 mmol/L蔗糖的 100 mmol/L 磷酸钾缓冲液(pH值7.4)中,供酶活性测定使用。以上操作均在4 ℃下进行。半乳糖内酯脱氢酶活性测定:2.4 mL反应体系中含有2 mL 1.05 mg/mL的细胞色素C、200 μL 56 mmol/L的L-半乳糖內酯和200 μL提取液。测定前先将反应混合液于25 ℃预温育1 min,反应从加入L-半乳糖内酯后开始计时。摩尔系数值17.3 L/(mmol·cm)用于酶活性计算,酶活性单位定义:L-半乳糖内酯氧化量为 1 nmol/min (相当于细胞色素C还原量为2 nmol/min)为1单位半乳糖内酯脱氢酶活性[10]。其中细胞色素C和L-半乳糖内酯均购自Sigma公司。
1.6 抗坏血酸氧化酶、丙氨酸氨肽酶以及单脱氢抗坏血酸还原酶、脱氢抗坏血酸还原酶活性测定
分别于花后10时期每个红枣品种称取1~2 g红枣果肉,在含甘露糖(0.3 mol/L)、乙二胺四乙酸(1 mmol/L)、牛血清白蛋白(0.1%)、半胱氨酸(0.05%)及聚乙烯吡咯烷酮(2%)的三羟甲基氨基甲烷-盐酸缓冲液(50 mmol/L,pH值7.2)中于4 ℃下研磨成匀浆,1 910 r/min离心20 min,收集上清液用分光光度计法测定这4种酶活性。酶活性定义:维生素C氧化量为1 μmol/min为1单位(U)抗坏血酸氧化酶或丙氨酸氨肽酶活性;烟酰胺腺嘌呤二核苷酸氧化量为 1 μmol/min 为1单位(U)单脱氢抗坏血酸还原酶活性;脱氢抗坏血酸还原量为1 μmol/min为1单位(U)脱氢抗坏血酸还原酶活性[11]。脱氢抗坏血酸的含量为总维生素C与维生素C间的差值,用维生素C/脱氢抗坏血酸比值来表示维生素C的氧化还原状态。以上指标均重复3次。测试数据采用SAS 9.4软件进行数据分析。
2 结果与分析
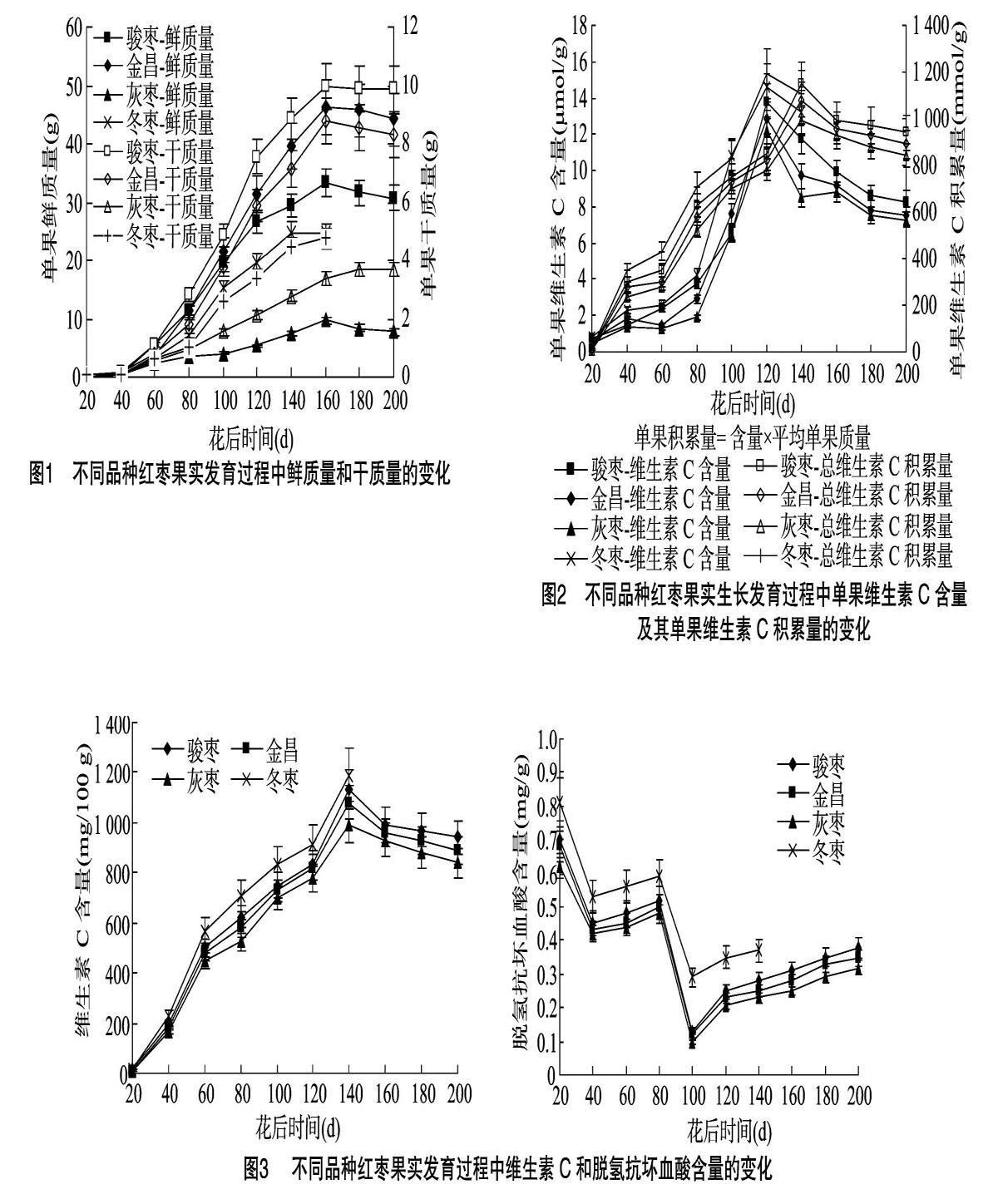
2.1 制干枣和鲜食枣果实鲜质量和干质量的变化
由图1可知,制干枣品种果实鲜质量和干质量在花后 40~160 d持续快速增加,其中60~160 d增加幅度较大,于160 d达到峰值,鲜质量160 d后开始有所下降而灰枣质量有所增加;制干枣品种完熟采收期比鲜食冬枣延迟45 d,而在花后120 d,这使制干枣果实密度增加从而有利于制干枣品质的形成,显示制干枣饱满且肉厚;采收期制干枣干质量和鲜质量略有下降,是由于失水后呈半干状态,此时80%以上的果实仍然挂在树上。鲜食冬枣从幼果发育到果实成熟的整个过程持续105 d时间。
2.2 制干枣和鲜食枣果实发育过程中维生素C水平及其积累量的变化
制干枣品种和鲜食冬枣维生素C含量在果实快速生长期(60 d后)快速提高, 在花后120 d达到最大, 是花后40 d
的6.32倍;花后120~140 d开始明显下降,花后 160 d 下降趋缓,仅下降17.8%;自花后40 d开始鲜食冬枣维生素C含量一直明显高于制干枣品种,直至140 d采收,制干枣品种间差异明显,骏枣维生素C含量﹥金昌一号维生素C含量﹥灰枣维生素C含量(图2)。
从整个红枣果实维生素C积累量来看,维生素C的积累主要在花后40 d之后,花后140 d才达到峰值,为花后20 d的74.52倍。160 d后维生素C的形成和降解达到相对平衡,积累量基本稳定。
2.3 制干枣和鲜食枣果实发育过程中维生素C和脱氢抗坏血酸含量的变化
由图3可见,在鲜食枣果实的整个发育过程中,冬枣果实
维生素C的积累速率总体上呈“快-快-快”直线形的快速上升趋势,采收前达到最高水平,并明显高于制干枣;鲜食枣冬枣脱氢抗坏血酸的积累速率总体上呈“降→升→降→升”的“W”形变化趋势,并明显高于制干枣。制干枣维生素C于花后40 d开始积累,至花后140 d达到峰值,在此后的自然失水干燥中略有下降,制干枣间差异不明显;制干枣品种脱氢抗坏血酸含量积累速率也呈“W”形变化,但在140 d后,有一个长达60 d的缓慢增长,而制干枣品种间差异不明显。
2.4 制干枣和鲜食枣果实发育过程中糖含量与半乳糖内酯脱氢酶活性变化的关系
由图4可知,半乳糖内酯脱氢酶活性变化呈“M”形,花后60~120 d,是制干枣果实半乳糖内酯脱氢酶活性上升最快的时期,140 d后明显下降;总糖和蔗糖的含量均维持在较高的水平,其间还原糖却处于整个生育期较高水平。这说明果实中的果糖等还原糖组分在该段时期可能部分用于维生素C合成。特别是在花后160~200 d,虽然蔗糖仍然保持几乎整个发育期最高的含量,但还原糖却处于较低水平,同时可溶性总糖含量也轻微降低,但这并未导致此时维生素C合成和积累降低,而是维持了较高水平。就整个发育过程而言,这3类糖水平与半乳糖内酯脱氢酶积累量之间表现相应的直线相关性。鲜食枣花后60~120 d,糖分积累与维生素C积累量之间表现明显的直线相关性,于120 d达到峰值。
2.5 制干枣和鲜食枣果实发育过程中半乳糖内酯脱氢酶活性的变化及其与维生素C积累的关系
图5显示,冬枣果实中半乳糖内酯脱氢酶在花后40 d之后开始表现活性,到花后60 d后活性急剧增加,至花后120 d达到最高水平,然后稍有下降,而这一时期也是冬枣维生素C积累最快的时期,花后120 d,随着冬枣果实的逐渐成熟,半乳糖内酯脱氢酶活性虽有所降低,但维生素C含量仍然线性增加;制干枣品种果实中半乳糖内酯脱氢酶活性变化与冬枣相似,至花后60 d后活性急剧上升,至花后120 d达到较高水平,随后缓慢下降,而后缓慢升高至最高,随后半乳糖内酯脱氢酶活性急剧降低,呈现“M”形;60~120 d间维生素C与半乳糖内酯脱氢酶呈现相似趋势,而在160 d后半乳糖内酯脱氢酶活性突然下降,相应在这一短暂时期维生素C的积累速率下降后变得较为平缓,但保持较高水平。
2.6 制干枣和鲜食枣果实发育过程中抗坏血酸氧化酶、抗坏血酸氧化物酶、单脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶活性的变化
通常在维生素C代谢过程中,在抗坏血酸氧化酶或抗坏血酸氧化物酶作用下维生素C氧化成单脱氢抗坏血酸,进一步形成脱氢抗坏血酸, 同时单脱氢抗坏血酸和脱氢抗坏血酸
可以在单脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶作用过程中还原成再生为维生素C。由图6可见,制干枣和鲜食枣果实快速生长期抗坏血酸氧化酶的活性不断升高,在花后100 d达到最大值,为花后20 d的2.32倍,然后至花后160 d下降为花后20 d的63.3%,花后160 d以后活性基本维持较低水平,鲜食冬枣抗坏血酸氧化酶活性自60 d后明显高于制干枣;花后20 d以后至80 d,无论是鲜食枣还是制干枣抗坏血酸氧化物酶活性均明显高于抗坏血酸氧化酶活性,制干枣品种间差异明显;花后80 d前制干枣品种和鲜食冬枣幼果抗坏血酸氧化物酶的活性较高,花后140 d达到最小值,快速生长期后逐渐下降,花后120 d后达到花后100 d的 45.1%。制干枣品种果实发育过程中脱氢抗坏血酸还原酶、单脱氢抗坏血酸还原酶的活性变化基本一致,均在花后120 d达到最大值,分别为花后20 d的4.35倍和2.15倍,至花后140 d下降至花后20 d的1.22倍和2.33倍,花后140 d以后变化趋缓,花后40~120 d,无论是鲜食枣还是制干枣脱氢抗坏血酸还原酶活性均明显高于单脱氢抗坏血酸还原酶活性,制干枣品种间差异不明显。
3 讨论与结论
3.1 和田红枣维生素C含量和积累与半乳糖内酯脱氢酶的关系
和田红枣因维生素C含量极高而日益受到人们的关注,研究人员试图了解和田红枣积累维生素C的独特过程,但由于人们过去并不清楚红枣合成维生素C的过程,所以对这种特殊高积累维生素C的生理机制缺乏较为深入的研究。关于植物维生素C的研究,1998年以后有了新的进展,植物中维生素C的生物合成路径才逐渐明朗,尤其是对L-半乳糖途径及其关键酶的日益明确,才使研究人员可以通过探究该途径中相关酶的活性变化及其与维生素C积累间的内在关系,进而揭示和田红枣果实持续高积累维生素C的生理生化机制。笔者研究发现,红枣果实在发育过程中半乳糖内酯脱氢酶能于较长生育期维持较高活性,从而果实能够持续高水平合成维生素C,这可能是和田红枣果实高积累维生素C的一个关键原因;同时,半乳糖内酯脱氢酶活性变化与维生素C积累量之间于60~120 d间存在着明显的正相关关系,这表明和田红枣果实合成维生素C的含量很大部分受到半乳糖内酯脱氢酶活性的调控。
3.2 和田红枣维生素C含量与抗坏血酸氧化酶、抗坏血酸氧化物酶、单脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶活性的关系
抗坏血酸氧化酶和抗壞血酸氧化物酶是维生素C代谢过程中主要的氧化分解酶[10]。和田红枣果实能持续合成维生素C,同时,由于抗坏血酸氧化物酶在果实发育前阶段的相对较短时期内具有较高活性,因而在该时期之后维生素C极少氧化分解,这是和田红枣果实能够积累高水平维生素C的另一个关键原因。一方面维生素C在持续不断地合成,另一方面其氧化损耗很少,进而使得维生素C能够高水平积累。维生素C经抗坏血酸氧化酶、抗坏血酸氧化物酶等氧化的产物是单脱氢抗坏血酸,单脱氢抗坏血酸一部分能经单脱氢抗坏血酸还原酶还原为维生素C,而另一部分能自身发生歧化反应生成维生素C和脱氢抗坏血酸,生成的脱氢抗坏血酸需依赖脱氢抗坏血酸还原酶还原成维生素C[11]。单脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶活性在制干枣果实生育中的变化趋势基本与抗坏血酸氧化酶相似,而与抗坏血酸氧化物酶相反,在果实快速发育期的120 d均迅速升高到最大,而果实成熟期维持较低水平,抗坏血酸氧化酶和抗坏血酸氧化物酶以及单脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶活性平衡点分别在花后100、140 d。不同研究结果显示,经由提高氧化态维生素C的再生能力可有效降低维生素C的氧化降解速率,进而明显增加植物体中维生素C的含量[12-13];而相应减少维生素C的氧化降解是提高植物维生素C的一个关键途径。
3.3 和田红枣维生素C含量与立地环境条件促成糖高积累的关系
和田密植红枣立地环境和栽培条件独特性在于拉长 45 d 的生育期,近乎纯沙土和全定量肥水一体化滴灌密植栽培技术,秋延后持续加大的昼夜温差和午后持续不断的微风,及时吹散叶果表面露水以及极少的秋季降雨的独特小气候条件,均给和田红枣中后期糖分特别是还原糖持续积累、持续高水平半乳糖内酯脱氢酶活性,以及后期持续低水平抗坏血酸氧化酶、抗坏血酸氧化物酶、单脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶活性营造了独特外部条件,从而将和田红枣高积累维生素C内在生理与外在条件有机统一。研究和田红枣维生素C的积累与降解特征对于深入理解和田红枣果实维生素C独特积累机制具有重要理论和应用价值。
参考文献:
[1]Davey M W,Montagu M,Inze D,et al. Plant L-ascorbic acid:chemistry,function,metabolism,bitavailability and effects of processing[J]. Journal of the Science of Food and Agriculture,2000,80(7):825-860.
[2]安华明,陈力耕,樊卫国,等. 刺梨果实中维生素C积累与相关酶活性的关系[J]. 植物生理与分子生物学学报,2005,31(4):431-436.
[3]宋玉萍,李 英,高红亮,等. 不结球白菜维生素C积累与相关酶活性研究[J]. 西北植物学报,2007,27(11):2240-2244.
[4]侯长明,李明军,马锋旺,等. 猕猴桃果实发育过程中AsA代谢产物积累及相关酶活性的变化[J]. 园艺学报,2009,36(9):1269-1276.
[5]Kostman T A,Tarlyn N M. Biosynthesis of L-ascorbic acid and conversion of carbons 1 and 2 of L-ascorbic acid to oxalic acid occurs within individual calcium oxalate crystal idioblasts[J]. Plant Physiology,2001,125(2):634-640.
[6]徐胜利,陈小青. 荒漠绿洲直播建园红枣光照分布及其对枣吊产量品质的影响[J]. 安徽农业科学,2012,40(14):8035-8037,8125.
[7]林炎坤. 常用的几种蒽酮比色定糖法的比较和改进[J]. 植物生理学通讯,1989(4):53-55.
[8]Turcsányi E,Lyons T,Plchl M,et al. Does ascorbate in the mesophyll cell walls form the first line defence against ozone?Testing the concept using brosd bean(Vicia faba L.)[J]. Journal of Experimental Botany,2000,51(346):901-910.
[9]Takahama U,Oniki T. Regulations of peroxidase-dependent oxidation of phenolics in the apoplast of spinach leaves by ascorbate[J]. Plant & Cell Physiology,1992,33(4):379-387.
[10]Tabata K,Takaoka T,Esaka M. Gene expression of ascorbic acid-related enzymes in tobacco[J]. Phytochemistry,2002,61(6):631-635.
[11]Stasoll C,Yeung E C. Ascorbic acid metabolism during white spruce somatic embryo maturation and germination[J]. Physiologia Plantarum,2001,111(2):196-205.
[12]安華明,樊卫国,刘庆林,等. 刺梨果实和叶片发育过程中抗坏血酸和抗氧化酶的协同变化[J]. 园艺学报,2007,34(5):1293-1296.
[13]Eltayeba A E,Kawano N,Badawi G H,et al. Overexpression of monodehydroascorbate reductase in transgenic tobacco confers enhanced tolerance to ozone,salt and polyethylene glycol stresses[J]. Planta,2007,225(5):1255-1264.徐 劼,段德超. 镉胁迫对芹菜生理特性及细胞超微结构的影响[J]. 江苏农业科学,2019,47(5):95-99.
——维生素C

