免疫瘦素促进大鼠脂肪沉积和PPARγ/SREBP-1 基因表达
吴丽红, 李洪涛, 管红兵, 顾为望, 黄莉文
(1. 广州医科大学附属口腔医院·广州口腔疾病研究所·口腔医学重点实验室, 广州 510140;
2. 广州医科大学附属第一医院广州呼吸健康研究院, 呼吸疾病国家重点实验室
·国家呼吸系统疾病临床医学研究中心, 广州 510230;
3. 南方医科大学实验动物管理中心暨比较医学研究所, 广州510515)
现代科学技术和经济速猛发展,生活变得方便、舒适、优越: 富营养食品, 汽车代步, 电脑、网络和空调使人们舒适上班, 甚至足不出户便可完成金融交易和跨国会议等。同时也使人们变得更加“懒慢”,缺少运动、营养过剩导致很多人处于超重、高脂血症和非酒精性脂肪肝的状态。
瘦素(Leptin)是由脂肪细胞分泌的激素[1,2],是反映体内脂肪储存重要信号。Leptin 功能异常可引起脂肪代谢异常,从而导致高脂血症和非酒精性脂肪肝等疾病的发生。Leptin 与脂肪代谢之间的联系机制很多。有报道[3-5]指出线粒体解偶联蛋白3(uncoupling protein-3, UCP3)、过氧化体增殖物激活型受体γ(peroxisome proliferatoractivatedreceptor-gamma, PPARγ)和类固醇调节元件结合蛋白-1(sterol regulatory element binding protein-1, SREBP-1)在Leptin参与脂肪代谢过程中起到重要作用。UCP3 是脂肪和能量代谢过程中的重要关键调控基因之一,而PPARγ被认为是脂肪细胞分化和增殖的调控因子,它们在Leptin 与Leptin受体结合的信号转导过程中起到增敏作用。SREBP-1 参与肝细胞脂肪变过程,食物中的脂肪酸可以通过调节SREBP-1基因mRNA表达与转录过程,从而促进脂肪在肝细胞的蓄积。
本实验利用Leptin免疫SD 大鼠,观察Leptin对皮下、腹部和肝脏脂肪沉积的影响,不但对肥胖、高脂血症、非酒精性脂肪肝的新型动物模型制作进行探索性研究,也为临床脂肪代谢异常疾病发生、病因研究提供科学依据。
1 材料与方法
1.1 实验动物
SPF 级雌性SD 大鼠30 只, 40 日龄, 110~120 g,购自南方医科大学实验动物中心[SCXK(粤)2016-0041]。动物实验于南方医科大学实验动物中心[SYXK(粤)2016-0167]进行,动物实验伦理审查表编号为R-20120928-01。
1.2 主要试剂与仪器
Lpetin抗体检测用的Leptin(包被96孔板用)为实验室自制保存, 磷酸盐缓冲液、油红O 染色试剂盒、钥孔血蓝(keyhole limpet hemocyanin,KLH)蛋白均购自美国Sigma 公司; 脱脂奶粉、3,3',5,5'-四甲基联苯胺、二甲基亚砜、碳酸氢盐、醋酸钠和98%浓硫酸等为国产试剂; 荧光定量PCR 试剂盒购自赛默飞世尔科技(中国)有限公司。显微镜及数码成像系统(COOLSCOPE)购自日本尼康公司; 石蜡切片机(R M 2 2 4 5)、全自动脱水机(TP1020)和冰冻切片机(CM1850 UV)均购自德国莱卡公司; 荧光定量PCR仪(CFX96)和酶标仪(FC)购自美国伯乐公司。
1.3 实验方法
1.3.1 动物免疫实验 Leptin 的表达、纯化、浓缩以及免疫原的制备具体方法按照前期研究[6]进行。
将SD大鼠随机分成对照组(KLH组)和实验组(Leptin 组), 每组15 只。实验期间, 大鼠饲养在屏障环境并饲喂无菌鼠料、高压灭菌水, 饮食自由。
实验全期按免疫次数分成3 个阶段:以第一次免疫前1 d 记为0 d,于1 d 进行第一次免疫,21 d 和42 d 加强免疫。采用腿部肌两侧两点注射方法免疫,Leptin 组每只大鼠每次免疫1 mg Leptin,KLH 组免疫1 mg KLH 蛋白。实验0 d 和52 d 称体质量和测抗体水平。实验0 d,大鼠在0.3%戊巴比妥钠溶液1 mL/100 g剂量腹腔注射麻醉状态下进行眼眶静脉丛采血,用于抗Leptin 抗体水平和血脂4 项指标检测。
在实验52 d将所有大鼠实施安死术,采集血液分离血清,用于抗Leptin 抗体水平和血脂4 项指标检测。采集肝脏称重、制作冰冻切片并进行油红O 染色,采集皮下和腹部脂肪称重和制作石蜡切片并进行HE 染色。肝脏脂变率=脏脏脂肪滴面积/观察视野面积×100%。
1.3.2 抗Leptin 抗体和血脂4 项指标检测 抗Leptin抗体测定方法如下: 通过交叉连续稀释法确定ELISA中显色剂和抗原(Leptin)包被剂的最佳浓度; 向酶标板孔中加入100 μL 含适量抗原的包被液4 ℃过夜; 清洗后加入200 μL 封闭液,37 ℃孵育2 h; 清洗后加入血清样品100 μL,37 ℃孵育1 h; 清洗后加入100 μL 二抗(过氧化物酶标记的羊抗大鼠抗体,稀释比为1∶2 400),37 ℃孵育1 h; 清洗后进行四甲基联苯胺(TMB)染色,室温下作用10~20 min (避光),加入100 μL 2%硫酸溶液终止反应后立即用酶标仪测定A450值。
每组血清样本随机抽取6 个进行总胆固醇、低密度脂蛋白、高密度脂蛋白和甘油三酯检测(由南京建成生物工程研究所进行检测和分析)。
1.3.3 基因的定量检测 抽取总RNA并反转录成cDNA。将UCP3(肌肉)、Leptin(腹部脂肪)、SREBP-1(肝脏)和PPARγ(下丘脑)基因与对应组织的β-actin 基因同时进行定量PCR 扩增, 记录各个基因扩增的Ct 值。荧光定量PCR 方法与步骤根据荧光定量PCR试剂盒说明书进行。定量PCR体系: 上下游引物(20 μmol/L)各0.2 μL、反转录产物1 μL、ddH2O 8.56 μL, SYBR green-Taq 10 μL,50×ROX 0.04 μL。 引物序列见表1。定量循环条件:50 ℃ 2 min,95 ℃ 2 min,[95 ℃ 15 s,60 ℃(β-actin)或54 ℃(Leptin) 或57 ℃(UCP3) 或58 ℃(PPARγ)或55 ℃(SREBP-1)30 s]40 个循环。
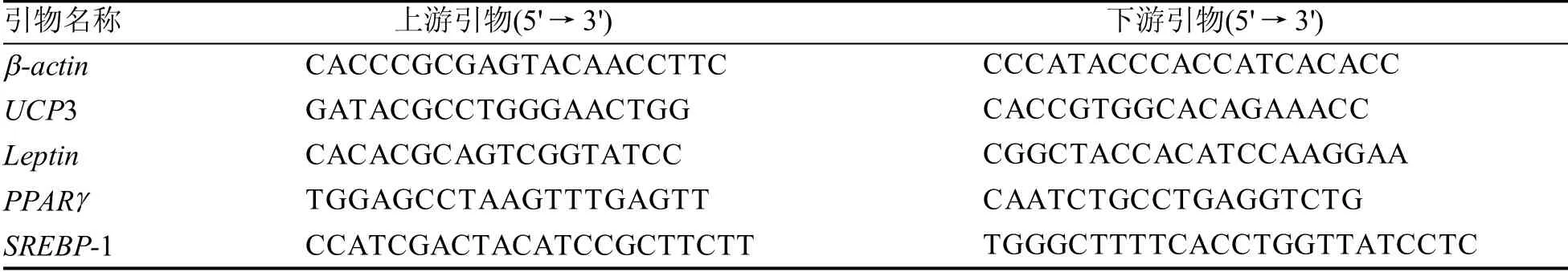
表 1 定量PCR 引物序列Table 1 Oligonucleotides used for Real-time PCR amplication
计算公式:Relative Quantification (ddCt)法,基因的平均相对含量 = 2-averageΔΔCt×100%(Ct 值是表示每个PCR反应管内荧光信号到达设定的阈值时所经历的循环数)。
1.3.3 组织病理学检测与分析 肝脏冰冻切片制作和油红O染色: 冷冻度调至-25 ℃左右取材,切成大小约为0.5 mm×0.5 mm×0.5 mm后用OCT包埋、冰冻、切片; 冰冻切片在常温下干燥15~20 min; 无水异丙醇孵育5 min; 0.5%的油红O 溶液孵育7~8 min (在60 ℃烤箱); 85%异丙醇溶液洗3 min; 双脱水洗,苏木素染1~1.5 min, 双脱水洗;封片剂封片; 倒置显微镜观察结果并拍照(染色结果不能长期保存,应尽快观察和拍照)。皮下、腹部脂肪组织的石蜡切片与HE染色: 具体染色步骤参考文献[7]。
1.3.4 实验数据处理与分析 利用SPSS17.0进行数据统计与分析,数据用x-± s 表示。体质量、抗Leptin 抗体水平、血脂4 项检测结果分析采用two-way ANOVA 进行统计分析; 其余数据采用student t 检验进行统计分析,P<0.05 为差异有统计学意义。
2 结果
2.1 免疫Leptin 后大鼠抗体水平和体质量
表2 结果显示,在实验0 d(首次免疫前),2组大鼠血清中的抗Leptin抗体水平均比较低。在实验52 d(实验结束),KLH 组没有明显变化,Leptin 组抗体水平明显升高(P<0.01),表明SD 大鼠免疫Leptin 后,成功激活了其体内免疫应答反应。SD 大鼠的体质量在实验52 d,免疫Leptin组体质量显著重于对照组(P<0.01)。
2.2 免疫Leptin 后大鼠血脂水平
表3 结果显示,实验0 d,免疫Leptin与KLH组大鼠血脂水平差异不显著(P>0.05), 但实验52 d时,免疫Leptin 的大鼠总胆固醇、低密度脂蛋白和甘油三酯均显著高于KLH 组(P<0.05)。
2.3 免疫Leptin后大鼠皮下、腹部和肝脏脂肪沉积
病理学观察可见(图1),Leptin 组大鼠皮下和腹部脂肪组织中的脂肪空泡较KLH 组排列松散,大部分脂肪细胞单个体积增大,有些细胞边缘轮廓不清晰。KLH 组大鼠肝细胞核呈蓝色, 肝细胞内红色脂滴数量极少; Leptin组大鼠肝细胞胞质内红色脂滴蓄积明显,视野内出现弥漫性的红染脂滴,且大多数被红染的脂肪滴的轮廓界面清晰。Leptin 组大鼠腹部脂肪和肝脏重量都较KLH 组显著增加; 单个视野皮下和腹部脂肪细胞面积大小分别约为KLH 组的2 倍和1.4 倍(P<0.05); 单个视野皮下和腹部脂肪细胞数量则分别比KLH组少31%和22%; 肝脏脂肪所占面积和肝脏脂变率都比KLH组分别显著高约8 倍和3.3 倍(表4)。

表 3 大鼠血清中总胆固醇、高密度脂蛋白、低密度脂蛋白和甘油三酯水平Table 3 The levels of total cholesterol, high density lipoprotein, low density lipoprotein and triglycerides in rat mmol/L

表 4 大鼠肝脏、皮下和腹部脂肪细胞比较Table 4 The comparison of liver, subcutaneous and abdominal fat cell of KLH and leptin rats
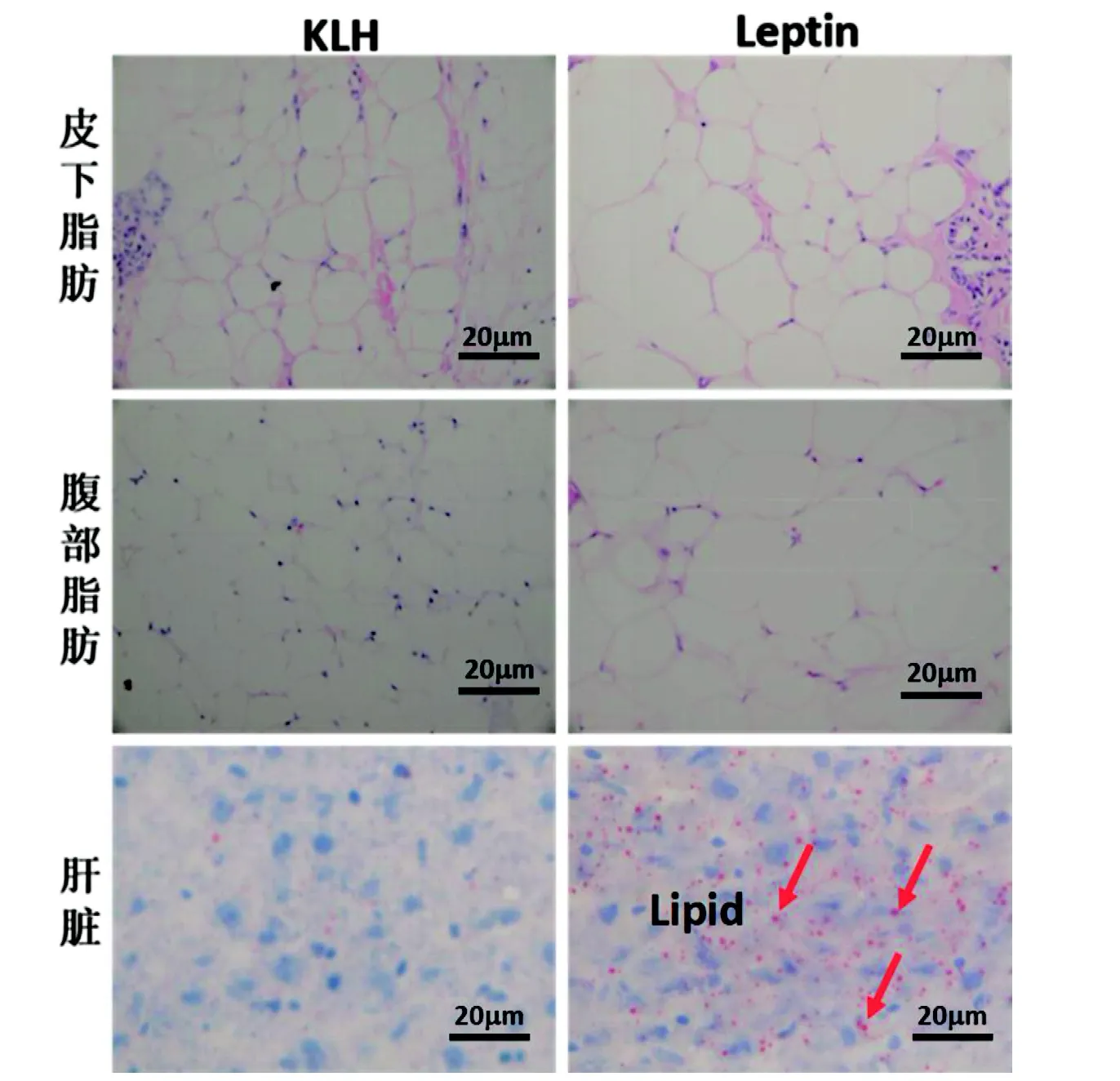
红色箭头表示肝脏中的红色脂肪滴图 1 大鼠皮下、腹部和肝脏脂肪沉积情况Figure 1 Fats deposition in subcutaneous, abdominal and liver of rat
2.4 免疫Leptin 后大鼠PPAYγ、Leptin 和SREBP-1 mRNA 表达水平
与KLH组比较,免疫Leptin后SD大鼠PPAYγ(下丘脑)、Leptin(腹部脂肪)和SREBP-1(肝脏)的mRNA 表达量均显著增加(P<0.05)(表5)。

表 5 脂肪沉积相关基因的mRNA 表达水平 (变化倍数)Table 5 The mRNA expression levels of fat deposition related genes in hypothalamic, abdominal fat,muscle or liver (Fold Change)
3 讨论
通常情况下,高脂血症合并非酒精性脂肪肝会伴随肥胖、糖尿病和高血压等代谢性疾病一起发生[8]。迄今,它们的病因复杂且尚未阐述明确,发病机制亦不十分清晰,这给高脂血症和非酒精性脂肪肝一级防治带来极大困难。
目前,常用的高脂血症合并非酒精性脂肪肝动物模型利用高脂饮食法诱导成模[9],随着人们健康意识的加强,部分人膳食中的脂肪摄入控制后,仍然出现超重和高脂血症合并非酒精性脂肪肝,这预示高脂饮食法造模存在一定的局限性。另外大部分高脂血症合并非酒精性脂肪肝患者未筛查出高脂血症合并非酒精性脂肪肝相关基因的突变或缺失,因而转基因和基因剔除性模型是远远不够的[10]。
高脂血症和非酒精性脂肪肝的发生与下丘脑Leptin抵抗有关[11]。Leptin被认为是一种新的肝病致病因子,Leptin 调控肝脏代谢的各种因子成为研究热点。Leptin 抵抗使外周脂肪分解,血中游离脂防酸增加,促进脂肪酸在肝内蓄积。甘油三酯合成增多是引起脂肪肝重要原因之一[12,13]。本实验结果显示,SD 大鼠免疫Leptin 后,体质量较KLH 对照组显著增加;组织病理学观察显示,脂肪在皮下、腹部中沉积增多。Leptin 功能的异常能够引起脂肪代谢异常,可使脂肪在血液中沉积,引起高脂血症、心血管疾病等[14-17]。本实验结果显示,免疫Leptin 后,大鼠总胆固醇、低密度脂蛋白和甘油三酯比KLH组显著升高,提示免疫Leptin 可引起大鼠发生高脂血症。临床上有些心血管病患者存在Leptin抵抗的现象(体内内源性的Leptin 分泌异常升高),导致Leptin 在体内蓄积,破坏心血管的内皮细胞的正常新陈代谢[18]。免疫Leptin后,SD 大鼠腹部脂肪中Leptin 基因的mRNA 表达量升高,可能与Leptin 抵抗产生的机体代偿机制相关,这一结果与临床患有高血脂的肥胖患者情况十分相近。
另外,免疫Leptin 后,下丘脑PPAYγ 和肝脏SREBP-1 表达上调也会导致脂肪在肝脏的沉积。转录活化后的PPAYγ 参与调控脂类代谢[19]。PPAYγ 上调可以促进白色脂肪细胞的分化与增殖、脂肪储存等,与本文结果一致。SREBP-1在肝脏脂肪化过程中起重要作用,肝内葡萄糖增高是脂肪组织表达SREBP-1的主要正调控因子之一[5]。从本文结果可见,免疫Leptin 可能通过降低SREBP-1基因mRNA的表达来促进在肝脏抗脂质合成的效应,肝脏SREBP-1 表达上调促进了非酒精性脂肪肝的发生。Leptin 可促进组织对葡萄糖的吸收和利用,阻碍葡萄糖进入肝脏,免疫Leptin可能阻碍了内源性Leptin与肝脏中Leptin受体的结合,从而抑制葡萄糖进入肝脏,增加脂肪在肝脏的沉积。我们推测,大鼠免疫Leptin 后,内源性Leptin 的功能受到抑制,脂肪细胞增大可能与Leptin受体信号转导通路中酪氨酸激酶(JAKs)和信号传导子与转录激活子(STATs)的活化和磷酸化减弱有关,这个科学问题将是我们未来研究工作的重点之一。
综上所述, 大鼠免疫Leptin 后, 出现高脂血症和脂肪在皮下、腹部和肝脏沉积增多,这可能与脂肪代谢相关的Leptin、PPARγ 和SREBP-1 基因表达水平上调有关,一定程度上为构建新型高脂血症和非酒精性脂肪肝大鼠模型提供科学依据。

