Tg2576 小鼠的行为和病理特征观察
关雅伦, 刘书华, 黄忠强, 李韵峰, 李雪娇, 李 舸, 张 钰
(广东省实验动物重点实验室, 广东省实验动物监测所, 广州510663)
阿尔兹海默症(AD)是一种以认知障碍和记忆力减退为临床特征的中枢神经系统变性疾病。目前AD 已成为全球老龄化社会中威胁老年人健康甚至生命的第一大杀手,至今缺乏有效的治疗方法。因此,一直以来AD 都是神经病学研究的热点,而基于AD 相关致病基因构建的各种遗传工程小鼠成为AD 疾病研究不可或缺的模式动物,目前国际上常用的AD 小鼠有Tg2576、APP23、APP/PS1、3×Tg-AD 和5×FAD。其中, Tg2576小鼠是1996年由Hasio等[1]构建的能产生认知障碍和A β斑块的转基因AD 小鼠模型,是最早应用于AD 研究的模式动物之一。该小鼠遗传背景为C57BL/6J 和 SJL小鼠的杂交系,通过将编码人的APP695 氨基酸异构体基因序列转入小鼠基因组后,小鼠过表达产生人APP (Lys670->Asn670,Met671->Leu671)突变体(瑞典型突变位点), 最终导致转基因小鼠出现AD 样的临床和病理改变。由于Tg2576 小鼠遗传背景为杂交系, 当杂交系小鼠作为亲代进行长期繁殖后由于基因的随机分离,将导致子代个体之间遗传背景出现差异[2], 但这种差异是否影响动物表型目前并不清楚, 这也成为近年来Tg2576小鼠较其它单一遗传背景的AD转基因小鼠较少被应用于科学研究关键因素之一。本文作者针对本实验室引进并长期繁使用的Tg2576转基因小鼠, 通过行为和病理表型分析,初步探讨长期繁殖可能对该小鼠AD 表型产生的影响。
1 材料与方法
1.1 实验动物
使用1 只12 周龄雄性Tg2576 小鼠(广东药科大学王丽京教授惠赠)和60只5周龄雌性C57BL/6小鼠,购自广东省医学实验动物中心[SCXK(粤)2013-0002], 过体外受精、胚胎移植方式,获得同期出生的6周龄SPF级Tg2576雌性小鼠和同窝对照C57BL/6 雌性小鼠各40 只(体质量18~20 g)。动物实验在广东省实验动物监测所SPF 级设施内进行[SYXK(粤)2016-0122],所有小鼠分别饲养至6 月龄、9 月龄、12 月龄和15 月龄后, Tg2576小鼠和对照小鼠随机各选取10 只进行实验, 饲养期间动物自由采食饮水,12 h∶12 h 循环灯光,恒定湿度, 室温(23±2) ℃。本次动物实验获得广东省实验动物监测所(AAALAC认证机构)动物实验动物使用与管理委员会(IACUC)批准(IACUC编号2014027)。
1.2 主要试剂和仪器设备
鼠抗Aβ 1-40 抗体,鼠抗Aβ 1-42 抗体(美国Biolegend公司), 兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(美国Millipore 公司),硫磺素(美国Sigma-Aldrich 公司),鼠链霉亲和素-过氧化物酶免疫组织化学试剂盒(中国康为世纪生物科技有限公司),抗兔Alexa Fluor 555免疫荧光二抗(美国Cell Signaling Technology公司),鼠Aβ 1-40 ELISA检测试剂盒,鼠Aβ 1-42 ELISA检测试剂盒(美国Invitrogen Life Technologies公司),多聚甲醛、 无水乙醇和二甲苯(中国上海化学试剂有限公司), Triton X-100(中国上海阿拉丁生化科技股份有限公司)。
Morris水迷宫(中国上海欣软信息科技有限公司),切片机、冷冻切片机、DM3000 正置显微镜和TCS SP5 激光共聚焦显微镜(德国Leica 公司),酶标仪(美国Bio-Rad 公司)。
1.3 方法
1.3.1 Morris 水迷宫 Morris 水迷宫由一个圆形水池(直径120 cm,高度50 cm)和一个白色圆形平台(10 cm)组成,水池周围由1 m 高的布帘围蔽,水池顶部放置摄像系统记录动物运动轨迹。圆形水池被等分为4 个象限,每个象限的水池壁绘制几何图形便于动物进行定位,实验前注水并将水温保持在(24±1)℃,在第一象限中心固定放置白色圆形平台,并调节高度至水面下1 cm处。小鼠在正式实验开始前,先放置于平台上观察适应环境,正式实验开始后,连续进行5 d,前4 d,小鼠每日分别从4 个不同象限的固定位置入水,观察记录动物找到平台的时间(潜伏期),如果在60 s 内找不到平台,动物则被轻轻地引导到平台上,每次试验结束后小鼠留在平台上休息10 s,再进行下一个象限的测试, 前4 d主要测试动物的学习能力。第5 日,将第一象限的平台拆除,动物从对侧象限入水,进行了一次60 s 的单一探测试验,观察记录动物穿越平台位置的次数,主要测试动物的记忆能力。动物运动轨迹自动化软件进行跟踪并分析。
1.3.2 脑组织样品Aβ1-40 和42 免疫组织化学染色 小鼠麻醉后用生理盐水从心脏进行灌注, 取右半脑在质量分数4%多聚甲醛中固定过夜, 脑组织经梯度酒精脱水、二甲苯透明、浸蜡后, 包埋成石蜡组织块。石蜡块修块后4 μm 切片, 在45 ℃水中展片后,贴于明胶玻片上放入烘箱中烘烤过夜用于后期染色。组织切片经过二甲苯脱蜡、梯度酒精复水、抗原修复后, 按照鼠链霉亲和素-过氧化物酶免疫组化试剂盒操作说明,滴加山羊血清封闭, 加入1∶400 稀释的一抗鼠抗Aβ 1-40 抗体或鼠抗Aβ 1-40 抗体孵育过夜后,经PBS 充分漂洗后, 滴加生物素标记的羊抗鼠二抗工作液室温孵育30 min, 经PBS 漂洗后,加入过氧化物酶(HRP)标记的链霉亲和素室温孵育30 min,经PBS再次漂洗后,加入二氨基联苯胺显色工作液,并在显微镜下观察显色。显色完成后,将组织切片放入自来水中终止显色,之后组织切片经苏木素复染、脱水透明,封片后在显微镜下进行镜检。
1.3.3 ELISA 检测脑组织样品Aβ 1-40 和Aβ 1-42表达 小鼠麻醉后用生理盐水从心脏进行灌注,取左半脑准确称量后置于预冷的PBS 中,冰上充分匀浆,离心后获得上清, 按照鼠Aβ 1-40 和Aβ 1-42 ELISA 检测试剂盒说明书要求,将上清中的抗原与预先包被Aβ 1-40抗体或Aβ 1-42抗体的酶标板进行孵育, 之后加入HRP标记的二抗与一抗进行结合, 形成抗体-抗原-酶标抗体复合物, 经过彻底洗涤后加底物3,3',5,5'-四甲基联苯胺显色,用酶标仪在450 nm 波长下测定吸光度,通过标准曲线计算脑组织中的Aβ 1-40 和42 表达浓度。
1.3.4 脑组织样品星形胶质细胞免疫荧光染色 小鼠麻醉后用生理盐水从心脏进行灌注, 取右半脑在质量分数4%多聚甲醛中固定过夜, 之后置于质量分数30%蔗糖溶液中再次过夜。脑组织过夜后在-20 ℃冰冻切片机下10 μm 连续切片。在进行免疫荧光前, 冰冻切片经过0.3%的Triton X-100 破膜, 并用10%血清在室温下封闭1 h。之后加入一抗兔抗胶质纤维酸性蛋白抗体并在4 ℃避光孵育过夜, PBS漂洗后选择抗兔Alexa Fluor 555 免疫荧光二抗在37 ℃下避光孵育1 h, 之后组织切片经过硫磺素染Aβ 沉淀后, 在激光共聚焦显微镜下根据发光基团选择激发光进行观察拍照, 所有照片应选择相同的曝光时间, 最后利用显微镜自带软件对进行合成分析。
1.4 统计分析
采用SPSS16.0 软件进行统计分析,实验数据以x-± s 表示。实验数据采用重复测量方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 Tg2576 小鼠AD 样行为特征变化
与对照小鼠比较, 从12 月龄开始, Tg2576 小鼠在水迷宫实验的学习测试阶段,定位航行逃避潜伏期时间在1~4 d 明显出现分离,15 月龄时逃避潜伏期时间分离更明显(图1)。在第5 日拆除第一象限平台后,从9 月龄开始,Tg2576 小鼠
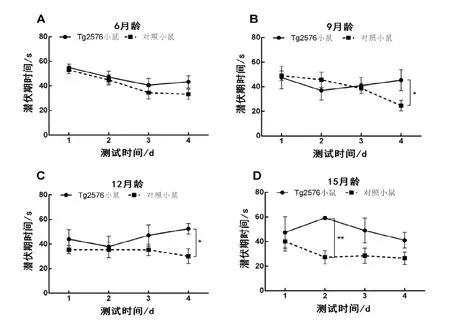
A: 6 月龄; B: 9 月龄; C:12 月龄; D: 15 月龄; 与对照小鼠比较: *P<0.05; **P<0.01图 1 不同月龄Tg2576 小鼠逃避潜伏期实验
在水迷宫实验的记忆测试阶段比对照组小鼠穿越平台位置的次数开始减少, 15月龄穿越平台次数明显减少(图2)。
2.2 Tg2576 小鼠脑组织Aβ 斑块的变化

图 2 不同月龄Tg2576 小鼠穿越平台实验
对小鼠脑组织进行Aβ 1-40和Aβ 1-42免疫组织化学染色显示,与对照小鼠相比,12 月龄的Tg2576 小鼠脑组织中可见明显的Aβ 斑块的沉积,毒性蛋白沉积物主要集中在大脑皮层(图3A)和海马区(图3C), 且大脑皮层的Aβ 斑块沉积物相对较多,同时, 血管周围也出现典型Aβ 斑块的沉积(图3B)。对小鼠脑组织进行Aβ 1-40 和Aβ 1-42蛋白定量分析表明,Tg2576 小鼠脑组织Aβ 1-40蛋白从12月龄开始出现显著升高,蛋白水平表达是同龄对照小鼠20 倍以上(图4A)。而Aβ 1-42 蛋白则从9 月龄开始出现显著升高,蛋白水平是同龄对照小鼠17 倍以上(图4B)。

A: 皮层, 比例尺100 μm; B: 皮层血管,比例尺100 μm; C: 海马, 比例尺50 μm图 3 12 月龄Tg2576 小鼠大脑皮层Aβ 斑块免疫组织化学染色结果

A: Aβ 1-40; B: Aβ 1-42; 与对照小鼠比较, *P<0.05; **P<0.01图 4 不同月龄Tg2576 小鼠脑组织Aβ 1-40 和Aβ 1-42 蛋白检测
2.3 Tg2576 小鼠脑组织星形胶质细胞激活情况
对小鼠脑组织进行星形胶质细胞免疫荧光染色和硫磺素染色后发现,与对照小鼠相比,从9月龄开始,Tg2576小鼠在大脑皮层区开始出现星形胶质细胞激活,随着年龄增大,在大脑皮层区和海马区均能够观察到星形胶质细胞激活,特别是在大脑皮层区出现大量星形胶质细胞聚集,通过与硫磺素共染发现,这些激活的星形胶质细胞主要聚集在Aβ 斑块附近(图5)。
3 讨论
Tg2576 小鼠表型与AD临床症状具有一定的相似性,表现在: 大量与淀粉样斑块产生和细胞凋亡相关的蛋白泛素化; 神经元出现营养不良; α突触核蛋白异常引起神经元轴突退变; 胆碱能神经元和肾上腺素能神经元的数量显著减少,这些病理变化主要发生在淀粉样斑块和认知缺陷之前,类似于AD 前驱期在人类中发生的认知缺陷。同时,该小鼠还表现出慢性神经炎症,睡眠障碍等表型。但该小鼠同样也表现出与人的AD 不一致临床病理特征,例如,认知缺陷衰退较临床AD病人不显著,无广泛的神经元丢失,无神经纤维缠结形成,晚期糖基化终产物以及葡糖糖代谢显著降低等。因此,该转基因小鼠模型可能更适合临床AD发生早期阶段研究,还无法完全模拟AD发生发展过程中的临床病理特征[3]。

GFAP 染色星形胶质细胞(红色荧光), 硫磺素染色Aβ 斑块(绿色荧光)图 5 不同月龄Tg2576 小鼠脑组织星形胶质细胞激活情况
对过去20年PUBMED数据库统计结果分析显示,1998 年至今有994 篇研究论文使用了Tg2576小鼠, 但从2004 年开始,每年使用该小鼠发表的文章在50 篇左右。与常用的APP/PS1 小鼠相比,从2013年后, 使用Tg2576小鼠发表的研究论文数量呈现下降趋势,这可能与该小鼠是在繁育使用中个体遗传背景存在差异, 且遗传背景影响着繁殖和行为变化有关。Lassalle等[4,5]将具有C57BL/6和SJL 杂交背景的Tg2576 小鼠与C57BL/6 回交后,连续3 代产仔数由6 只至4 只,最后下降至0; 而与CBA小鼠回交3代,每代产仔数平均在4.7只、5.3只和3.7只; 与C57BL/6和SJL(B6SJL)杂交1代小鼠繁殖6代, 每代产仔数平均在10.3 只、8.1只、5 只、5.9 只、7 只和7 只。由此可见,Tg2576小鼠维持B6SJL 混合背景具有较好的繁殖能力。
本研究选用长期在本实验室繁殖保种的Tg2576雄鼠, 通过体外受精-胚胎移植方式获得本实验所需的小鼠, 并未出现在自然交配中无法繁育的情况。其次, 因遗传背景所致雄性Tg2576 小鼠攻击性较强, 很难群居饲养[6], 本研究中, 长期繁育后产生的Tg2576小鼠在饲养过程中仍然出现群居和谐性较差的情况,无论雌性或雄性都容易出现打斗现象, 该小鼠的这种特性对于需要长期进行的AD 相关研究造成较大困难。此外, 该小鼠携带Pde6brd1视网膜变性基因, 易造成个别动物对光敏感或失明,因此,需要在进行行为评价前排除。
Tg2576 小鼠AD样行为学表型主要表现为年龄相关的认知障碍。Tg2576 小鼠最早在6 月龄开始出现空间学习和记忆缺陷,以及环境恐惧现象,也有认为, 该小鼠空间学习损伤出现在12个月以后[7]。本研究中,长期繁育的Tg2576 小鼠后代从9 月龄开始出现认知行为损伤,仍然保持了该小鼠的AD 样行为学特性。Hsiao 等[1]构建的Tg2576 小鼠Aβ 斑块的沉积主要出现在前额叶、颞叶、嗅皮质区、海马和小脑部位, 9~12 月龄鼠上出现了与年龄相关的淀粉样斑块, 11~13月龄小鼠的Aβ 1-42/43 的产生比2~8 月龄增加14 倍以上。本研究中, Tg2576 小鼠脑皮层和海马区出现典型的Aβ沉淀发生在9月龄以后与文献报道较为一致。鉴于Tg2576 小鼠随着月龄增大, 能产生典型的Aβ 斑块, 以及大量星形胶质细胞增生特点[8],目前该小鼠仍然是应用于Aβ斑块清除以及星形胶质细胞参与AD 发生等研究中较好的模式动物,此外,Tg2576小鼠也被应用于乙酰胆碱酯酶抑制剂[9]、美金刚胺和加兰他明[10]以及疫苗的药效评价中, 然而尽管使用Tg2576 小鼠进行AD 治疗药物临床前评价显示有效, 但在临床应用中实际应用中仍然无法获得阳性结果, 这也是目前使用的AD基因工程小鼠在药效评价中面临的主要问题。
综上所述,我们对长期杂交繁育的Tg2576进行行为和病理结果检测与文献报道未出现明显的差异,动物仍然能够表现出典型的学习记忆功能衰退、Aβ 斑块沉积以及星形胶质细胞激活等表型,但由于长期繁育后该小鼠仍然携带SJL 小鼠背景,群养和谐性较差,导致长期饲养困难,群居性较差对于开展行为评价可能产生较大影响,这也成为近年来Tg2576 小鼠应用较少的重要原因之一。

