槟榔江水牛BMP4基因分离鉴定、组织表达及生物信息学分析
郭文博,哈 福,江明星,张自芳,钱林东,保志鹏,苗永旺
(1.云南农业大学 动物科学技术学院,云南 昆明 650201;2.云南农业职业技术学院 畜牧兽医学院,云南 昆明 650212)
骨形态发生蛋白(Bone morphogenetic protein, BMP)是转化生长因子-β(Transforming growth factor-beta, TGF-β)超家族成员,在脊椎动物胚胎干细胞分化和器官发生过程中发挥重要的调控作用[1-2]。BMP作为TGF-β超家族中最大的配体亚家族,最早发现于1965年,迄今已经识别和鉴定出的BMP成员不下20种[3]。BMP4基因是BMP基因家族中的重要成员,其编码产物和其他骨形态发生蛋白一样,参与骨和软骨组织的发育。已有研究显示,BMP4在生殖细胞发育过程中也发挥重要作用[4]。Li等[5]研究结果揭示BMP4通过参与BMP4/Smad信号通路在精原干细胞分化的调控过程中起重要作用。BMP4参与的信号转导是由细胞内信号转导蛋白Smad介导的,BMP4通过与细胞表面2种丝氨酸/苏氨酸激酶受体(Ⅰ型和Ⅱ型)结合形成异源复合物,Ⅱ型受体使Ⅰ型受体转磷酸化,后者的激活导致Smad 1/5/8的磷酸化,然后导致Smad 1/5/8与Smad 4发生寡聚,并以复合物的形式转移到细胞核并发挥转录因子的作用[6]。人类BMP4参与体内复杂的调控过程,BMP4基因突变与人类眼球缺血性小眼病(Anophthalmia microphthalmia,AM)及SHORT综合征等疾病的发生有关[7-8]。存在于哺乳动物体细胞和生殖细胞中的BMP4/Smad信号通路在精子生成和原始卵泡发育过程中的重要调控作用已得到证实[5,9-10]。
迄今,关于BMP4基因的研究多集中于人和小鼠上,该基因在其他动物上的研究报道较少。人类BMP4基因定位于染色体14q22.2-q23,编码区全长1 227 bp,编码408个氨基酸[7]。小鼠BMP4基因包括5个外显子和4个内含子,其编码区全长1 227 bp,编码408个氨基酸[11]。有报道称BMP4参与猪的卵泡发育过程[12]。从长白×大白杂交育肥猪的肾脏和脊髓中分离得到猪的BMP4编码区序列,长度为1 230 bp,编码409个氨基酸[13]。由NCBI数据库上(https://www.ncbi.nlm.nih.gov/)已发表的数据显示,普通牛BMP4基因定位于10号染色体上,含有3个外显子,2个内含子,编码区全长1 230 bp,编码409个氨基酸。
水牛是我国南方极具开发潜力和价值的家畜,可以奶用、肉用和役用,但水牛繁殖效率低,发情周期长,发情症状不明显,生殖细胞发育迟缓等在一定程度上限制了水牛产业的发展,是目前水牛养殖过程中急需解决的问题。卵巢内卵泡的发生发育对水牛发情周期具有显著影响。已有研究显示,BMP4基因在哺乳动物卵巢生殖细胞成熟发育过程中起着重要的调节作用。因此,对BMP4基因的研究,有助于深入了解水牛卵巢发育和繁殖性状的遗传基础。本研究对槟榔江水牛BMP4基因进行了分离及功能生物信息学和多个组织差异表达分析,以期揭示水牛BMP4基因的分子特征和生物学功能,为深入了解水牛BMP4在生殖细胞成熟过程中的作用机制提供依据。
1 材料和方法
1.1 试验材料
5头雄性和5头雌性的成年、健康的槟榔江水牛各采自云南腾冲市,它们相互之间无直接血缘关系。每头牛屠宰后,分别迅速取心脏、肝脏、脾脏、肺、肾、肌肉、小肠、瘤胃、子宫、卵巢和睾丸组织,置于液氮中,带回实验室。
1.2 组织总RNA提取和cDNA合成
组织样品总RNA提取采用RNAiso Plus(TaKaRa,中国大连)。通过核酸定量仪和琼脂糖凝胶电泳检测其浓度和完整性。cDNA第一链合成采用 Oligo(dT)18(500 μg/mL)和逆转录酶试剂盒(Invitrogen M-MLV,TaKaRa,中国大连)。将cDNA 母液稀释成 50 ng/μL 的工作液,置于-20 ℃冰箱备用。
1.3 BMP4基因序列分离及多组织表达谱检测
根据已公布的普通牛BMP4基因序列(NM_001045877),采用Primer Premier 5.0软件设计分别用于分离该基因完整编码区及多组织差异表达分析的引物。以水牛18SrRNA基因序列(JN412502)设计内参基因PCR引物。设计的引物送上海生物工程有限公司合成。引物信息见表1。

表1 PCR及半定量RT-PCR引物信息Tab.1 Primer information of PCR and Semi-quantitative RT-PCR
进行基因分离采用的PCR体系包含: 10×Buffer(Mg2+15 mmol/mL )4 μL,上、下游引物(10 μmol/μL)各0.7 μL, dNTP(2.5 mmol/mL)2 μL, rTaqDNA聚合酶(5 U/μL)0.25 μL(TaKaRa,中国大连),DNA模板2 μL(约100 ng),ddH2O补至25 μL。扩增程序:95 ℃预变性5 min;94 ℃变性30 s→退火30 s→72 ℃延伸2 min,30个循环;72 ℃后延伸10 min。
各组织差异表达分析采用半定量RT-PCR 方法进行检测,反应体系包含: 10×Buffer(Mg2+15 mmol/mL )2.5 μL,上、下游引物(10 μmol/μL)各0.5 μL, dNTP(2.5 mmol/mL)2 μL, rTaqDNA聚合酶(5 U/μL)0.25 μL(TaKaRa,中国大连),DNA模板2 μL(约100 ng),ddH2O补至25 μL。扩增程序:95 ℃预变性5 min;94 ℃变性30 s→退火30 s→72 ℃延伸40 s,30个循环;72 ℃后延伸5 min。
PCR产物用2%琼脂糖凝胶电泳检测,检测结果用凝胶成像系统进行拍照记录。
1.4 数据分析
应用ORF finder程序(http://www.ncbi.nlm.nih.gov/gorfi/orf.html),对获得的基因序列进行开放阅读框预测,获得编码区全序列。将所获得的CDS序列为查询序列,应用Blast程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行基因同源性搜索,确定获得序列的基因属性。采用在线软件Prosite、MART、Protparam、ProtScale、SignalP 4.0 server、TMHMM-2.0 server、 ProtComp、SOPA、SWISS-MODEL分别预测BMP4蛋白质功能位点、功能结构域、理化性质及氨基酸组成、疏水性、信号肽预测、跨膜结构域、亚细胞定位、二级、三级结构预测。利用EditPlus软件进行序列编辑;利用Bioedit和DNAStar(DNAStar Inc.)软件包进行序列拼接比对;利用MEGA 6进行物种间氨基酸序列比较、N-J系统发育树的构建及突变位点输出。
采用Quantity One 软件分析BMP4基因在各组织中的表达量。
2 结果与分析
2.1 水牛BMP4基因PCR分离
获得目的扩增片段为1 476 bp,结果清晰无杂带,见图1。

M. DL2000分子量;1.水牛BMP4基因RT-PCR产物。M.Marker DL2000; 1.RT-PCR product of buffalo BMP4 gene.
2.2 BMP4 CDS区序列分析
获得水牛BMP4基因的CDS序列为1 230 bp,编码409个氨基酸(图2)。通过NCBI数据库进行同源搜索比对,水牛序列与普通牛(NM_001045877)、野牦牛(XM_005901928)、绵羊(NM_001110277)、山羊(NM_001285646)的BMP4基因序列长度相同,序列同源性皆为99%,确定其为水牛BMP4基因序列(获登录号KF312880)。水牛BMP4基因CDS区A、G、T、C碱基的组成分别为22.68%,28.86%,19.51%,28.94%。在基因结构上,水牛BMP4基因与普通牛的相似,含有3个外显子,2个内含子。
2.3 水牛BMP4分析
2.3.1 基本理化特征 槟榔江水牛与普通牛BMP4蛋白(NP_001039342)序列差异较小,基本理化特征相似,但普通牛BMP4蛋白稳定性略高(表2)。
2.3.2 信号肽、细胞定位和跨膜结构域分析 槟榔江水牛BMP4蛋白具有1个信号肽序列(图3-A),该信号肽序列最大可能裂解位点在24-25位氨基酸。该蛋白不含跨膜结构域,最大疏水位点位于第14位半胱氨酸处(2.978),最大亲水位点位于第307位赖氨酸处(-3.300),属亲水性蛋白(图3-B)。亚细胞定位分析显示,水牛BMP4蛋白属胞外分泌型蛋白。
2.3.3 结构域与结构分析 在水牛BMP4蛋白上发现2个结构域,与普通牛保守结构域一致,在39-276位氨基酸处为TGFβ前导肽(TGFβ_propeptide)结构域,在309-409位氨基酸处为TGF-β超家族结构域,如图4。在BMP4蛋白TGF-beta超家族结构域中,水牛与其他物种一致,均含有7个保守半胱氨酸残基,半胱氨酸在不同物种蛋白序列上的位置见图5。

阴影部分为保守结构域:39-276位氨基酸为TGF-beta前导肽结构域;309-409位氨基酸为TGF-beta超家族结构域;*.终止密码子。The shaded part is a conserved domain: amino acids 39-276 belong to the TGF-beta propeptide domain;Amino acids 309-409 belong to the TGF-beta superfamily domain; *. Stop codon.

基本理化特征Basic physical and chemical properties水牛Buffalo普通牛Cattle氨基酸数 Number of amino acids409409分子质量/ku Molecular weight 46.6446.64等电点/PI Isolectric point 8.578.57 分子式FormulaC2054H3225N619O596S16C2053H3223N619O596S16强酸性氨基酸残基Strongly acidic amino acids (D,E)4646强碱性氨基酸残基Strongly basic amino acids (K,R)5050疏水性氨基酸Hydrophobic amino aciads (A,I,L,F,W,V)128128极性氨基酸Polar amino acids (N,C,Q,S,T,Y)102102不稳定系数Instability index59.4959.02脂肪系数Aliphatic index80.5480.54平均亲水系数Grand average of hydropathicity (GRAVY)-0.543-0.543
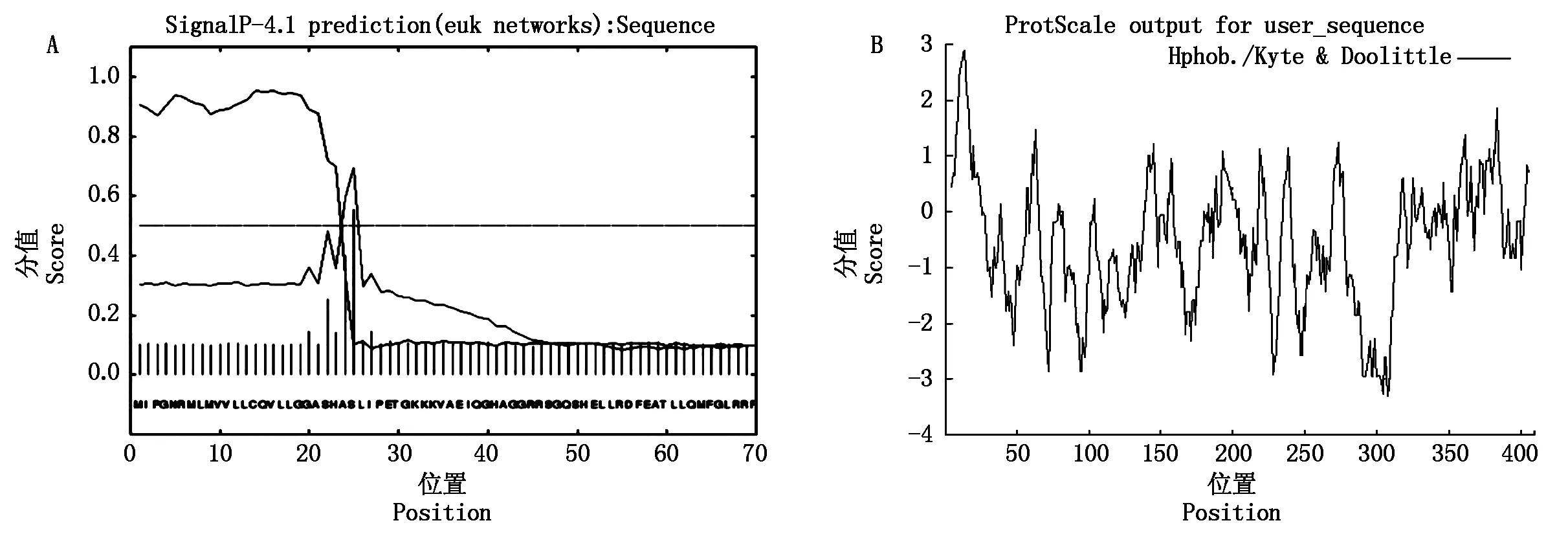
SignalP-4.1 prediction(euk networks): Sequence.由SignalP-4.1程序预测(euk networks)的用户氨基酸序列的信号肽;ProtScale output for user_sequence.由ProtScale程序输出的用户氨基酸序列的疏水性。

图4 水牛BMP 4的保守结构域Fig.4 Putative conserved domain of buffalo BMP 4

- - - - - -.不同物种间完全相同的氨基酸序列;阴影部分为保守半胱氨酸残基。- - - - - -.The same amino acid sequence between different species; The shaded part indicates the conserved Cysteine residue.
二级结构预测,水牛BMP4有24.45%的氨基酸构成α-螺旋(Alpha helices),18.09%的氨基酸构成延伸链(Extended strands),2.20%的氨基酸构成β-转角(Beta turns),55.26%的氨基酸构成无规则卷曲(Random coils)。进行蛋白质同源建模搜索显示,水牛BMP4蛋白序列与Swiss-Model数据库中的同源序列一致性小于30%,同源建模可信度较低。
2.3.4 功能位点预测 水牛与普通牛BMP4蛋白(NP_001039342)功能位点完全一致,预测结果见表3。

表3 蛋白功能位点预测Tab.3 The prediction of protein functional sites
2.3.5 同源性分析 将水牛BMP4氨基酸序列输入NCBI数据库进行同源搜索,获得下列物种的一致序列:牦牛(Bosmutus,XP_005901990)、普通牛(Bostaurus,NP_001039342)、绵羊(Ovisaries,NP_001103747)、山羊(Caprahircus,NP_001272575)、野猪(Susscrofa,NP_001094501)、犬(Canislupusfamiliaris,NP_001274099)、小鼠(Musmusculus,NP_031580)、狒狒(Papioanubis,NP_001162558)、人(Homosapiens,NP_001193)、马(Equuscaballus,NP_001157442)。各物种BMP4蛋白氨基酸序列一致性比对结果见表4。水牛与牦牛的氨基酸序列完全一致,与其他牛科物种序列一致性超过99%,与非牛科物种间序列一致性超过97%。基于以上物种BMP4蛋白的氨基酸序列构建了NJ-系统发育树以揭示不同物种间BMP4蛋白的进化关系,结果表明,牛科物种聚在一起,且有较高的支持率(85%)(图6)。

表4 不同物种间BMP4氨基酸序列一致性与分歧度Tab.4 Amino acid sequence consistency and divergence of BMP4 between different species %
注:对角线上方数值表示序列一致性,对角线下方数值表示序列分歧度。
Note: Data above the diagonal line represent the percent identify and below the diagonal line represent the sequential divergence.

图6 水牛与其他物种BMP4氨基酸序列N-J系统树Fig.6 N-J phylogenetic tree of BMP4 amino acid sequences in buffalo and other species
2.4 组织差异表达分析
采用半定量RT-PCR法,以18SrRNA作为内参,检测BMP4在槟榔江水牛11个组织中的差异表达。结果显示(图7),BMP4基因只在水牛子宫、卵巢和睾丸中表达,其中在睾丸组织中表达水平最高。

18S rRNA表达作为内参。M.DL2000 DNA Marker。1.子宫;2.卵巢;3.肝脏;4.瘤胃;5.小肠;6.肌肉;7.肾;8.肺;9.脾脏;10.睾丸;11.心脏。The expression level of 18S rRNA served as an internal control. M.DL2000 DNA Marker; 1. Testis; 2. Ovary; 3. Uterus; 4. Rumen; 5. Small intestine; 6. Muscle; 7. Kidney; 8. Lung; 9. Spleen; 10. Liver; 11. Heart.
3 讨论
本研究分离获得槟榔江水牛BMP4基因的编码区序列长为1 230 bp,编码409个氨基酸,与普通牛BMP4基因编码区序列长度相同,序列一致性为99%。生物信息学分析显示,槟榔江水牛BMP4蛋白含有一个信号肽,平均亲水系数为-0.543,为亲水性蛋白,不具有跨膜结构域,属于胞外分泌型蛋白;水牛BMP4含有TGF-beta前导肽和TGF-beta超家族结构域。氨基酸序列比对结果显示,水牛与野牦牛、普通牛、人、犬和小鼠等其他10个物种BMP4序列一致性在97%以上。物种间BMP4蛋白序列一致性较高,揭示了BMP4蛋白序列在进化上具有保守性。水牛与普通牛的BMP4基本理化特征、结构和功能位点极相似;在构建的系统发育树上,水牛与野牦牛、普通牛、山羊和绵羊聚在一起,表明水牛与牛科其他物种的BMP4在功能上更接近。
作为BMP/Smad信号通路的重要激活因子,BMP4在不同组织和器官内广泛存在并被特异性激活,进而调控细胞增殖、黏附、迁移、分化和凋亡等一系列细胞代谢过程,在胚胎发生和组织内稳态过程发挥着重要作用[5]。BMP4所含有的2个结构域中,TGF-β前导肽结构域又称潜在相关肽(Latency associated peptide,LAP),LAP与BMP4在体内的组织特异性表达和传导范围有关,是产生具备稳定功能活性的成熟BMP4蛋白所必需的调节肽[14];TGF-β结构域存在7个保守的半胱氨酸,其中6个形成3个分子内二硫键,称为胱氨酸结,第7个半胱氨酸通过另一个单体结合形成共价二硫键,从而形成生物活性信号分子,并通过与Ⅰ型和Ⅱ型丝氨酸或苏氨酸激酶受体结合来启动信号传递[3]。人类BMP4基因的移码突变(c.226del2,p.S76fs104X)发生于TGF-β前体结构域N-末端,个体表现出AM、视网膜营养不良、近视、多指/并指和原发性脑发育障碍等症状[7]。大量研究表明,BMP系统在卵泡发生和排卵的过程中起着重要调节的作用,在原始卵泡、初级卵泡、次级卵泡和腔卵泡的卵母细胞中均有磷酸化Smad1/5的表达,表明BMP4/Smad信号通路促进原始卵泡发育启动和原始卵泡存活[10]。免疫组化试验表明,BMP4、BMP6、BMP7及其受体BMPRIB、BMPRII、ActRII和ActRIIB等在牛卵泡膜细胞中均有表达,这些受体可与BMP-4、BMP-6和BMP-7结合并形成功能性信号传导复合物,从而激活Smad介导的细胞内转导途径,调控卵泡膜细胞的增殖,肽类激素分泌等细胞反应[15]。免疫组化试验证实,BMP4、BMP6、BMP7及其受体BMPR1和BMPR2在成年女性颗粒细胞内表达[16]。BMP4是目前确认的唯一一个调控成人支持细胞发育和功能的自分泌因子,内源性BMP4通过激活Smad1/5和ID2/3通路,促进成人支持细胞增殖及雄激素受体等精子生成必需蛋白的合成,其活性异常与人类非阻塞性无精症有关[17]。本研究所得水牛BMP4序列也具有TGF-beta前导肽结构域和TGF-beta超家族结构域,与人类、普通牛等物种的BMP4保守结构域相同,功能位点种类一致,特别值得一提的是在BMP4蛋白TGF-beta超家族结构域中,水牛与其他物种都含有7个保守半胱氨酸残基,其所构成的半胱氨酸结构基序是BMP4蛋白发挥功能的重要结构基础。表明水牛BMP4蛋白与其他物种BMP4的功能相近,推测其可能参与水牛体内BMP4/Smad信号通路的转导,在水牛骨骼形成、卵泡发育和精子形成等过程中发挥重要调控功能。
BMP4在小鼠多种卵巢细胞类型中表达,在卵泡膜、黄体、卵巢表面上皮、性索和部分血管内皮细胞中mRNA表达水平最高,在发育中的优势卵泡膜中mRNA表达水平较高,在闭锁卵泡中mRNA表达水平非常低或不可检测[18]。Fatehi等[19]研究发现,BMP4基因mRNA在牛窦卵泡所有腔体中都有表达。实时荧光定量PCR结果显示,BMP4在牛退化胚胎中的表达量较囊胚高,母体卵巢内BMP4基因型与体外培养的囊胚率显著相关,表明BMP4在胚胎和母体水平上对着床前胚胎发育起着重要的调节作用[20]。本研究显示,BMP4基因在槟榔江水牛的卵巢、子宫组织中均有表达,揭示该基因在水牛这些组织中发挥功能,特别是在卵巢中可能参与了卵泡成熟过程。Hu等[21]发现,BMP4的mRNA主要表达于雄性小鼠精母细胞和支持细胞中,且在附睾发育过程中持续表达,在C57BL/6背景的BMP4杂合子雄性小鼠中出现生殖细胞退化、精子数量减少和精子活力下降等现象。RT-PCR显示BMP4及其3种受体基因的转录本在新鲜分离的成人支持细胞和睾丸组织中表达。本研究发现,BMP4在水牛睾丸组织中表达且表达量最高,推测BMP4基因在水牛雄性生殖细胞发育过程中发挥重要功能。鉴于BMP4基因在水牛生殖过程中的重要作用,进一步了解其具体的调控机制将有助于解析水牛繁殖性状的形成机理,可为水牛繁殖性状的选育提供依据。

