液质联用仪的基质效应研究
左英芳
(焦作市畜产品质量安全监测中心,河南 焦作 454003)
1 基质效应概述
基质效应(matrix effect,ME)是指在样品测试过程中,由于待测物以外其他物质的存在或者其他的物理、化学因素,直接或间接影响待测物响应的现象。包括基质抑制效应和基质增强效应。
2 基质效应产生的原因
2.1 ESI离子源工作原理
(1)毛细管加2~4kV高压,造成氧化还原反应形成带电的小液滴。
(2)溶剂蒸发小液滴碎裂,电荷密度增大,离子集中到液滴表面。
(3)离子从液滴表面蒸发出来形成气相离子。
2.2 基质效应产生的理论
基质效应源于随待测物一起进入到离子源的样品或流动相中的基质成分与待测物在雾滴表面离子化过程的竞争(ESI离子源),其竞争结果会降低(离子抑制)或增加(离子增强)目标离子的生成效率及离子强度,进而影响测定结果的准确度和精密度。
2.3 基质的种类
(1)样品中含有的内源性物质、体内药物的多个代谢产物或其他同类药物引起。具体分为以下几种:①饲料:蛋白质、脂肪、糖类、氨基酸、无机盐等。②尿液:无机盐。③动物组织:蛋白质、脂肪、其他内源性物质等。④血液:蛋白质、内源性磷脂等。⑤药物:溶剂中表面活性剂,吐温80,聚乙二醇400。不同种类样品或来源不同的样品产生的基质效应不同。
(2)前处理过程中塑料管内残留的聚合物、有机酸、缓冲液、SPE柱材料等引起。
(3)流动相残留的K、Na离子及酸的影响,形成加钠[M+23]+、加钾[M+39]+或加酸离子。
3 基质效应产生的评价
绝对基质效应:基质匹配标准品与标准品的信号响应差异,影响分析方法的准确度
ME<100%离子抑制;ME=100%无基质效应;ME>100%离子增强。一般要求控制在85%~115%之间。
相对基质效应:不同样品间的信号响应差异,影响分析方法的精密度与准确度。
评价方法:比较至少5个不同来源的同类样品提取后加入待测物的信号响应差异来评价,5个不同来源的样品所形成的标准曲线的斜率的相对标准偏差不超过4%则认为无相对基质效应。
其他评价方法:柱后输注法通过T型阀将待测物连续从色谱柱后的注射器入,同时空白样品基质进样到色谱柱。
4 基质效应产生的消除
(1)优化样品前处理方法--最大限度地去除基质成分。具体采用以下几种常见方法,当然,也可以几种方法多联合使用。
①沉淀蛋白法(PPT):盐析、等电点沉淀、甲醇乙腈等有机溶剂沉淀、生物碱试剂初与某些酸(如三氮醋酸)沉淀等,可最大限度除去蛋白质,但不能有效去除盐类和脂类化台物。
②液液萃取(LE):可去除蛋白质、无机盐、脂肪但两性药物或极性较大的化合物难萃取。
③固相萃取法(SPE):可有效去除蛋白质、无机盐、脂肪,适用于大部分药物。
④Quechers:可去除有机酸、脂肪酸、碳水化合物、色素等。
(2)优化样品前处理方法--柱切换技术:二维色谱、在线固相萃取等。先将大分子、无机盐等与待测物分离,排除内源性物质干扰,然后将药物切换到另一支色谱柱上完成色谱分离。
(3)优化色谱质普条件:优化质谱参数:ESI源受基质影响较大。优化色谱条件:选择合适的有机相、加入酸(甲酸)、碱(氨水)、挥发性盐(甲酸铵、乙酸铵),改善分离增加保留时可减少共流出物,梯度洗等。
(4)选择合适的内标:采用内标法消除基质效应,选择与待测物理化性质、色谱行为相似的内标物,一般采用同位素内标。
(5)外标法定量时使用基质相似的基质标准溶液校正结果
(6)稀释样品或减小进样量,但应兼顾灵敏度
(7)用标准加入法
单点标准加入法:先测量样品的响应值AX,然后加入少量的标准溶液后测定样品的响应值A,按下式计算:
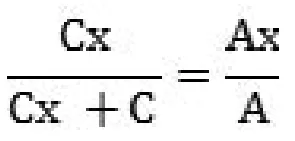
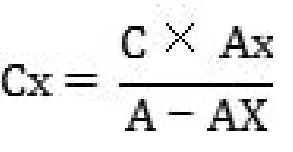
尤其适合于没有空白样品的比对试验!
标准曲线加入法:曲线截距即为待测物含量
5 小结
(1)养成良好的操作习惯,每批样品检测时设置质控样品考察基质效应(试剂空白、样品空白、溶剂空白(进样时)、标准溶液、基质标准溶液等)。
(2)液质方法验证时要验证基质效应的影响。
(3)善于收集日常检测数据,注重总结,丰富经验。收集同一方法不同种类样品的基质效应、同类不同来源样品的基质效应数据比较差异,分析原因,优化方法积累经验。
——化工原料、农副产品

