响应面法优化大豆分离蛋白物理改性工艺研究
王 晴,钱玉梅,李红侠,黄 铜,李梅梅
宿州学院生物与食品工程学院,安徽宿州,234000
大豆分离蛋白是以脱脂豆粕为原料生产的蛋白质类食品添加剂,营养价值高,功能性质优良,但其加工稳定性较差,对温度、pH等敏感,常需改性来提高性能,拓宽大豆分离蛋白的应用领域[1-2]。改性方法通常分为物理改性、化学改性和酶改性等。相较于化学改性和酶改性法,物理改性具有安全性高、成本低、无毒副作用等优点,是具有广阔前景的大豆分离蛋白改性方法[3-4]。
本文采用高温加热和高速剪切处理大豆分离蛋白,以乳化稳定性或持水性作为响应值,大豆分离蛋白浓度、加热温度和均质时间作为单因素考察条件,响应面法进行试验设计与分析,得到最优改性条件,为大豆分离蛋白进一步开发和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(SPI)(购于河南宏益生物科技有限公司)、润记大豆油(购于宿州市大润发超市)、十二烷基硫酸钠(SDS)(购于国药集团化学试剂有限公司)。
1.2 仪器与设备
HH-2数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司)、FA1104B电子天平(上海越平科学仪器有限公司)、722可见分光光度计(上海元析仪器有限公司)、TD4台式离心机(湖南仪器仪表总厂离心机厂)、FA25-D数显型高速剪切分散乳化机(上海弗鲁克流体机械制造有限公司)。
1.3 方法
1.3.1 大豆分离蛋白改性方法
将一定浓度的大豆分离蛋白溶液在一定温度下加热处理10 min,室温冷却,于10 000 r/min条件下进行高速剪切处理一定时间,得到改性大豆分离蛋白溶液[5]。
1.3.2 乳化稳定性的测定
改性大豆分离蛋白溶液与等体积大豆油混合,10 000 r/min高速剪切1 min得到混合乳浊液。在0 min、30 min时从乳浊液底部移取溶液,与0.1% SDS混合均匀,于500 nm下分别测定吸光值。乳化稳定性(ESI)由下式计算得到[6]:
(1)
ESI为乳化稳定性;A30为间隔30 min后大豆分离蛋白的吸光度值;Δt为时间间隔;ΔA为吸光度差值。
1.3.3 持水性的测定
已知体积的改性大豆分离蛋白溶液置于温度25 ℃,转速3 000 r/min条件下离心20 min,精密测量上清液体积,持水性(water-holding ability,WHC)的计算方法为[7]:
(2)
WHC为持水性(mL/g);W0为大豆分离蛋白样品重量;V1为离心前溶液体积;V2为离心后上清液体积。
1.4 单因素试验
1.4.1 大豆分离蛋白浓度对乳化稳定性和持水性的影响
取质量分数分别为6%、7%、8%、9%、10%的大豆分离蛋白溶液,选取加热温度为90 ℃,均质时间为40 s。考察经高温加热和高速剪切改性后,不同大豆分离蛋白浓度对溶液体系乳化稳定性和持水性的影响。
1.4.2 加热温度对乳化稳定性和持水性的影响
取质量分数均为8%的大豆分离蛋白溶液,选取均质时间为40 s,加热温度分别设置为60 ℃、70 ℃、80 ℃、90 ℃、100 ℃。考察经高温加热和高速剪切改性后,不同加热温度对溶液体系乳化稳定性和持水性的影响。
1.4.3 均质时间对乳化稳定性和持水性的影响
取质量分数均为8%的大豆分离蛋白溶液,选取加热温度为90 ℃,均质时间分别设置为10 s、20 s、30 s、40 s、50 s。考察经高温加热和高速剪切改性后,不同均质时间对溶液体系乳化稳定性和持水性的影响。
1.5 响应面法探究最佳工艺
根据单因素结果进行试验设计,具体因素水平如表1,使用Design-Expert 8软件进行响应面试验设计和工艺优化。

表1 试验设计编码值和实际值
2 结果与分析
2.1 单因素试验
2.1.1 大豆分离蛋白浓度对乳化稳定性和持水性的影响
大豆分离蛋白浓度对乳化稳定性和持水性的影响见图1。由图1可知,改性后大豆分离蛋白在一定的浓度范围内,其乳化稳定性和持水性逐渐增高,随后逐渐下降,可能由于大豆分离蛋白浓度过高影响球状蛋白质伸展,其疏水基团不再暴露至分子外,且经高温加热处理时,浓度高的溶液分子间作用力相对较强,空间结构改变明显,黏度增大,若浓度过高,分子间的相互作用会受抑制,蛋白质主链上疏水基团无法完全打开,因而溶液黏度开始下降,两相界面稳定性随之降低而导致乳化稳定性下降;大豆分离蛋白浓度超过8%,持水性也开始下降,可能由于水分子间发生相互吸引,主要是沿着蛋白质碳链骨架的极性基团,分布不均匀会影响持水效果,改性会使极性基团发生转移,浓度过高后基团停止转移,无法继续与水分子结合,使得持水性下降[8-9]。综合分析得知,乳化稳定性和持水性在大豆分离蛋白浓度为8%时均达到最大值,此条件下持水效果最好。
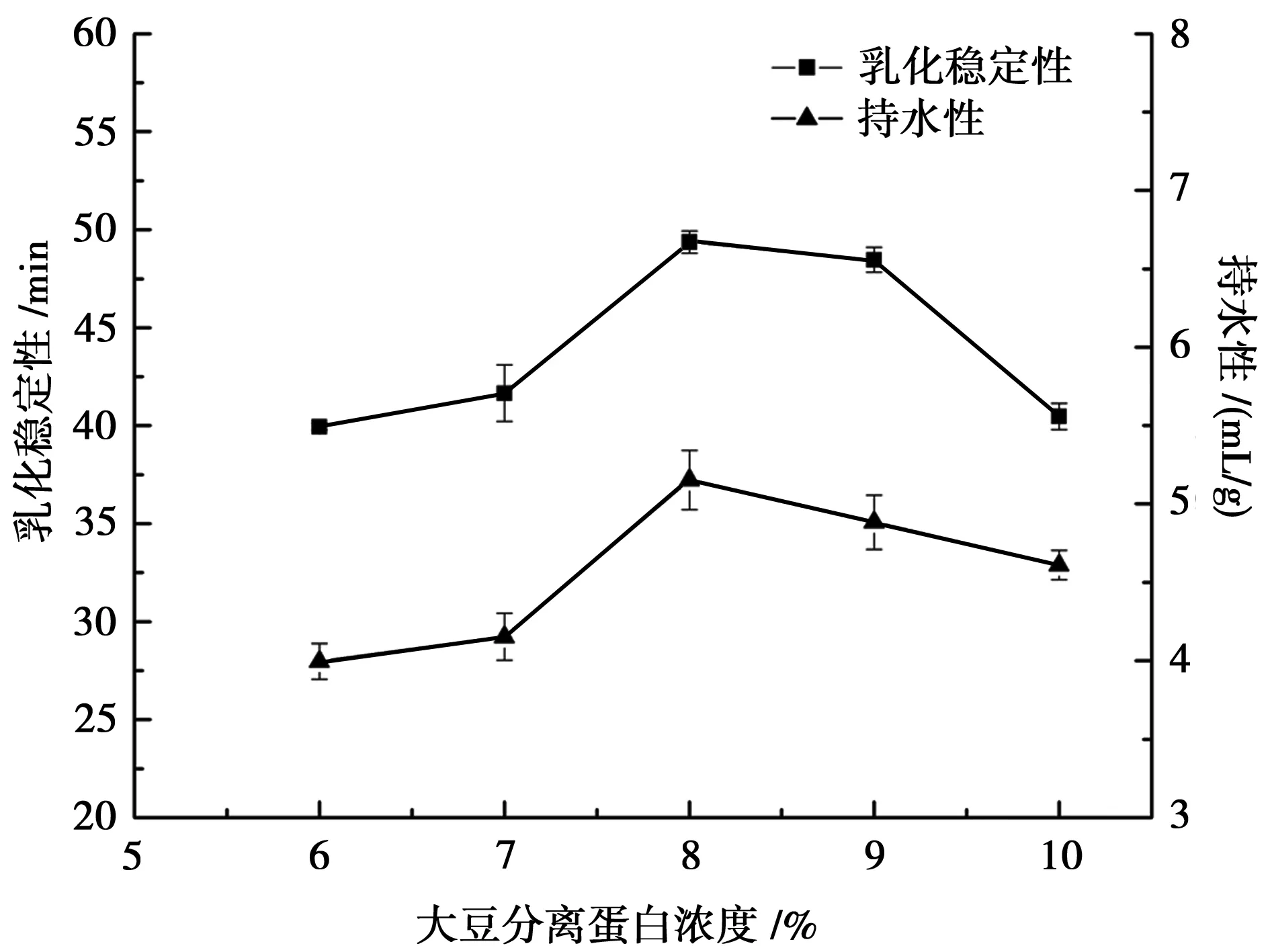
图1 大豆分离蛋白浓度对乳化稳定性和持水性的影响
2.1.2 加热温度对乳化稳定性和持水性的影响

图2 加热温度对乳化稳定性和持水性的影响
改性加热温度对大豆分离蛋白乳化稳定性和持水性有不同程度的作用,见图2。当改性加热温度在60 ℃至90 ℃之间,改性大豆分离蛋白乳化稳定性呈明显上升趋势,高于90 ℃后迅速下降,原因可能是在适宜温度范围内,疏水基团随温度升高暴露加快,但加热温度过高会使疏水基团停止暴露不再往外延伸,改性发生逆转[10-11];加热温度在60 ℃至90 ℃间,改性大豆分离蛋白持水性缓慢增加,且在90 ℃到100 ℃间基本保持稳定,说明此时温度改变对改性大豆分离蛋白的持水性影响较小。综合分析得知,乳化稳定性在加热温度为90 ℃时达到最大值,此温度下持水性也最高。
2.1.3 均质时间对乳化稳定性和持水性的影响
均质时间对改性大豆分离蛋白乳化稳定性和持水性影响见图3。由图3可以看出,改性大豆分离蛋白乳化稳定性呈先升高后缓慢下降趋势,持水性呈先升高后快速下降趋势,原因可能是均质时间过长,导致原本已经暴露的疏水基团遭到破坏,疏水基团受损,极性基团减少,使乳化稳定性和持水性无法保持优势状态[12]。综合分析得知,乳化稳定性和持水性在均质时间40 s时均达到最大值。
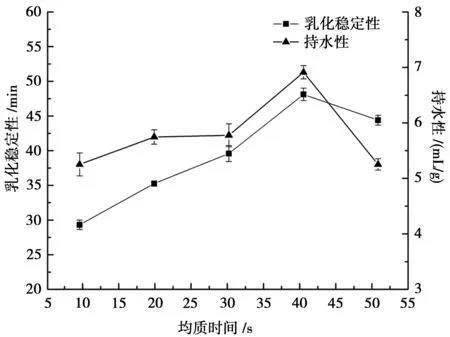
图3 均质时间对乳化稳定性和持水性的影响
2.2 响应面探究最佳工艺
在单因素试验基础上,利用Design-Expert8软件进行分析试验,计算各组合工艺下改性大豆分离蛋白的乳化稳定性及持水性,对试验结果进行回归拟合,试验结果、拟合方程及方程方差分析如表2-5所示。

表3 模型拟合结果

表4 乳化稳定性模拟方差分析
注:*P<0.05;**P<0.01。
表4表明,Y1(乳化稳定性)拟合模型P< 0.000 1为极显著,该模型具有统计学意义,失拟项P=0.835 9>0.05为不显著,无失拟因素存在,且从表3中Y1拟合模型的R2值可知,回归模型与试验拟合度较好,可用于乳化稳定性的分析和预测。比较表4中F值可得,各因素对乳化稳定性影响的主次顺序为A>C>B,两两交互对乳化稳定性影响的主次顺序为:BC>AC>AB。
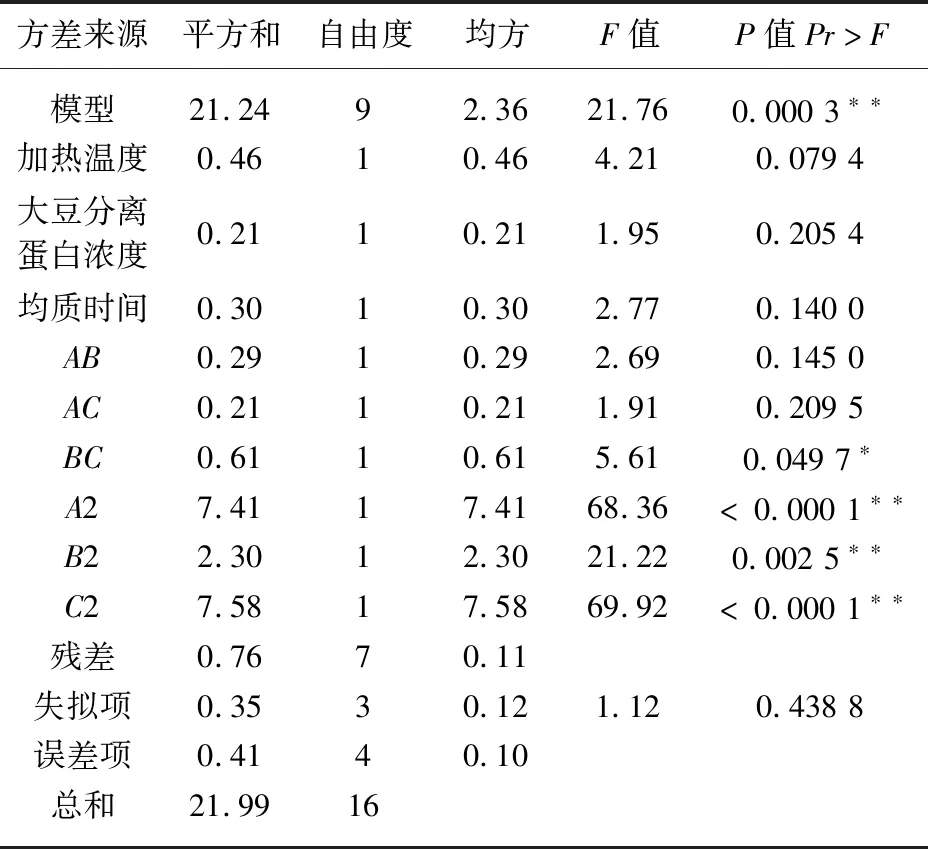
表5 持水性模拟方差分析
注:*P<0.05;**P<0.01。
表5表明,Y2(持水性)拟合模型P值为0.000 3极显著,失拟项P=0.438 8不显著,且从表3中此模型的R2值可知,回归模型与试验拟合度较好,可用于持水性的分析和预测。比较表5中F值可得,各因素对持水性影响的主次顺序为A>C>B,与乳化稳定性相一致,两两交互影响的主次顺序为:BC>AB>AC。
2.3 最佳工艺的确定与验证
通过响应面试验,综合考虑乳化稳定性和持水性,最佳工艺条件为:大豆分离蛋白浓度7.93%、加热温度92.70 ℃、均质时间39.79 s,此工艺条件下乳化稳定性为55.43 min,持水性为6.38 mL/g。为方便实际操作,在大豆分离蛋白浓度为8%、加热温度为93 ℃、均质时间为40 s的条件下进行3次验证试验,结果为:乳化稳定性为55.18±1.02 min、持水性为6.18±0.53 mL/g,符合模型预测值,因而模型拟合可靠。
3 结 论
对大豆分离蛋白进行高温加热和高速剪切处理,选取大豆分离蛋白浓度、加热温度和均质时间为单因素,以乳化稳定性或持水性为响应面值,优化了大豆分离蛋白乳化稳定性和持水性的工艺条件。得到最优条件为:大豆分离蛋白浓度为8%、加热温度为93 ℃、均质时间为40 s,此时改性大豆分离蛋白的乳化稳定性为55.18±1.02 min,持水性为6.18±0.53 mL/g。经最优条件改性后,大豆分离蛋白乳化稳定性和持水性得到提升,具有优良的加工特性,拓宽了大豆分离蛋白在食品加工中的应用领域,增加了大豆分离蛋白的附加价值。

