澳洲坚果不定芽诱导及生根培养研究
邹家通 罗一然 韩国伟 何小帆 和润喜 何承忠,3
( 1. 西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650233;2. 西南林业大学西南地区生物多样性保育国家林业局重点实验室,云南 昆明 650233;3. 西南林业大学西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650233)
澳洲坚果(Macadamia ternifolia)又称为澳洲胡桃、夏威夷果、昆士兰坚果、巴布果,属山龙眼科(Proteaceae)澳洲坚果属(Macadamia)的常绿乔木。原产于澳大利亚东南部的昆士兰洲沿海地区及新南威尔士洲北部的江河地区,因其具有丰富的营养和独特的风味而备受消费者青睐,且价格昂贵,具有很大的市场潜力和很高的经济价值、科研价值。我国自20世纪70年代引进澳洲坚果品种并开展了环境适应性试验,至今已成为澳洲坚果发展最快、种植面积最大的国家[1]。目前,澳洲坚果苗木繁殖方法主要采用扦插育苗和嫁接育苗[2]。
组织培养快繁技术不仅能够实现植物优良品种的工厂化育苗,在较短时间内达到规模化生产苗木,且组培再生体系的建立也是开展植物分子育种的前提和基础[3]。Gitonga等[4]探讨了澳洲坚果组织培养的基本条件,并在WPM培养基上以幼嫩茎段为外植体获得了高达98%的萌芽率,但进一步尝试生根诱导时,没有获得成功。Cha-um等[5]以蛭石为载体,向培养容器中充入高浓度CO2,从而获得了根系发达的粗壳澳洲坚果品种"Keaau"的生根苗。国内有关澳洲坚果组培技术报道较少,肖再云[6]利用茎段培养愈伤组织和畸胚,再进一步培养分化获得不定芽,剪下单芽诱导生根培养60 d,再将这些无根苗移入沙床中炼苗60 d,最终获得了生根苗。郭凌飞等[7]在澳洲坚果成年树上剪取带芽茎段进行组织培养研究,获得了萌芽率较好的培养基配方,但未能成功获得生根苗。由此可见,目前国内澳洲坚果组织培养技术尚不成熟,限制了澳洲坚果遗传改良、良种快繁及现代生物技术育种等工作[8]。澳洲坚果是多年生木本植物,其外植体存在脱毒难、易褐化、生根诱导困难等问题。本研究以澳洲坚果‘H2’品种幼苗的带腋芽茎段为外植体材料,通过开展不同植物生长调节剂及其配比对腋芽启动、增殖及生根的影响研究,从而建立其组织培养快繁技术体系,为澳洲坚果优良品种苗木规模化繁育、人工多倍体诱导育种及现代生物技术育种等研究提供参考。
1 材料与方法
1.1 材料来源
供试材料为德宏州林业局苗圃中心引种栽培的澳洲坚果‘H2’品种2年生实生苗,将苗木带回昆明并栽种于西南林业大学格林温室,待苗木抽生新梢后,取着生有侧芽的幼嫩茎段为外植体。
1.2 试验方法
1.2.1 外植体消毒
将剪取的幼嫩茎段切除叶片,用洗洁精溶液清洗其表面的泥土及灰尘,之后置于烧杯中流水冲洗1 h。在超净工作台上先用75%乙醇浸泡20 s,再用无菌水冲洗4次,5%次氯酸钠浸泡3 min,0.1%升汞处理5 min,用无菌水冲洗5次,无菌滤纸吸干表面水分,备用。
1.2.2 腋芽启动培养
将消毒处理后的外植体截取长度为2.5~3.0 cm的带腋芽茎段,将其竖直插入腋芽启动培养基中。腋芽诱导培养基设计的因素及水平为:6-BA 1.0、2.0、3.0 mg/L; IBA 0、0.5、1.0 mg/L;NAA 0、0.5、1.0 mg/L;活性炭(AC)0、200、400 mg/L。以WPM为基本培养基,添加20 g/L蔗糖和4 g/L琼脂。采用L9(34)正交试验探索不同浓度6-BA、IBA、NAA、AC对腋芽启动培养的影响。试验共9个处理,每个处理接种5瓶,每瓶接种3个外植体,3次重复。接种后定期观察和记录腋芽萌发情况,15 d后统计腋芽诱导系数。
1.2.3 腋芽增殖培养
待腋芽萌发生长至1~2 cm时,将其切下接种于不定芽分化的增殖培养基中。增殖培养基以MS为基本培养基,加入30 g/L蔗糖和4 g/L琼脂,分别添加2.0 mg/L的TDZ、2.0 mg/L的6-BA、0.5 mg/L或 1.0 mg/L的 NAA以及 0.5 mg/L或1.0 mg/L的KT。共设计8个处理组合,每个处理组合接种5瓶,每瓶接入3个单芽,3次重复,培养45 d后统计不定芽增殖系数。
1.2.4 生根诱导培养
待不定芽生长高度达到2 cm左右时,剪取生长健壮的不定芽,接种于生根培养基诱导生根。生根培养以WPM、1/2MS为基本培养基,加入30 g/L蔗糖,4 g/L琼脂,200 mg/ L的AC,植物生长调节剂6-BA 0.2 mg/L,NAA 1.0 mg/L,IBA(0.5、1.0 mg/L),ABA 0.5 mg/L,调节培养基酸度分别为pH=5.0和pH=6.0两个水平。共设置8个处理组合,每个处理组合接种5瓶,每瓶接种3个不定芽,3次重复。培养40 d后统计生根率,并观察组培苗生长状况。
1.2.5 炼苗移栽
生根组培苗苗高达到4~5 cm时即可进行炼苗。在培养室内打开瓶盖,放置3~4 d,然后移至室温下放置7 d,取出生根苗洗净粘附在根部的培养基,移栽到用多菌灵消毒后的基质中(珍珠岩、河沙、红土、腐殖土4种基质按不同比例混合配制),移栽后定期采用雾状化喷水保湿,于14 d后统计成活率。
1.2.6 培养条件
培养条件为昼温(25±2)℃,夜温(22±2)℃,光照强度2 000~2 500 lx,光照时间12 h/d。
1.2.7 数据统计与分析
采用Excel 2007进行数据整理,运用SPSS 22.0软件对试验数据进行统计分析,多重比较采用Duncan’s新复极差测验法(P<0.01)进行显著性分析。
主要指标计算公式如下:

2 结果与分析
2.1 植物生长调节剂配比对腋芽萌发的影响
将消毒外理后的带腋芽幼嫩茎段接入含不同浓度植物生长调节剂配比的培养基中,15 d后腋芽萌发(图1a)及生长状况见表1。由表1可见,处理组合AG6为最优组合,萌发的腋芽生长健壮,叶片翠绿舒展,且腋芽诱导系数达到3.51,极显著地高于其他处理组合,表明植物生长调节剂6-BA与IBA按一定浓度配比使用时,对澳洲坚果腋芽萌发具有显著的促进作用,且有利于萌发后的腋芽生长。处理组合AG1的腋芽诱导系数最低,仅为0.42,说明在WPM基本培养中仅添加植物生长调节剂6-BA,对澳洲坚果腋芽萌发和腋芽生长的作用效果不明显。然而,当6-BA使用浓度为3.0 mg/L时,无论与IBA、NAA共同配比使用,还是仅与IBA或NAA配比使用,虽然对腋芽萌发具有较好的促进作用,但萌发抽生的腋芽出现较严重的玻璃化和叶片畸形现象(处理组合AG7,AG8和AG9)。此外,在培养基中添加适量的活性炭(AC),腋芽生长更为健壮,叶色翠绿。因此,结合腋芽生长状况和诱导系数,从节约成本方面考虑,较适宜澳洲坚果茎段腋芽萌发的培养基为WPM+ 6-BA 2.0 mg/L+IBA 1.0 mg/L+AC 200 mg/L。

图 1 澳洲坚果不定芽诱导与生根培养Fig. 1 Adventitious bud induction and rooting culture of M. ternifolia

表 1 不同植物生长调节剂配比对腋芽萌发的影响Table 1 Effects of different exogenous hormones ratio on the axillary bud germination
2.2 植物生长调节剂配比对腋芽增殖的影响
将生长健壮,高度达到2.0 cm以上的腋芽从基部切下,竖直接种于增殖培养基,45 d后统计增殖系数及不定芽生长情况(图1b和表2)。由表2可知,不同处理组合间的不定芽增殖系数呈极显著差异(P<0.01)。其中处理组合AP7的增殖系数最高(3.49),其次是处理组合AP3,增殖系数为3.09,二者之间差异不显著,且诱导发生的不定芽生长势良好,而TDZ + KT/NAA组合(AP1,AP2,AP5和AP6)不仅增殖系数低,而且诱导发生的不定芽生长势一般,表明6-BA +KT/NAA组合更适宜于澳洲坚果腋芽的增殖培养。此外,澳洲坚果不定芽对NAA比较敏感。当NAA浓度为0.5 mg/L时(处理组合AP1,AP3),不定芽生长良好;而NAA浓度增加为1.0 mg/L时(处理组合AP2,AP4),则引起不定芽的玻璃化。植物生长调节剂KT与TDZ组合对澳洲坚果不定芽也存在相同的作用效果,但KT与6-BA组合中(处理组合AP7,AP8),KT浓度为0.5 mg/L或1.0 mg/L时均没有出现玻璃化现象。综合上述分析认为,澳洲坚果腋芽增殖的适宜培养基为MS+6-BA 2.0 mg/L+KT 0.5 mg/L。
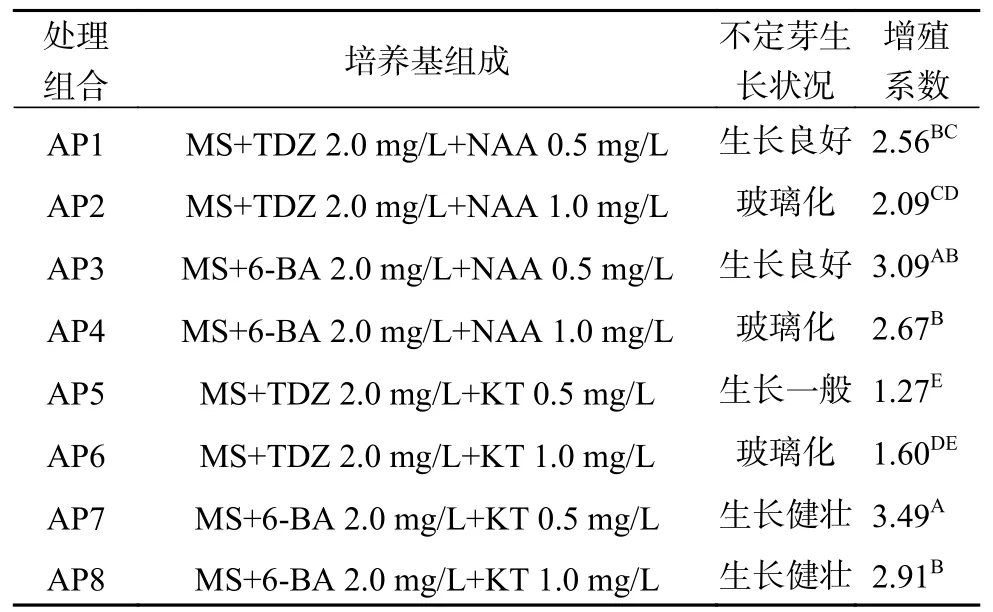
表 2 不同植物生长调节剂配比处理对腋芽增殖的影响Table 2 Effects of different exogenous hormones ratio on proliferation of axillary bud
2.3 植物生长调节剂配比对诱导生根的影响
剪取生长健壮的不定芽,接种于生根培养基诱导生根(图1c),培养40 d后不定芽生根结果见表3。结果显示,当培养基pH=6.0时,仅有3个处理组合(R2,R6,R8)诱导不定芽产生不定根,生根率最高值为16.3%;当培养基pH=5.0时,除R1处理组合外,其他7个处理组合均能够诱导不定芽产生不定根,生根率最高值达到42.2%,表明生根培养基pH=5.0更适宜于澳洲坚果不定芽的生根培养。在植物生长调节剂配比相同的情况下,以1/2MS为基本培养基的处理组合生根率均显著高于以WPM为基本培养基的处理组合生根率,说明1/2MS基本培养基较WPM基本培养基更适宜用于澳洲坚果不定芽的生根培养。进一步分析发现,接种于添加有ABA成分的培养基(处理组合R2和R6),不定芽生根率显著高于其他培养基,表明植物生长调节剂ABA对澳洲坚果不定芽诱导生根具有促进作用。由此可知,可用于澳洲坚果不定芽诱导生根的培养基为1/2MS+6-BA 0.2 mg/L+IBA 0.5 mg/L+ABA 0.5 mg/L,pH=5.0。

表 3 不同植物生长调节剂配比对生根诱导的影响Table 3 Effects of different exogenous hormones ratio on rooting induction
2.4 基质对组培苗移栽成活的影响
将澳洲坚果组培苗在培养室内开瓶炼苗3 d,移至实验室内室温下炼苗5 d后,移栽于不同基质中(图1d),14 d后统计成活情况(表4)。由表4可见,组培苗移栽成活率最高者是配比组合S2,成活率达到66.7%,其次是配比组合S1,移栽成活率为66.3%,移栽成活率最低者是配比组合S3(53.3%),但各配比组合基质间的组培苗移栽成活率差异不显著(P=0.397>0.05),而含有河沙的栽种基质有利于组培苗成活。由此,V(河沙)∶V(红土)∶ V(腐殖土)=1∶ 1∶ 1的基质适用于澳洲坚果组培苗的移栽。

表 4 不同基质对组培苗成活的影响Table 4 Effects of different substrates on survival rate
3 结论与讨论
植物细胞在理论上都存在全能性,任何植物的器官或组织都能作为组织培养的外植体[9]。但在组织培养实践中,植物不同品种、组织或器官,其分化能力存在显著差异,而且外植体的生理年龄、生长阶段与取材部位等都直接影响着组织培养技术体系的建立,因此,外植体选择是组织培养能否成功的首要因素[10]。在很多木本植物组织培养中,选择以叶片、叶柄作为外植体,均能获得较好的诱导效果。在预试验时,采集‘H2’澳洲坚果的幼嫩叶片、叶柄和幼嫩茎段作为外植体开展诱导研究,但叶片和叶柄的分化能力差,均在30 d后逐渐褐化、变黄死亡,只有以幼嫩茎段作为外植体获得了较好的诱导效果。
澳洲坚果组培苗诱导生根较困难。郭凌飞等[7]和Bhalla等[11]在研究澳洲坚果组织培养时,曾尝试添加多种植物生长调节剂进行诱导生根,但均未获得理想效果。Cha-um等[5]将澳洲坚果不定芽接入以蛭石为载体的MS液态培养基中,并向培养容器中注入高浓度CO2,成功诱导出了不定根。一般地,WPM培养基更适合于木本植物的组培苗生根培养,但本研究结果表明,‘H2’澳洲坚果组培苗在1/2MS培养基中的诱导生根效果优于WPM培养基。
ABA作为植物天然的生长抑制物质,对植物形态发生和生长具有负效应[12],并对植物生根发挥着关键作用[13-14]。赤霉素能够抑制植株生根培养起始阶段的细胞分裂,从而抑制根原基的分化和形成[15]。作为赤霉素的天然拮抗剂[16],较高浓度的ABA在不定根的分化阶段发挥作用,能够促进植物不定根的形成[14]。本研究中也发现,在不定芽诱导生根培养基中添加适量植物生长调节剂ABA,能够显著地提高澳洲坚果不定芽的生根率,与前人研究结果一致。
此外,培养基的酸碱度对澳洲坚果不定芽生根诱导有一定的影响,偏酸性(pH=5.0)的培养基有利于不定根的发生。总之,本研究仅初步建立了澳洲坚果的组织培养快繁技术体系,组培苗生根率较低,仅为42.2%,还需要进一步优化完善。
[ 参 考 文 献 ]
[1]贺熙勇, 陶亮, 柳觐, 等. 我国澳洲坚果产业概况及发展趋势 [J]. 热带农业科技, 2015, 38(3): 12-16.
[2]罗培四, 何新华, 韦巧云, 等. 澳洲坚果繁育技术研究进展 [J]. 中国南方果树, 2017, 46(3): 179-183.
[3]Oliveira J P S, Hakimi O, Murgu M, et al. Tissue culture and metabolome investigation of a wild endangered medicinal plant using high definition mass spectrometry [J]. Plant Cell, Tissue and Organ Culture,2018, 134(1): 153-167.
[4]Gitonga L, Gichuki S, Ngamau K, et al. Effect of explant type, source and genotype on in vitro shoot regeneration in Macadamia (Macadamia spp.) [J]. Agricultural Biotechnology and Sustainable Development,2010, 2(7): 129-135.
[5]Cha-um S, Chanseetis C, Chintakovid W, et al. Promoting root induction and growth of in vitro macadamia(Macadamia tetraphylla "Keaau") plantlets using CO2-enriched photoautotrophic conditions [J]. Plant Cell, Tissue and Organ Culture, 2011, 106: 435-444.
[6]肖再云. 澳洲坚果的组织培养研究 [J]. 热带农业科学, 1999(4): 12-14.
[7]郭凌飞, 彭靖茹, 覃剑峰, 等. 澳洲坚果组织培养研究初报 [J]. 中国农学通报, 2010(26): 385-386.
[8]柳觐, 孔广红, 倪书邦, 等. 澳洲坚果多倍体的化学诱导及流式细胞术鉴定 [J]. 热带作物学报, 2013,34(11): 2138-2144.
[9]王小箐, 李玲. 植物生长调节剂在植物组织培养中的应用 [M]. 北京: 化学工业出版社, 2002: 36.
[10]Rout G R, Sahoo S. In vitro selection and plant regeneration of copper-tolerant plants from leaf explants of Nicotiana tabacum L. cv. 'Xanthi' [J]. Plant Breeding,2007, 126(4): 403-409.
[11]Bhalla P L, Mulwa R M S. Tissue culture and macadamia propagation [J]. Acta Horticulturae, 2003, 616:343-346.
[12]费学谦, 阙国宁, 周立红. ZT、ABA等内源物质与杉树龄及其组培复壮的关系 [J]. 林业科学研究, 1992,5(3): 317-320.
[13]郭敏敏, 王清连, 胡根海. 利用高效液相色谱法分离和测定棉花组织培养过程种4种内源激素 [J]. 生物技术通讯, 2009, 20(2): 213-216.
[14]郑均宝, 刘玉军, 裴保华, 等. 几种木本植物插穗生根与内源IAA, ABA的关系 [J]. 植物生理学报, 1991,17(3): 313-316.
[15]孟庆伟, 高辉远. 植物生物学 [M]. 2 版. 北京: 中国农业出版社, 2017: 199-240.
[16]周燕, 高述民, 李凤兰. 胡杨不定根原基发生的分生细胞结构特征及内源激素变化分析 [J]. 西北植物学报, 2009, 29(7): 1342-1350.

