海螺沟冰川退缩区不同演替阶段植被碳贮量与分配格局
何咏梅 李 伟 杨丹荔,3 罗 辑
( 1. 中国科学院、水利部成都山地灾害与环境研究所,四川 成都 610041;2. 中国科学院大学,北京 100049;3. 成都理工大学地球科学学院,四川 成都 610101)
全球变化研究是当今地球科学研究的重要议题之一。气候变化对陆地生态系统的影响是多尺度、多层次的,主要表现在生态系统的结构和功能方面[1],生态系统碳循环研究是全球变化科学中的重要组成部分,也是研究生态系统对气候变化贡献和响应的重点之一[2]。森林生态系统是陆地生态系统的主体,世界的森林生态系统储存了陆地生态系统大部分的有机碳,在陆地碳循环中发挥着重要作用[3-4]。《京都议定书》正式生效后,对森林生态系统碳贮量的研究显得更为迫切。目前对森林碳贮量的估计,主要是通过直接或间接测算森林生物量或现存量再乘以含碳率推算而得。因此,森林群落的生物量及其组成树种的含碳率是研究森林碳贮量的两个关键因子[5]。森林生态系统由于其自身的多样性和复杂性,其中的碳循环过程存在很大的不确定性,随着气候、土壤等生态因子的地带性变化,生态系统碳循环和碳贮量都呈现出相应的空间变化规律[3,6]。贡嘎山海螺沟冰川在过去150多a的时间里,后退幅度十分显著,原生裸地近地表环境变化迅速,土壤有机质积累过程明显。退缩区发育着完整的植被演替序列,呈现着植物群落演替在时空上的连续性和生态环境变化的规律性[7-8]。演替序列每个阶段碳循环密切相关,由此可以准确测定演替序列的碳动态,有助于把握演替序列生态系统中营养元素的循环和利用方式,进而深入研究演替序列生态系统的格局和过程,指导植被生态恢复建设等。本研究通过测定海螺沟冰川退缩区植被演替序列各个阶段生物量及不同树种含碳率,构建了原生演替不同阶段的碳分配和碳贮量格局,对研究原生演替过程中的碳循环有积极意义。
1 研究区概况
贡嘎山位于青藏高原东部边缘,地处东经101°30′~102°15′,北纬 29°20′~30°20′,面积约10 000 km2,主峰海拔7 556 m,是横断山主要的季风海洋性冰川作用中心,区内新构造运动强烈,地貌为高山峡谷类型,自然条件复杂。本研究选择贡嘎山海螺沟冰川近150 a形成的冰川退缩区为研究区(29°34′21″N,102°59′42″E)(图1),该区域海拔2 800~2 950 m,气候湿冷,属于山地寒温带气候类型,年平均气温4.2 ℃,年降水日数达260 d以上,年平均降水量约1 947 mm。海螺沟是贡嘎山东坡最主要的冰川河,水热条件配合好,冰川消融速度快,近百年来没有冰进过程,其冰川退缩区内发育着自小冰期以来形成的完整植被演替序列,并且该区域土壤有连续成土过程,生境变化具有周期短、更替速度快的特点,是进行全球变化研究的理想场所。在该研究区长达2 km的范围内,人为干扰很小,有利于测定该区域植被演替过程中的碳动态。

图 1 海螺沟冰川退缩区样地分布Fig. 1 Map of sampling plots in Hailuogou glacier retreat area
2 研究方法
2.1 样品采集与测定
冰川退缩后形成原生裸地,3~5 a就有先锋植物不断侵入。在柳树(Salix rehderana)、冬瓜杨(Populus purdomii)、沙棘(Hippophae rhamnoides)主导的演替前期阶段,由于它们的生态位相近,竞争加剧。随着演替进行,各阶段优势种不断更替,最终形成以峨眉冷杉(Abies fabri)和麦吊云杉(Picea brachytyla)为主的顶极群落。基于前人对海螺沟冰川退缩区研究基础[9-10],选取了8个典型样地,各样地冰川退缩时间、林分密度、优势物种组成状况见表1。
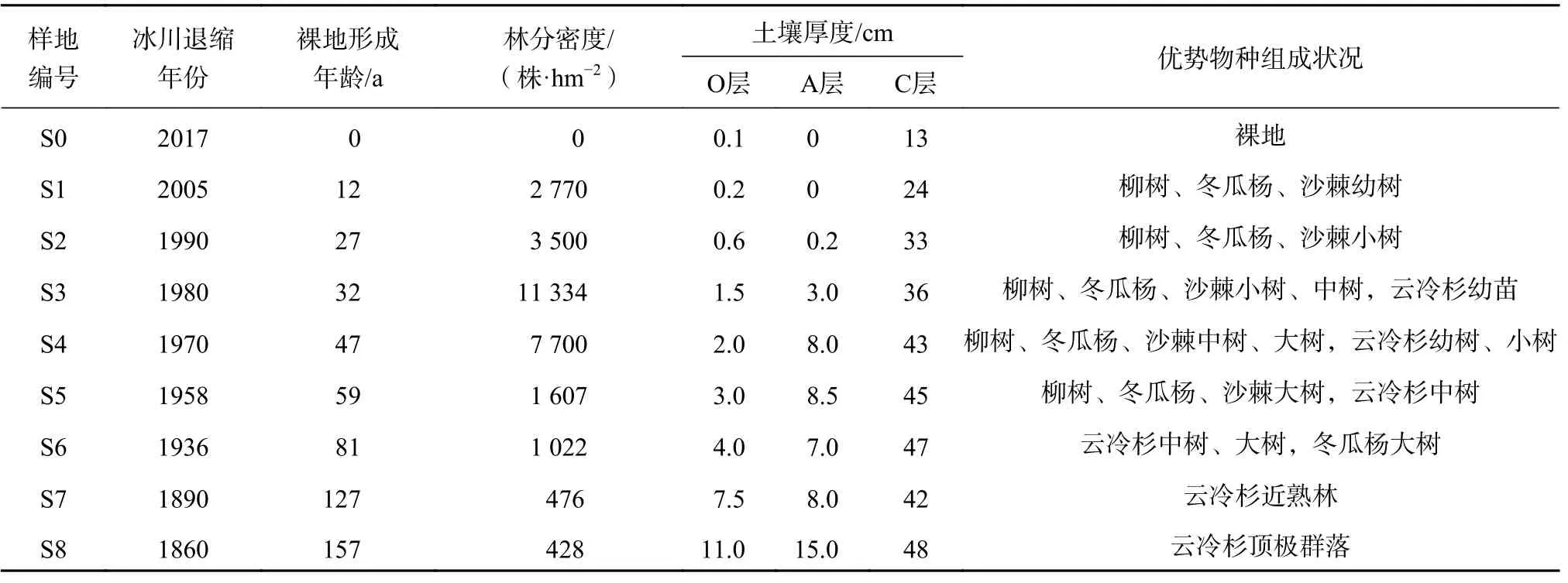
表 1 不同演替阶段群落特征Table 1 Species characteristics of plots at different stand ages
于2017年4月和8月在各个样地随机布设3个10 m×10 m的样方,记录样方内乔木的名称、基径、胸径、树高、冠幅、存活状态等,并沿样方对角线布设3个1 m×1 m的小样方,调查样方内所有灌木、草本、地被物,记录植物名称,数量等。同时,在样地内随机布设3个0.5 m×0.5 m的小样方,用于收集凋落物。样地内不同乔木各器官除单独采集样品外,还将在计算得出生物量后根据生物量比例将不同树种相同器官样品混合取样。采用收获法收获样方内所有灌木、草本及地被物,记录总重后采集样品。粗木质残体包括立枯、倒木和站桩,在样方内采集立枯、倒木和站桩的皮和木质部,组成混合样。在每个样地挖掘3个土壤剖面采集土壤样,按照野外土壤发育性状,将土壤按以下层次采集:O层,完全分解的腐殖质层;A层,腐殖质积累的矿质土表层;C层,母质层。记录每层厚度,挑出土壤混合样中的根系和石砾,采用环刀法测土壤容重。
2.2 碳储量计算方法
所有植物样品带回实验室,放入85 ℃的恒温箱中烘至恒重,土壤样做风干处理,磨碎待用。本研究中样品含碳率的测定采用Elementar Vario Macro Cube C测定仪测定(德国,检测下限≤10 μg/g)。
乔木层生物量根据罗天祥等[11-13]的生物量计算方式计算得出;粗木质残体生物量根据张修玉等[14-15]的计算方法得出,再采集样地内具代表性的立枯、倒木作为标准参照物带回实验室称量其干质量后进行校正;土壤碳贮量依据以下公式计算:
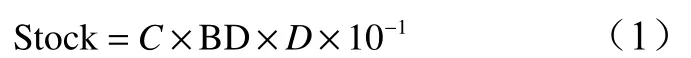
式中:Stock表示碳元素在各土层里的贮量(kg/hm2);C表示碳元素在土层中的浓度(mg/kg);BD表示土层的容重(g/cm3);D表示土层厚度(cm)。
2.3 分析方法
所有数据分析和图形制作均使用SPSS和Excel软件完成。采用单因素方差分析法(one-way ANOVA)分析不同演替阶段植被含碳率的差异,并采用最小显著差法(LSD)进行多重比较。
3 结果与分析
3.1 乔木层主要树种碳库构成
在海螺沟冰川退缩区植被演替的各个阶段,乔木层优势种含碳率存在差异,各器官间含碳率也存在差异。在演替前期(S1~S3),群落内植被含碳率表现为沙棘(47.46%)>柳树(46.45%)>冬瓜杨(45.63%),在演替中期(S4~S5),群落内植被含碳率表现为云冷杉(48.37%)>沙棘(46.27%)>冬瓜杨(45.53%)>柳树(45.26%),在演替后期(S6~S8),群落内云冷杉含碳率(48.43%)显著大于冬瓜杨(45.85%)(P<0.05)。在整个演替序列上,针叶树种的平均含碳率(48.4%)显著高于阔叶树种(46.15%)(P<0.05)。
海螺沟冰川退缩区原生演替序列上乔木层主要树种碳贮量见表2。由表2可知,随着演替的进行,乔木层碳贮量呈显著增加的趋势。从S1到S8,样方内乔木层碳贮量分别为3.07、40.52、86.09、94.90、 103.07、 129.61、 167.16、 180.52 t/hm2,平均增长率为 1.22 t/(hm2·a);其中 S2 到 S3 阶段增长最快,平均增长率为4.6 t/(hm2·a),S7阶段到S8阶段增长速率最慢,平均增长率为0.45 t/(hm2·a)。除 S3 和 S4 2 个阶段间不存在显著差异外,其余各阶段间均存在显著性差异(P<0.05)。在演替前期S1阶段,群落内沙棘碳贮量最大,其次是柳树,冬瓜杨碳贮量最小,在S2阶段和S3阶段则呈现出相反的趋势,冬瓜杨碳贮量最大,且显著高于沙棘和柳树(P<0.05)。在演替中期,云冷杉碳贮量极低,冬瓜杨碳贮量在该时期达到最大,沙棘和柳树碳贮量迅速降低,在S5阶段,沙棘和柳树总碳贮量只占群落碳贮量的5%。演替后期,云冷杉占据群落内主导地位,碳贮量迅速增加,占群落内碳贮量的85%以上。从植物各器官来看,各阶段碳贮量表现为树干>树根>树枝>树皮>树叶。
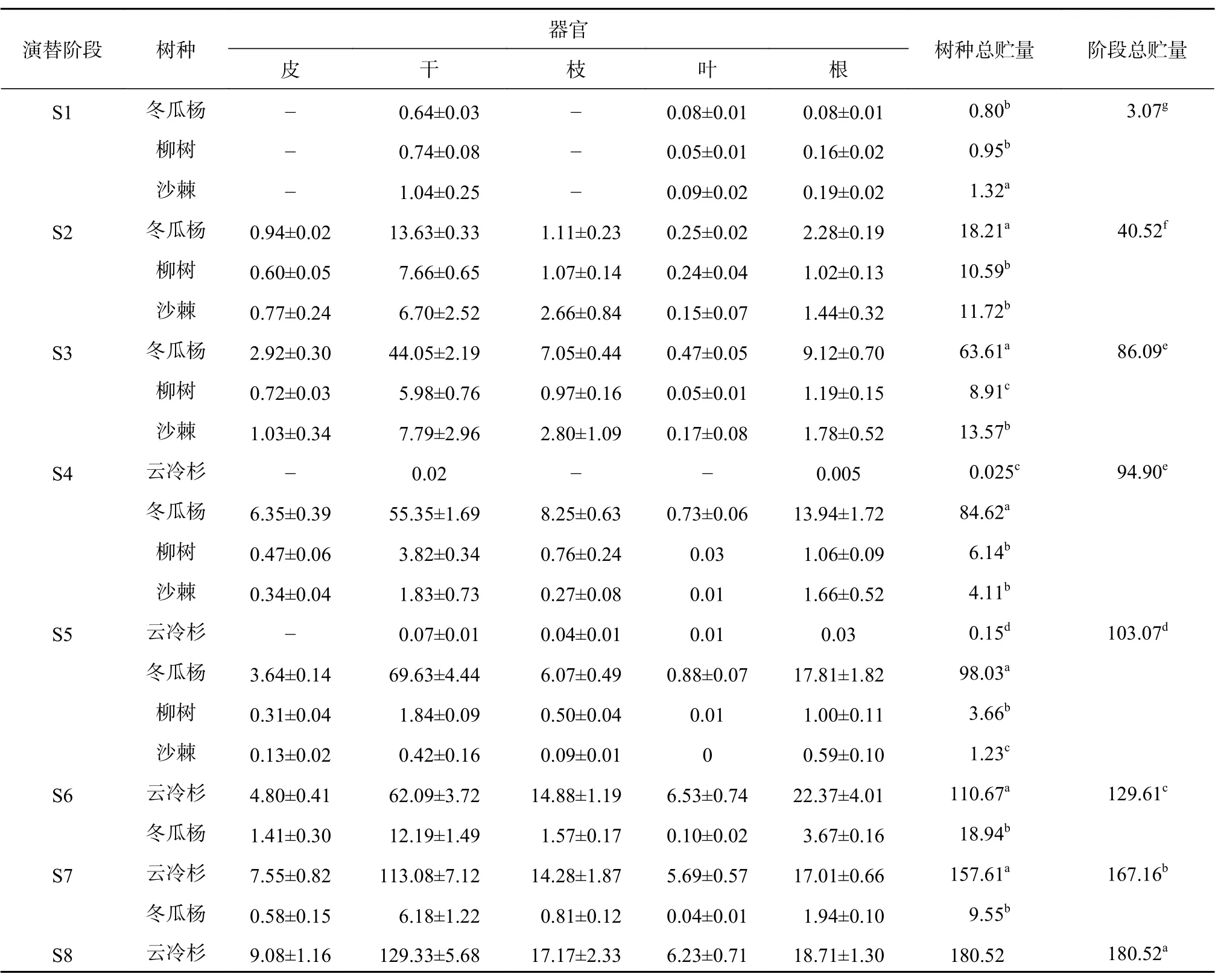
表 2 原生演替序列乔木树种碳贮量Table 2 Carbon storage of arbor species of primary succession sequence t/hm2
3.2 灌木、草本、地被层碳库构成
在演替的各个阶段,林下的灌木、草本、地被层碳贮量都较小,所占比例较低(图2)。根据相关研究[16],以含碳率45%计算灌木层碳贮量,以含碳率41%计算草本和地被层含碳率。随着演替的进行,总碳贮量由最初的0.12 t/hm2逐渐增加到顶级群落的12.41 t/hm2,其中灌木层所占比例最高,为63.21%,草本层所占比例最小,不足3%。在整个演替序列上,灌木层贮量表现为持续增加,除演替前期各阶段间无显著性差异外,其余各阶段间均存在显著性差异(P<0.05);草本层碳贮量表现为先增加后减小再增加的趋势,在S5阶段达到最大,S6阶段碳贮量最低,S5阶段草本碳贮量与S4、S8阶段无显著性差异,但显著大于其余各阶段碳贮量(P<0.05);地被层碳贮量在各阶段波动较大,但总体上碳贮量呈增加趋势,S6阶段碳贮量最大,显著大于其余阶段碳贮量(P<0.05)。
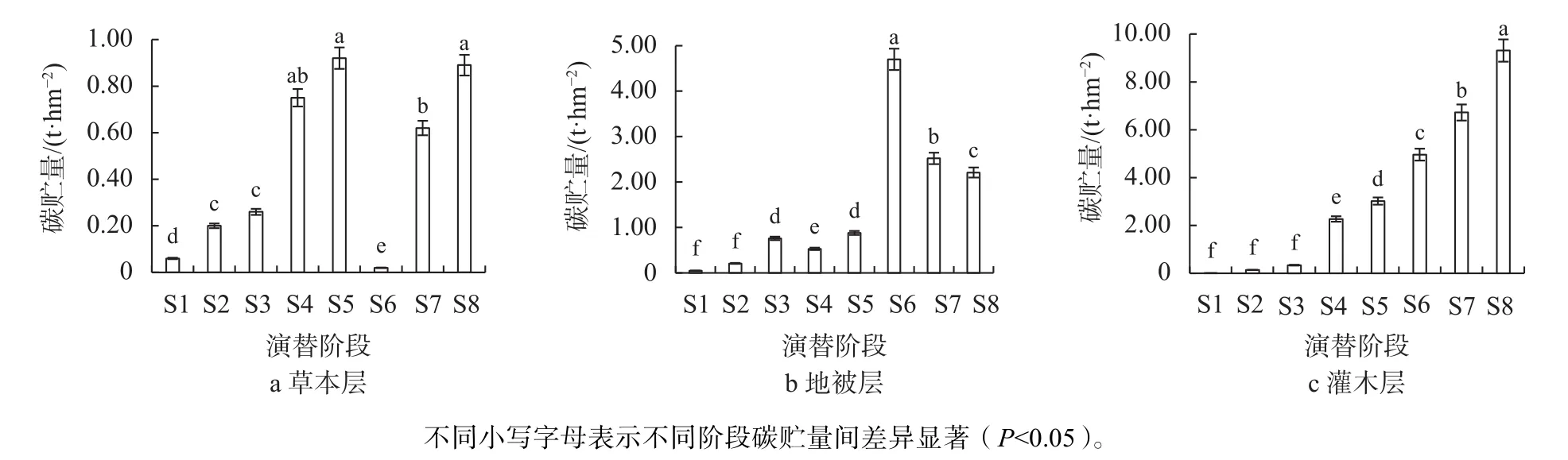
图 2 原生演替序列草本层、地被层、灌木层碳贮量Fig. 2 Carbon storage of herb layer, ground cover and shrub layer of primary succession sequence
3.3 凋落物、粗木质残体碳库构成
森林中凋落物和粗木质残体中的碳是森林生态系统碳库的重要组成部分,二者含碳率以陈有超[17]研究中的0.46为准,计算得出演替各阶段的碳贮量,见图3。由图3可知,凋落物碳贮量随着演替的进行呈现上升趋势,由S1阶段的0.44 t/hm2增加到S8阶段的1.29 t/hm2,其中S7阶段略有下降,但波动幅度较小,S1阶段凋落物碳贮显著低于其余各阶段,S2~S8阶段间均无显著性差异。演替过程中群落的叶量和小枝量都是逐步增加,但是在S3阶段的种间竞争产生大量枯枝,S1~S5阶段是落叶阔叶林阶段,每年落叶较多,从S7阶段开始发展到常绿的暗针叶林阶段,落叶较少,由此形成凋落物碳贮量随着演替进程的波动。

图 3 凋落物和粗木质残体碳贮量Fig. 3 Carbon storage of litters and coarse wood residues
粗木质残体的碳贮量表现为先增加后减小,在S6阶段达到最大值15.68 t/hm2,之后有所下降,但总体上碳贮量是增加的。除S5、S6、S7阶段间碳贮量无显著性差异外,其余各阶段碳贮量均存在显著性差异(P<0.05)。S1阶段没有粗木质残体,随后的竞争产生了枯立木和倒木,S4、S5阶段主要是沙棘和柳树死亡后产生的倒木,S6、S7主要是冬瓜杨死亡产生的倒木。
演替最初阶段,凋落物碳贮量在二者中所占比例高达95%,随着演替的进行,组成群落的种群种内、种间竞争加剧,产生大量死树,粗木质残体快速增加,凋落物碳贮量增幅较低,所占比例下降到不足1%。各阶段中二者总贮量的变化也表现为先增加后减小,和粗木质残体变化趋势一致,这主要是由于演替中后期有大量的柳树和冬瓜杨大树死亡,粗木质残体迅速上升所致。
3.4 原生演替序列土壤碳库构成
各演替阶段土壤碳贮量随着演替的进行逐渐增加,从S1阶段的0.98 t/hm2增加到S8阶段的144.88 t/hm2,增长近150倍,各阶段间土壤碳贮量均存在显著性差异(P<0.05)。S1到S2阶段不仅凋落物量少,而且凋落物分解还在进行,土壤碳贮量增加缓慢,年增长速率为0.54 t/(hm2·a);S2到S3阶段增长速率最快,平均年增长率为2.22 t/(hm2·a),且柳树、冬瓜杨、沙棘竞争剧烈,产生大量枯枝、倒木,输入土壤的碳较多。土壤碳贮量一直呈现逐渐增加趋势,到顶级群落土壤碳贮量还远低于贡嘎山峨眉冷杉成熟林的土壤碳贮量(291.8 t/hm2)[18],与我国森林土壤和世界土壤平均碳贮量(193.6、189 t/hm2)[3,19-20]相比,土壤碳贮量存在一定差距,土壤还没有形成真正的淀积层,说明海螺沟冰川退缩区土壤发育还没有达到成熟状态,土壤发育还将持续进行[21]。

表 3 原生演替序列土壤碳贮量Table 3 Soil carbon storage of primary succession sequence
3.5 原生演替序列碳贮量动态变化
由各阶段各层碳贮量得出原生演替森林生态系统各阶段的总碳贮量,见图4。随着演替进行总碳贮量逐渐增加,由S1阶段的4.63 t/hm2增加到顶级群落的346.10 t/hm2,除S7与S8无显著性差异外,其余各阶段间均存在显著性差异,且显著小于S7、S8(P<0.05)。其中乔木层和土壤碳贮量在整个演替序列上所占比例均超过85%,其中S2、S3、S7、S8阶段所占比例超过90%。在S2阶段二者碳贮量达到该阶段总贮量的96%,其余部分只占4%。其中土壤所占比例持续增加,由S1的21.20%增加到S8的41.86%,而乔木所占比例则呈现先上升后下降的趋势,由S1的66.37%下降到S8的52.16%。S7、S8阶段的总贮量分别为321.02、346.1 t/hm2,远高于我国森林生态系统的平均碳贮量(258.8 t/hm2)[20-21],但与我国针叶林生态系统的平均碳贮量(408 t/hm2)相比还较低[22-24]。
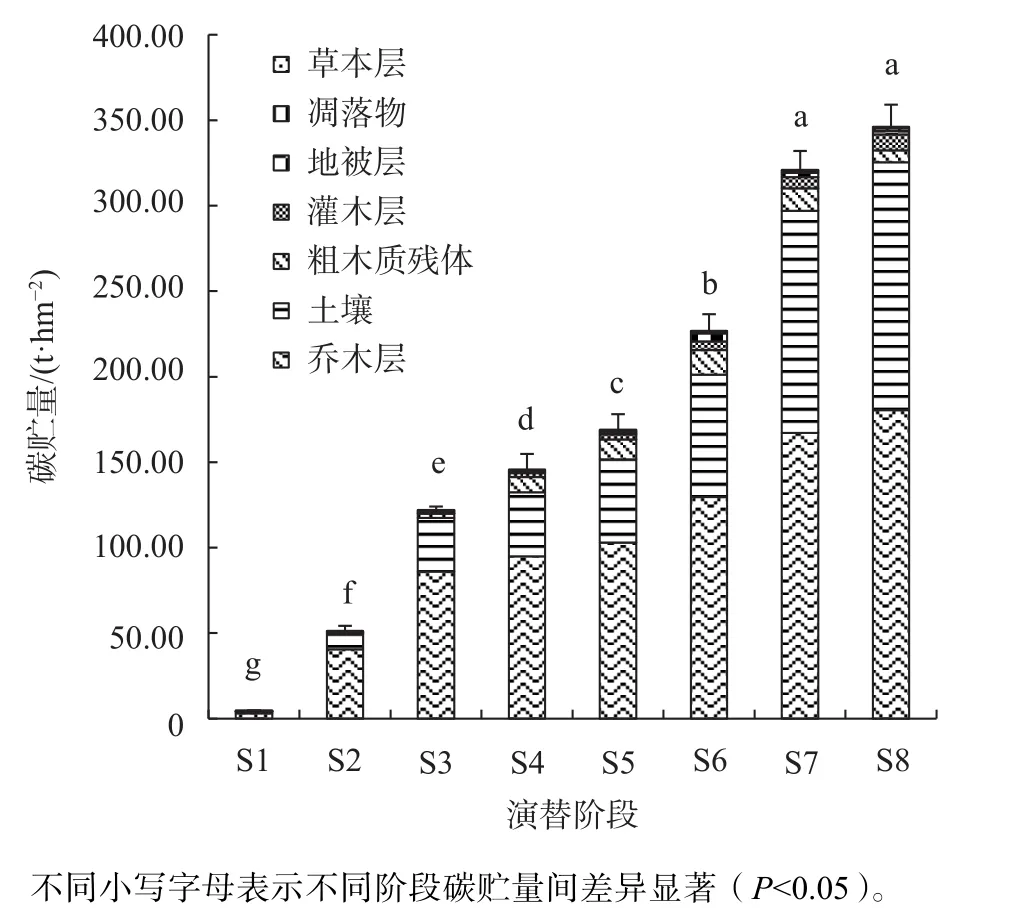
图 4 原生演替序列碳贮量动态变化Fig. 4 Dynamic changes of carbon storage of primary succession sequence
4 结论与讨论
树种之间含碳率的差异,主要是由于乔木种类之间自身结构的不同而导致的[5]。海螺沟冰川退缩区植被含碳率与唐宵等[25]、黄从德等[26]对四川主要针叶树种含碳率的研究结果、张萍[27]对北京延庆县9个主要森林类型含碳率的研究结果、马钦彦等[28]对华北主要森林类型建群种含碳率的研究结果基本一致。
海螺沟冰川退缩区原生演替不同阶段植物体不同部位含碳率分布为41.82%~50.9%,范围略大于周鹏[16]在贡嘎山典型植被带上所测得的植被含碳率(43.72%~48.81%);略小于陈有超[17]在贡嘎山东坡峨眉冷杉林所测得的含碳率(41.50%~53.4%);王金亮等[5]对滇西北4种不同树种各器官的含碳率进行了测定,结果为45.09%~56.02%,显著大于本研究区植被含碳率,这可能与当地的地理位置和树种有关。在整个演替序列上,树枝和树叶含碳率相对较大,其余部位含碳率相对较低,主要是因为树枝含有较多的木质素,而木质素的含碳率较高,而树叶有丰富的叶绿体,有大量有机物存在所引起的[5]。在演替前期(S1~S3),群落植被含碳率表现为根系含碳率最低(45.72%),由于在演替前期植物根系对土壤中营养元素的吸收与利用过程是能量的消耗过程。无论是元素的获取过程还是元素在植物体内的运输、同化和分配过程都需要消耗能量,能量最终来源于植物体内碳水化合物的转化消耗。其中对吸收起重要作用的细根的周转是最大的碳消耗过程[29]。
在海螺沟冰川退缩区长达2 km的植被演替序列上,植物群落与环境相互作用,生物地球化学循环逐步加强[30]。不同演替阶段植被类型不同,种类组成也不同。不同种类的器官和组织含碳率不同,同一种类在不同演替也存在差异。植被演替序列生态系统的碳库构成变化较大,碳贮量存在逐步增加的趋势。在演替前期,乔木层树种以冬瓜杨、柳树、沙棘为主,林下草本、灌木等都较少。S1阶段,各树种间碳贮量差异不大,在S2、S3阶段,冬瓜杨凭借其较快的高生长和较高的光合速率在群落内占据主导地位[31],碳贮量迅速增加,而柳树和沙棘在种间竞争中不敌冬瓜杨,碳贮量远小于冬瓜杨。该时期群落内凋落物和粗木质残体碳贮量也较小。随着演替持续进行,林下生境特征发生改变,云冷杉顺利进入到群落中。在演替中期,云冷杉主要以幼苗及小树为主,碳贮量较低,该时期冬瓜杨占据主林层,碳贮量达到整个演替序列的最大值,而沙棘和柳树在该时期逐渐死亡,碳贮量持续下降。由于柳树和沙棘在该时期大量死亡,林下粗木质残体碳贮量与演替前期相比显著增加。同时由于群落内大量林窗出现,林下的灌木、草本等数量有所上升。在演替后期,群落进入到以冬瓜杨和云冷杉为主的针阔混交阶段,云冷杉在该时期生长较快,迅速占据主林层,碳贮量迅速增加,林下的冬瓜杨由于接受不到足够的光照而逐渐死亡,碳贮量迅速减小。在S6阶段,林下的草本层碳贮量不足0.1 t/hm2,而地被层碳贮量达到整个演替序列的最大值,这主要是由于在这一阶段林冠层郁闭度增大使得林下草本层植物所能利用的光照减少,该阶段林下空气湿度较大,为苔藓、石松等地被物的生长提供了有利条件。
海螺沟冰川退缩区植被演替是一个有序的、可观测的连续过程,经过150多a的发展,最终由裸地演替为以云冷杉为主的顶级群落。各演替阶段不同树种各器官间的碳含量分布在41.8%~50.9%之间,总体表现为枝和叶碳含量较高,根碳含量较低。各器官含碳量的变异性较小,均不超过0.05。群落碳贮量则随着演替的进行不断增加,其中乔木层和土壤碳贮量在整个演替序列上所占比例均超过85%。土壤碳贮量随着演替逐渐增加,但顶级群落林下土壤碳贮量远低于贡嘎山峨眉冷杉成熟林的土壤碳贮量,说明海螺沟冰川退缩区土壤发育尚未完成,土壤发育还将持续进行。
原生演替开始时,在贫瘠生境上的养分积累是决定演替进程的重要因素[32]。最初的先锋植物对氮需求不高,在群落演替初期碳贮量迅速增加,群落中的固氮植物和微生物的作用逐步增强。随后土壤氮贮量迅速增加,植被演替动态取决于固氮植物的种类、密度、生活型以及碳氮比。演替初期围绕着氮争夺,冬瓜杨、柳树、沙棘种间竞争剧烈,由于冬瓜杨光合速率高,碳积累较多,同时也可以获得更多营养元素,生长迅速的冬瓜杨在演替前期、中期处于优势地位;演替中期群落主要是冬瓜杨的种内斗争,产生大量死树和倒木,养分的生物循环加强,土壤有机质迅速增加;演替后期的暗针叶林优势种个体碳贮量最大,乔木层和表土层贮存了大量养分,而生态系统养分的生物地球化学循环与以前明显不同。
以前对原生演替的研究都没有在一个连续完整的序列开展,这是形成这些问题的主要原因。海螺沟冰川退缩区植被演替是一个有序的、可观测的连续完整过程,经过150多a的发展,最终由裸地演替为以云冷杉为主的顶级群落。通过碳动态可以量化这一群落变化过程中种间、种内竞争关系和竞争的结果,量化凋落物和粗木质残体在土壤发育过程中的作用。今后需要深入研究植物营养元素循环和利用规律,揭示原生演替的碳素和养分共同驱动机制,丰富生态学理论。
[ 参 考 文 献 ]
[1]Walther G R, Post E, Convey P, et al. Ecological responses to recent climate change [J]. Nature, 2002,416(6879): 389-395.
[2]刘纪远, 于贵瑞, 王绍强, 等. 陆地生态系统碳循环及其机理研究的地球信息科学方法初探 [J]. 地理研究,2003, 22(4): 397-405.
[3]Dixon R K, Solomon A M, Brown S, et al. Carbon pools and flux of global forest ecosystems [J]. Science,1994, 263(5144): 185-190.
[4]程鹏飞, 王金亮, 王雪梅, 等. 森林生态系统碳储量估算方法研究进展 [J]. 林业调查规划, 2009, 34(6):39-45.
[5]王金亮, 王小花, 岳彩荣, 等. 滇西北香格里拉森林4个建群种的含碳率 [J]. 生态环境学报, 2012, 21(4):613-619.
[6]曹明奎, 于贵瑞, 刘纪远, 等. 陆地生态系统碳循环的多尺度试验观测和跨尺度机理模拟 [J]. 中国科学(D辑: 地球科学), 2004, 34(S2): 1-14.
[7]Alexander E B, Burt R. Soil development on moraines of Mendenhall Glacier, southeast Alaska. 1. The moraines and soil morphology [J]. Geoderma, 1996,72(1/2): 1-17.
[8]Egli M, Mavris C, Mirabella A, et al. Soil organic matter formation along a chronosequence in the Morteratsch proglacial area (Upper Engadine, Switzerland) [J]. Catena, 2010, 82(2): 61-69.
[9]钟祥浩, 罗辑, 吴宁. 贡嘎山森林生态系统研究[M].成都: 成都科技大学出版社, 1997.
传统民居元素是传统文化重要组成部分,应用于陶瓷艺术设计中,自身的装饰功能突显,可烘托出陶瓷艺术作品的文化底蕴、帮助其创造传统文化氛围。对于陶瓷艺术作品的欣赏,不能仅观察其外在表现,更应当注重其内涵、文化品位的挖掘,将传统民居元素对陶瓷艺术作品的文化功能充分发挥。
[10]陈富斌, 罗辑. 贡嘎山高山生态环境研究: 第 2卷 [M]. 北京: 气象出版社, 1998.
[11]罗天祥, 石培礼, 罗辑, 等. 青藏高原植被样带地上部分生物量的分布格局 [J]. 植物生态学报, 2002, 26(6):668-676.
[12]刘兴良, 马钦彦, 杨冬生, 等. 川西山地主要人工林种群根系生物量与生产力 [J]. 生态学报, 2006, 26(2):542-551.
[13]李登秋, 居为民, 郑光, 等. 基于生态过程模型和森林清查数据的森林生长量估算对比研究 [J]. 生态环境学报, 2013, 22(10): 1647-1657.
[14]张修玉, 管东生, 张海东. 广州三种森林粗死木质残体(CWD)的储量与分解特征 [J]. 生态学报, 2009,29(10): 5227-5236.
[15]何帆, 王得祥, 张宋智, 等. 小陇山林区主要森林群落凋落物及死木质残体储量 [J]. 应用与环境生物学报,2011, 17(1): 46-50.
[16]周鹏. 贡嘎山东坡垂直带谱典型植被类型固碳分异及其影响因子[D]. 北京: 中国科学院大学, 2013.
[18]程根伟, 罗辑. 贡嘎山亚高山林地碳的积累与耗散特征 [J]. 地理学报, 2003, 58(2): 179-185.
[19]潘辉, 黄石德, 洪伟, 等. 3种相思人工林生态系统碳贮量及分配 [J]. 福建林学院学报, 2009, 29(1): 28-32.
[20]杨卫星, 李春宁, 付军, 等. 桂西南连续年龄序列尾巨桉人工林碳储量及其分布特征 [J]. 农业研究与应用,2017(3): 24-30.
[21]罗辑, 李伟, 佘佳, 等. 贡嘎山海螺沟冰川退缩区植被演替过程的碳动态 [J]. 山地学报, 2017, 35(5):629-635.
[22]周玉荣, 于振良, 赵士洞. 我国主要森林生态系统碳贮量和碳平衡 [J]. 植物生态学报, 2000, 24(5):518-522.
[23]吕晓涛, 唐建维, 于贵瑞, 等. 西双版纳热带季节雨林的C贮量及其分配格局 [J]. 山地学报, 2006, 24(3):277-283.
[24]涂洁, 刘琪璟. 亚热带红壤丘陵区湿地松人工林生态系统碳素贮量与分布研究 [J]. 江西农业大学学报,2007, 29(1): 48-54.
[25]唐宵, 黄从德, 张健, 等. 四川主要针叶树种含碳率测定分析 [J]. 四川林业科技, 2007, 28(2): 20-23.
[26]黄从德, 张健, 杨万勤, 等. 四川省及重庆地区森林植被碳储量动态 [J]. 生态学报, 2008, 28(3): 966-975.
[27]张萍. 北京森林碳储量研究[D]. 北京: 北京林业大学, 2009.
[28]马钦彦, 陈遐林, 王娟, 等. 华北主要森林类型建群种的含碳率分析 [J]. 北京林业大学学报, 2002, 24(S1):100-104.
[29]王琪, 徐程扬. 氮磷对植物光合作用及碳分配的影响 [J]. 山东林业科技, 2005, 35(5): 59-62.
[30]宋蒙亚, 余雷, 姜永雷, 等. 贡嘎山冰川退缩迹地植被原生演替驱动机理探究[C]//中国地理学会经济地理专业委员会. 2017年中国地理学会经济地理专业委员会学术年会论文摘要集. 成都: 中国地理学会,2017: 38.
[31]杨丹丹, 罗辑, 佘佳, 等. 贡嘎山海螺沟冰川退缩区原生演替序列植被生物量动态 [J]. 生态环境学报,2015, 24(11): 1843-1850.
[32]何磊, 唐亚, 张继娟, 等. 原生演替及其在生态恢复中的应用 [J]. 四川师范大学学报(自然科学版), 2010,33(3): 393-402.
——冰川上的厕所革命

