林下枯落物浸提液对香果树种子萌发及幼苗生长影响的化感效应
陈茂光,郭连金,余诺祎,占学林,吴夏俊鹏,宁本松
(上饶师范学院,江西 上饶 334000)
香果树(Emmenopteryshenryi)是茜草科Rubiaceae落叶大乔木,是第四纪冰川孑遗和中国特有的单种属植物,被列为国家Ⅱ级重点保护对象[1,2]。香果树个体寿命较长,但由于其自然更新能力差,种子寿命短,发芽率低,以及其种群间的基因很难交流,导致香果树数量日益减少,濒临灭绝[3,4]。香果树是茜草科发育、形态演化、群落演替以及我国南部、西南部植物区系等研究的重要材料,还具有极高的观赏价值、药用价值和生态价值[3-5],因而保护恢复香果树自然种群具有重要的科研意义和实践意义。近年来,学者对香果树的研究主要集中于种群数量结构、生殖构件、解剖学、生态学特征和种子萌发特性等方面[1,2,4-10],有关化感作用方面尚无研究报道。
自1937年Molish提出化感作用(Allelopathy)以来[11],该方向逐渐成为濒危植物保护与恢复领域的研究热点[12]。有研究认为化感作用对植物种子的萌发具有重要的抑制或促进作用,使其种子萌发率降低[11-13]。原生境中香果树种子萌发率低,实生苗极少是香果树处于濒危状态的主要原因之一[3,4],这种现象可能是光照、温度或植物内源激素导致的[14,15],也可能是其林下枯落物产生化感物质所引起的。本研究利用原生境中香果树林下枯落物的浸提液培养香果树种子和实生苗,以研究林下枯落物对其种子萌发及幼苗生长的影响,为香果树种群自然更新提供理论依据。
1 实验材料及研究方法
1.1 实验材料
香果树种子于2016年采自福建省武夷山国家级自然保护区内生长良好的同一株树,挑选大而饱满的种子。已知香果树种群有纯林和竹林两种,故挑选香果树原生境林下4种枯落物:香果树落叶、香果树树枝、香果树果皮和竹叶为浸提液原料。将采集后的香果树种子及枯落物置于牛皮纸袋中,带回实验室于4 ℃保存备用。
1.2 研究方法
将称取的枯落物剪碎,然后置于375 ml水中配置枯落物浸提液[16]。林下枯落物的称取量分别为:香果树落叶6.00 g,香果树树枝1.84 g,香果树果皮1.32 g,竹叶6.87 g。然后静置24 h,再取其滤液作为浸提液母液,将母液稀释成5组不同浓度的处理组用于实验(根据野外环境中,香果树林下单位面积枯落物下落量及降雨量的范围,确定实验室所用枯落物的质量及浸提液的浓度范围),详细浓度见表1。

表1 林下枯落物浸提液的浓度
1.3 种子萌发实验
测定林下枯落物浸提液对种子萌发的化感效应。每种浸提液设5个浓度(处理)和1个对照(清水),每个处理及对照3次重复(3个培养皿)。每个培养皿中随机加入一百粒供试种子,每24 h记录一次种子萌发数,直到不再有种子萌发结束实验,一组共计15个培养皿,每组处理均设置3个重复。千粒种子重(0. 47±0.09)g,8个重复。
1.4 幼苗生长实验
试验设计与种子萌发试验相同,试验时从种子萌发试验中取已萌发的种子,培养20 d,待长出真叶后,移栽至经高温灭菌处理、约3 cm高的土壤中,开始实验。先测一次幼苗的大小,而后每3 d测一次,每次测量3颗幼苗真叶的叶长和叶宽、茎的株高和直径(死亡的幼苗由生长状况相近的幼苗接替测量),共计测量6次,测量数据取平均值。每组处理均设置3个重复。
1.5 数据处理
计算种子最终萌发率(Final Germination, FG),公式如下:
FG=萌发种子总数/供试种子总数×100%;
运用Excel 2010 进行成对二样本T检验分析。
根据Williamson(1998)提出的化感效应指数(Response Index, RI)作为测量化感作用效果和强度的指标[17]。公式如下:
式中,C为对照值,T为处理值,化感效应指数RI表示化感物质对受体植物的化感作用大小,当RI>0时表示促进作用,当RI<0时表示抑制作用,RI绝对值的大小表示化感作用的强度。
2 结果与分析
2.1 种子萌发实验结果
试验结果为,经香果树落叶浸提液处理后的香果树种子萌发受到显著(P<0.05)抑制作用(图1),并随浓度的升高抑制作用增强。经香果树树枝浸提液和竹叶浸提叶处理后的香果树种子萌发受到显著(P<0.05)抑制作用,并随浓度升高抑制作用呈增强—下降—增强变化趋势。经香果树果皮浸提液处理后的香果树种子萌发受到显著(P<0.05)的促进作用,并随浓度的升高促进作用增强。经竹叶浸提液处理后的香果树种子萌发基本受到显著(P<0.05)抑制作用。
2.2 幼苗生长实验结果
2.2.1 香果树落叶浸提液对香果树幼苗的影响 由图2知,在各浓度香果树落叶浸提液的处理下,香果树幼苗均受到显著(P<0.05)的促进作用,其促进效果基本随浓度的升高而减弱。香果树幼苗不同部位受到影响的强弱为:株高>叶长>叶宽>直径。香果树株高、叶长和叶宽均受到显著性(P<0.05)影响,而直径未受到显著性(P>0.05)影响。林下香果树落叶浸提液对幼苗叶长的促进作用,随着浓度的升高而减弱,其中促进作用最强的是处理组N5,其次是处理组N2;幼苗叶宽均受到促进作用,随着浓度的升高促进作用减弱,最显著的是处理组N1,受到促进作用由强到弱依次为:处理组N1、N3、N2、N4、N5;幼苗株高均受到促进作用,最显著的是处理组N1;茎直径均受到促进作用,最显著的是处理组N2。
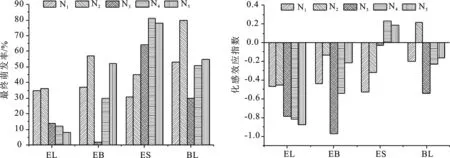
图1 不同枯落物浸提液对香果树种子最终萌发率及其化感效应的影响

A:香果树幼苗叶长;B:香果树幼苗叶宽;C:香果树幼苗株高;D:香果树幼苗茎直径图2 香果树落叶浸提液对香果树幼苗的影响
2.2.2 香果树树枝浸提液对香果树幼苗的影响 在不同浓度林下香果树树枝浸提液处理下,香果树幼苗生长受到的影响也不同(图3)。随着香果树树枝浸提液浓度的升高,香果树幼苗生长受到低浓度促进作用,高浓度抑制作用。香果树幼苗不同部位受到影响的强弱为:叶长>株高>叶宽>直径。香果树各部位在香果树树枝浸提液的处理下均受到显著(P<0.05)影响。在林下香果树树枝浸提液的处理下,幼苗叶长均受到促进作用,最显著的是处理N4;幼苗叶宽基本受到促进作用,最显著的也是处理N4,其次是处理N2;幼苗株高既受到促进作用,也受到抑制作用,其中受到抑制作用的是处理N1、N2、N5,而受到促进作用的是处理N3、N4;幼苗茎直径受到的促进作用随着浓度的升高而减弱,最显著的是处理N2,其次是处理N4、N5,其中处理N1抑制作用不显著。

A:香果树幼苗叶长;B:香果树幼苗叶宽;C:香果树幼苗株高;D:香果树幼苗茎直径图3 香果树树枝浸提液对香果树幼苗的影响
2.2.3 香果树果皮浸提液对香果树幼苗的影响 在不同浓度林下香果树果皮浸提液的处理下,香果树幼苗生长大多受到促进作用。香果树幼苗不同部位受到影响的强弱为:叶宽>株高>直径>叶长。香果树幼苗的叶宽、株高和直径均受到显著性影响,而叶长受到的影响不显著。不同浓度果皮浸提液对幼苗叶长的促进作用由强到弱依次为:处理N4、N5、N2、N1,仅在处理N3中受到抑制作用;幼苗叶宽、株高均受到促进作用,最显著的都是处理N5;幼苗茎直径受到双浓度效应,既受到抑制作用又受到促进作用(图4)。
2.2.4 竹叶浸提液对香果树幼苗的影响 试验最终只有对照组和N3、N4处理过的香果树幼苗存活,其余三组存活率均为0%。香果树幼苗不同部位受到影响的强弱为:株高>直径>叶宽>叶长。林下竹叶浸提液处理对香果树幼苗株高的影响极显著(P<0.01),对幼苗直径和叶宽的影响显著(P<0.05),对幼苗叶长影响不显著(P>0.05)。此外,随着竹叶浸提液浓度的升高,香果树幼苗真叶的叶长、叶宽受到的促进作用越低,直至转变成抑制作用,而幼苗的株高、直径受到的促进作用越强(图5)。
2.2.5 化感效应指数 从表2可知,在4种林下枯落物浸提液的处理下,香果树幼苗叶基本受到抑制作用,且随着浓度的升高抑制作用增强;茎基本受到促进作用,随着浓度升高促进作用减弱。香果树幼苗叶长、叶宽受到抑制作用最显著的均是处理组EB-N2,化感效应指数分别为-0.402和-0.356;香果树幼苗株高受到促进作用最显著的是处理EL-N3,化感效应指数为0.283;香果树幼苗茎直径受到促进作用最显著的是处理EL-N2,化感效应指数为0.133。

A:香果树幼苗叶长;B:香果树幼苗叶宽;C:香果树幼苗株高;D:香果树幼苗茎直径图4 香果树果皮浸提液对香果树幼苗的影响

A:香果树幼苗叶长;B:香果树幼苗叶宽;C:香果树幼苗株高;D:香果树幼苗茎直径图5 竹叶浸提液对香果树幼苗的影响
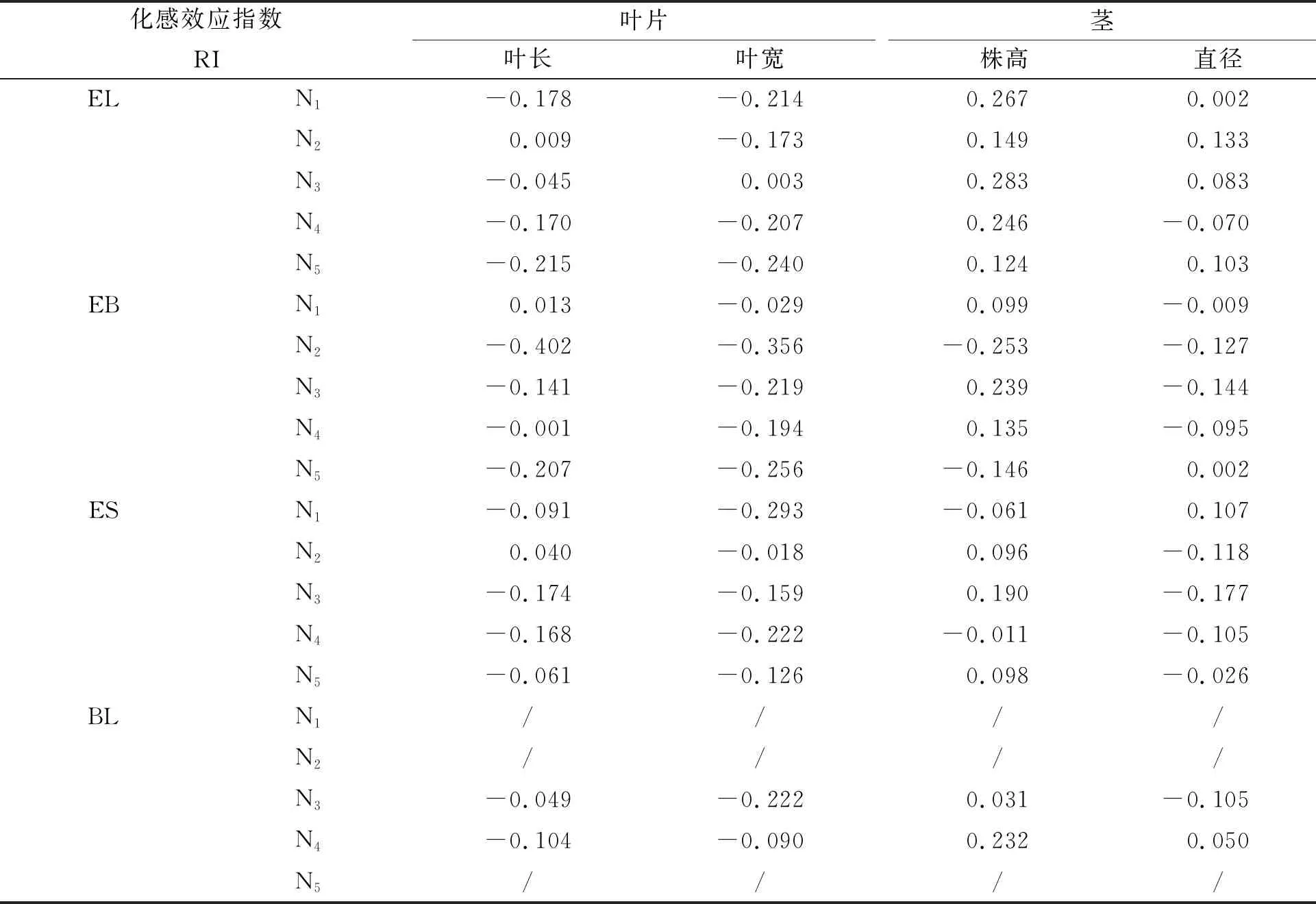
化感效应指数RI叶片叶长叶宽茎株高直径ELN1-0.178-0.2140.2670.002N20.009-0.1730.1490.133N3-0.0450.0030.2830.083N4-0.170-0.2070.246-0.070N5-0.215-0.2400.1240.103EBN10.013-0.0290.099-0.009N2-0.402-0.356-0.253-0.127N3-0.141-0.2190.239-0.144N4-0.001-0.1940.135-0.095N5-0.207-0.256-0.1460.002ESN1-0.091-0.293-0.0610.107N20.040-0.0180.096-0.118N3-0.174-0.1590.190-0.177N4-0.168-0.222-0.011-0.105N5-0.061-0.1260.098-0.026BLN1////N2////N3-0.049-0.2220.031-0.105N4-0.104-0.0900.2320.050N5////
3 讨论
3.1 枯落物对香果树种子萌发的影响
有研究发现化感效应具有浓度梯度效应,低浓度促进,高浓度抑制,即双浓度效应,浓度越高抑制作用越显著[18-20]。在自然生态系统中,化感物质主要依靠雨水淋溶出来。因此,本研究采用水浸提法提取4种林下枯落物中的化感物质。香果树种子萌发在香果树落叶和树枝浸提液的处理下,总体趋势是受到显著(P<0.05)抑制作用,随浓度的升高受到的化感抑制作用增强,与鲍根生等[20]和张卫红等[21]研究结果相似。香果树种子萌发也受到竹叶浸提液显著(P<0.05)抑制作用。这可能是由于叶片是植物进行光合作用和呼吸作用的主要器官,而其光合作用产生的有机化合物首先储存在叶片中,所以落叶中的化感物质含量较高,表现的化感作用也更强。本试验经香果树树枝N3和竹叶N3处理的香果树种子萌发率极低,也可能与某些昆虫的为害有关。香果树种子在香果树果皮浸提液处理下,表现出低浓度抑制种子萌发,高浓度促进种子萌发,这与众多学者[18-20]研究的“低促高抑”化感效应不同。由于植物不同器官向环境释放化感物质的种类和数量不同[22],所以这可能是因为香果树结果少,果皮被淋溶的化感物质相对较少;可能是化感抑制作用较缓慢,本实验周期并未将其化感作用完全表现出来;也可能是由于果皮是种子的保护层,果皮中具有某种抗氧化能力的物质,减少氧化性化感物质对种子萌发起毒害作用[23]所引起的,有待进一步探究。
3.2 枯落物对香果树幼苗生长的影响
李欣欣等[24]研究表明毛竹根际土浸提液对杉木种子在整个萌发过程中的萌发均具有促进作用。本研究显示在香果树落叶浸提液处理下,香果树幼苗生长均受到显著(P<0.05)抑制作用,随着浓度的升高抑制作用增强。香果树树枝浸提液处理结果与周泽建等[25]杉木落叶浸提液对走马胎(Ardisiagigantifolia)幼苗生长呈现低浓度促进、高浓度抑制的双浓度效应研究结果相似,表明了香果树也存在化感自毒效应[26]。本研究中香果树果皮浸提液普遍产生抑制作用,仅在较低浓度时有促进作用。竹叶浸提液的总体趋势随浓度升高具有“促茎抑叶”的化感效应,表明化感作用对同一受体植物不同部位的影响存在差异。
4 结论
(1)香果树落叶、树枝浸提液对香果树种子萌发都具有抑制作用,且随着浓度的升高抑制作用增强;香果树果皮浸提液低浓度具有一定抑制作用,较高浓度时促进作用不显著;竹叶浸提液对香果树种子萌发具有显著抑制作用。
(2)香果树落叶和果皮浸提液对香果树幼苗生长化感效应均为显著抑制,随浓度升高抑制作用增强;香果树树枝浸提液对香果树幼苗生长化感效应为“低促高抑”的双浓度效应;竹叶浸提液对香果树幼苗不同部位的化感效应不同,总体表现为“促茎抑叶”。

