窄带谱成像放大内镜技术对早期食管癌及其癌前病变诊断的临床应用价值*
张惠晶,冯明亮,矫太伟,周环,刘梦园,孙明军
(中国医科大学附属第一医院 内镜诊治科,辽宁 沈阳 110001)
食管癌为我国最常见的恶性肿瘤之一,其发病率在我国居肿瘤第5位,死亡率居第4位[1-2]。食管癌分为食管鳞状细胞癌(简称食管鳞癌)和食管腺癌,我国食管癌以食管鳞癌为主,占90.0%以上。早期食管癌(early esophageal cancer,EEC)患者多无明显症状,90.0%以上食管癌首诊已经达到中晚期,以外科手术为主的治疗5年生存率仅为10.0%,而EEC治疗后5年生存率可达90.0%以上[3]。因此,早期发现、早期诊断和早期治疗是决定食管癌患者治疗成功率、提高5年生存率及改善预后的关键,而早期发现、早期诊断又是早期治疗的基础,所以提高EEC的检出率成为整个食管癌诊治环节中的重中之重。近年来,随着窄带成像内镜(narrow band imaging,NBI)和放大内镜(magnifying endoscopy,ME)技术的发展,窄带成像放大内镜(narrow band imaging magnifying endoscopy,NBI-ME)技术在诊断EEC方面得到了广泛应用,主要通过仔细观察位于食管上皮乳头内毛细血管袢(intra-epithelial papillary capillary loops,IPCL)并判断其形态变化,从而能够对EEC及癌前病变做出准确诊断。本文应用NBI-ME技术对食道可疑病变进行观察,并与病理学诊断相对照,分析其临床应用价值。
1 资料与方法
1.1 一般资料
回顾性分析本院内镜诊治中心2013年7月-2016年12月发现的食管黏膜表面异常的102例(共132处病变)患者内镜表现及临床资料。其中,男83例,女19例,年龄36~85岁,平均(61.0±7.0)岁。62例(共69处病变)在本院接受治疗,其中58例行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)切除,4例行外科手术。
1.2 器械与方法
采用Olympus GIF H260 Z放大内镜,先行白光下内镜检查,发现可疑病灶(如食道黏膜发红、粗糙、糜烂、凹陷或隆起等改变)后切换为NBI模式,结合光学放大辨别病变与正常黏膜分界线,并记录IPCL分型。
1.3 IPCL分型判定
IPCL分型参考日本食管学会推荐的AB分型法[4]。A型:IPCL无明显变化或轻微变化,提示食管炎症;B1亚型:扩张、迂曲、粗细不均和形态不一的袢状血管,提示病灶浸润至黏膜上皮层(m1)或固有层(m2);B2亚型:袢形成较少的异常血管,提示病灶浸润至黏膜肌层(m3)或黏膜下层浅层(sm1);B3亚型:高度扩张、粗大、不规则的血管,提示病灶浸润至黏膜下层深层(sm2以上)。IPCL分型越高,肿瘤浸润越深。因此,如果2种或2种以上IPCL类型同时存在于一处病变时,笔者统一记录为排序靠后的IPCL分型。
1.4 病理学诊断标准
所有活检切片及ESD后切片均由高年资病理专家双盲阅片。食管鳞癌的癌前病变主要指食管鳞状上皮的异型增生,世界卫生组织(world health organization,WHO)称之为上皮内瘤变(intraepithelial neoplasia)。根据食管、胃肠上皮性肿瘤Vienna分类[5-6],将原位癌和重度异型增生归类于高级别黏膜上皮内瘤变(high-grade intraepithelial neoplasia,HGIN),轻度和中度异型增生归类于低级别黏膜上皮内瘤变(lowgrade intraepithelial neoplasia,LGIN)。早期食管癌癌组织局限于食管黏膜下层以内,未累及肌层,包括:原位癌、黏膜内癌、黏膜下癌,亦称表浅癌[7]。根据肿瘤的浸润深度,表浅食管癌的分期如下[4]:M期癌肿瘤局限于黏膜层;SM期癌肿瘤浸润超过黏膜下层,未达到固有肌层。M期癌又可分为:M1期(病变仅局限于黏膜上皮表层)、M2期(浸润至黏膜固有层)和M3期(达黏膜肌层但未突破);SM期癌又根据肿瘤浸润至黏膜下层的上、中、下1/3者,分别称为SM1期癌、SM2期癌及SM3期癌,其中将病变浸润至黏膜下层但距黏膜肌层200μm以内者称为SM1期癌。
1.5 统计学方法
采用SPSS 16.0统计软件包处理,计数资料一致性检验应用Kappa检验,两种检验方法的差异性检验采用配对χ2检验(McNemar test),P<0.05为差异有统计学意义。
2 结果
2.1 NBI-ME对食道病变性质的预判作用
2.1.1 NBI-ME观察食管病变IPCL分型与病理结果的关系132处病变经NBI-ME观察判定,IPCL为A型40处,预判为食管炎;IPCL为B型92处,预判为EEC及癌前病变。IPCL分型与病理结果关系见表1。IPCL为A型的病变中95.0%(38/40)诊断为食管炎,仅有5.0%(2/40)的病变为癌前病变;IPCL为B型的病变中96.7%(89/92)病理结果为ECC及癌前病变,诊断为食道炎的病变仅占3.3%(3/92)。

表1 NBI-ME观察下食道IPCL分型与内镜下活检病理的关系 处Table1 The relationship between IPCL classification of esophagus observed by NBI-ME and histopathological diagnosis of biopsy by endoscopy n
2.1.2 NBI-ME预判病理分型与活检病理结果一致性比较将NBI-ME预判病理分型与活检病理结果比较分析得出 :Kappa =0.911>0.75,P<0.01,两者一致程度相当满意。见表2。

表2 NBI-ME预判病理分型与活检病理一致性比较 处Table2 Comparison of consistency between the pathological classification of NBI-ME pre-detection and histopathological diagnosis of biopsy n
2.1.3 NBI-ME预判食道病变病理分型与术后完整病理分型一致性比较69处食道病变(62例)术后完整病理提示LGIN 8处、HGIN 8处和EEC 53处。通过NBI-ME观察后的活检病理提示LGIN 10处、HGIN 25处和EEC 34处。术前活检病理与术后完整病理具体分型比较见表3。术前活检病理的总体准确率为71.0%(49/69),两者一致性检验Kappa =0.485>0.4,P<0.01,说明术前活检病理与术后完整病理一致性尚可;但McNemar检验结果显示McNemar =20.000,P<0.01,说明术后完整病理对食道病变的性质程度判定高于术前活检病理。
2.2 NBI-ME对早期食道癌浸润深度的预判作用
62例患者共69处病变为可疑EEC,术前AB分型与术后病理浸润深度结果的对应情况见表4。术前AB分型为B1者共50处,术前浸润深度评估为M1~M2期,术后病理结果为LGIN 8处、HGIN 8处和M1~M2期EEC 34处,B1型IPCL预判食道病变浸润深度的准确率为68.0%(34/50);IPCL分型为B2型的病变共15处,术前预判浸润深度为M3~SM1期,术后病理结果为M1期2处、M2期2处、M3期7处和SM1期4处,B2型IPCL预判食道病变浸润深度的准确率为73.3%(11/15);IPCL分型为B3型的病变共4处,术前预判浸润深度为SM1以深的食道病变,术后病理结果4处B3型病变浸润深度全部为SM1以深,其预判浸润深度准确率达100.0%(4/4)。NBI-ME判断早期食管癌的总体准确率为71.0%(49/69)。
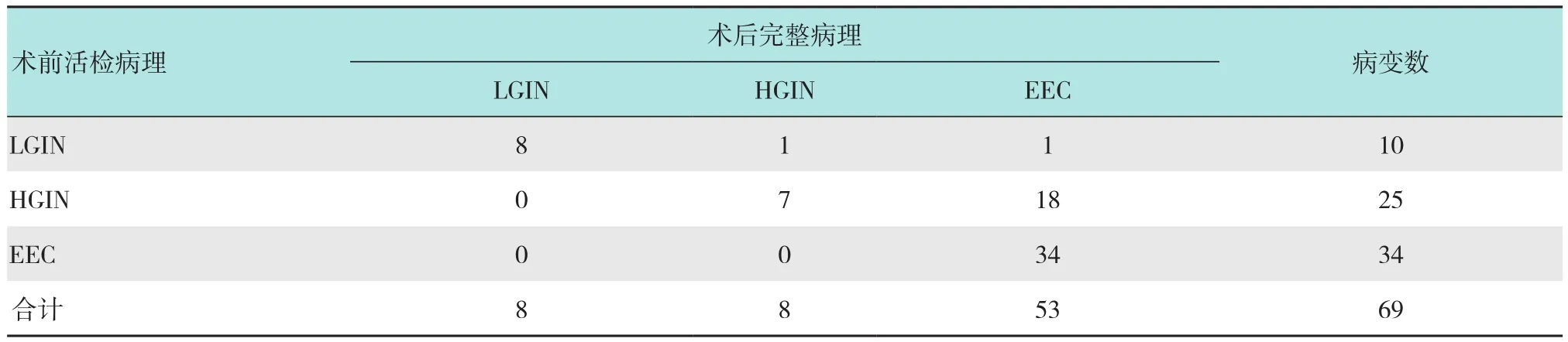
表3 NBI-ME术前活检病理与术后完整病理一致性比较 处Table3 Comparison of consistency between the histopathological results of NBI-ME preoperative biopsy and postoperative integrity pathology n
3 讨论
食管癌是指食管腺上皮或鳞状上皮异常增生所形成的恶性肿瘤,其演变过程呈渐进性发展,一般由轻度不典型增生逐步发展为中-重度不典型增生、原位癌、早期癌及中晚期浸润癌[8]。因此,早期确诊和及时治疗是改善食管癌患者预后、提高生存率的关键。目前,对于食管癌的筛查手段主要为内镜检查,而许多癌前病变及EEC患者内镜下常无特征性表现,主要以局限性充血、浅表糜烂及粗糙不平的黏膜浅层病变为主,易与食管炎性病变混淆,而极微小的病灶和“一点癌”在普通内镜下常常漏诊。有研究[9]表明,普通内镜对癌前病变的漏诊率高达40.0%。随着内镜技术的发展,NBI模式可以通过光学染色作用增强黏膜表层结构和微血管的显示效果,能够清楚地将病变范围突出显现,其与ME技术相结合则可进一步清晰显示食管黏膜IPCL形态,从而更有助于早期发现病灶,并可判断病变浸润深度。
本研究对102例患者(共132处病变)内镜检查过程中发现的食道病变均进行了NBI-ME模式观察,并将IPCL依据日本食管学会分型方法进行AB分型,与活检病理结果相比较,结果显示:IPCL为A型的病变多为食管炎95.0%,IPCL为B型的病变多为EEC或癌前病变,占96.7%。将AB分型预判病理结果与实际活检病理结果进行一致性分析,发现两者一致程度相当满意,说明可以根据IPCL分型来预测食管病变的性质。正常食管黏膜表浅血管由分枝状血管构成,紧贴黏膜肌层,向水平方向延伸,利用ME对食管鳞状上皮放大后可观察到IPCL。普通ME观察时,正常食管黏膜上皮的IPCL呈红色逗点状,而用NBI-ME观察时,深部的分支状血管为绿色,表浅的IPCL为棕色点状[5]。当发生食管炎时,IPCL基本不变或仅有轻微变化,而当发生癌变或癌前病变时,病变处部分扩张的异常血管密集增生,导致血管形态不整和排列不规则。因此,通过NBI-ME观察IPCL的形态分型来预测食管病变的性质,可以代替病理组织学活检,这样不但可以减轻患者的经济负担,还可以减轻由于活检所致的瘢痕对ESD手术操作的影响。
目前,内镜下治疗仍以检查过程中的活检病理诊断作为术前依据,但术前活检病理与术后完整病理在病变性质判定方面仍存在较大偏差。本研究中69处病变的术前活检病理与术后完整病理相比较,NBI-ME准确率为71.0%,略高于王实等[10]的报道,但术后病理对病变性质的判定结果较术前为重,提示术前活检病理存在一定的局限性。医生关于内镜下微小病变的发现能力对于取材阳性率具有重要影响,尤其是第1块活检的准确率至关重要,医生应结合NBI及ME尽量精准取材。由此可见,良好的技术和扎实的理论知识可以有效提高术前活检病理的准确性,有效降低术前和术后病理的偏差。
有研究[11]发现,EEC局限于黏膜层而未累及黏膜肌层时,淋巴结转移率较低,为0.0%~3.0%;当病变侵犯到黏膜下层时,其淋巴结转移率可达26.0%~50.0%。因此,术前进行浸润深度的评估对食管癌的治疗方式选择具有重要意义。虽然病理检查被称为判断病变性质的金标准,但在内镜技术飞速进步的当下,日渐显示出其局限性。由于术前活检病理不能够判断病变的浸润深度,对于食道癌前病变或EEC病例,若单纯依赖病理结果来判断病情或选择治疗策略,显然已经不能符合临床需求,需要一种更为准确的判断浸润深度的方法来为下一步治疗提供可靠依据。本研究显示,B1、B2型IPCL对EEC浸润深度预判的准确率分别达68.0%和73.3%,而B3型IPCL浸润深度预判的准确率高达100.0%,可见NBI-ME下B分型对浸润深度判断的准确率较高,与文献[12]报道一致。由于本研究未纳入无血管区(avascular area,AVA),未根据完整AB分型及AVA分型进行病变浸润深度的综合评估,可能影响B1和B2型对病灶浸润深度预判的准确性。
综上所述,NBI-ME下对食道病变的IPCL进行AB分型,有助于对食管病变性质及浸润深度的预判,同时结合活检病理结果,可实现对病变病情的综合评估,从而可以为患者制定最佳的治疗策略。

