小叶苦丁茶多酚提取物对盐酸/乙醇诱导小鼠胃损伤的预防效果
母健菲,赵 欣,龙兴瑶,3,周先容,潘妍霓,3,刘必慧,*
(1.重庆市功能性食品协同创新中心,重庆市功能性食品工程技术研究中心,功能性食品研发重庆市工程实验室,重庆第二师范学院生物与化学工程系,重庆 400067;2.西南大学食品科学学院,重庆 400715;3.车医科学大学食品生命工学专业,韩国京畿道 487-010)
小叶苦丁茶又称作“青山绿水”,其原植物为木犀科女贞属的粗壮女贞及其同属植物丽叶女贞、总梗女贞等,广泛分布于中国西南地区,尤其是贵州、四川和云南。研究表明,小叶苦丁茶具有保健功效,其功能性成分主要包括萜类、多酚类、苯丙素类、黄酮类物质[1]。由于这些功能性成分的存在,小叶苦丁茶具有散风热、清头明目、生津止渴、降血压、降血脂、降低胆固醇、抗菌消炎以及调节免疫系统等作用[1-2]。小叶苦丁茶多酚是从茶叶中提取的一类非常重要的成分,包括儿茶素类、黄酮类和酚酸类等[3],有研究表明小叶苦丁茶的降血脂、保肝等活性及清热解毒的传统疗效与其具有很强的抗氧化活性密切相关,而大叶苦丁茶的功效与其具有很强的抗菌及抗炎活性相关。小叶苦丁茶多酚对氧自由基有很强的清除能力,能攫取在新陈代谢作用和脂质过氧化过程中产生的自由基,并转化成活性较低的自由基,破坏自由基氧化链反应,同时茶多酚能够激活和提高机体中许多抗氧化酶(如 SOD、GSH、CAT等)的活性,高效清除自由基[4-5]。天然植物中包含多酚在内的多种抗氧化成分,已经逐步被应用于抗氧化保健产品的开发中。
胃是人体重要的消化器官,胃部疾病主要表现为胃损伤,常出现胃不适、胃痛甚至胃出血等症状,临床表现为胃酸过多、胃部灼烧、消化不良、腹部疼痛等。酒精、刺激性物质以及一些药物可能引起胃损伤[6]。近年来,酒精引发的疾病发病率明显增加,其中酒精性胃炎尤为突出,主要原因是酒精进入胃部,刺激胃粘膜,增加上皮组织细胞膜通透性,破坏胃粘膜屏障导致损伤。同时,酒精还会刺激胃组织,造成其严重蠕动,并引起机械损伤[7]。SOD是机体内重要的抗氧化酶,是体内唯一一种能够清除超氧阴离子的酶类物质,其活力能够反映机体清除自由基的能力,在抗氧化方面起着重要作用[8-9]。MDA是脂质过氧化代谢产物,可以破坏核酸、蛋白等生物大分子,造成机体损伤和疾病的发生,其产生还能加剧膜的损伤,可通过MDA了解膜脂过氧化的程度,间接测定膜系统的受损程度[10-11]。CAT是机体中一种重要的抗氧化酶,与SOD在机体内保持着动态平衡状态[12-13],机体发生氧化应激时以上物质就会受到影响。此外,机体炎症因子随机体也会发生改变,诱导型一氧化氮合酶(iNOS)和环氧合酶-2(COX-2)都是炎症相关基因,正常生理条件下,在多数器官中均检测不到表达,当机体受到各种病理刺激或损伤时,两者都会被迅猛诱导,表达量迅速上升[14-15]。NOS的另外两种神经型一氧化氮合酶(nNOS)和内皮型一氧化氮合酶(eNOS)是通过其s编码基因和对钙的依赖性进行区别的,主要存在于上皮和血小板中,两者可产生NO对机体进行调节。以上四种基因的表达升高或降低的特性可以作为判断炎症和组织损伤的标准[16-17]。有相关研究表明,茶多酚具有“七抗(抗氧化、抗炎、抗肿瘤、抗辐射、抗病毒、抗过敏、抗菌)、三降(降血脂、降血糖、降体重)、二防、(防动脉粥样硬化、防老年痴呆)、一解(解毒)”功能[3],其作用机制主要是茶多酚能够显著减少中性粒细胞的渗透物、肿瘤坏死因子-α,可有效减少血清中丙氨酸转氨酶、IL-6水平,并且可以在一定程度上降低多形核白细胞的渗透、IκBa的磷酸化,增加SOD活性,防止反应氮、氧自由基对细胞、DNA的功能结构造成损伤,进而有效防治急性炎症,减少刺激性物质对机体组织的损坏[18-19]。小叶苦丁茶含有多酚类物质种类较多,含量也丰富,且不同地区产小叶苦丁茶的多酚种类和含量也存在差异,并且苦丁茶的使用范围有限,目前针对其生物活性作用的研究不够深入,缺乏动物体内研究、临床研究和深入的分子层面的机制研究。
本文以小叶苦丁茶多酚提取物为研究对象,利用酒精与盐酸对胃的叠加损伤作用,建立小鼠胃损伤模型,观察小叶苦丁茶多酚对酒精盐酸溶液诱导小鼠胃损伤的预防作用,以期为小叶苦丁茶保健功能的开发利用奠定理论依据。
1 材料与方法
1.1 材料与仪器
小叶苦丁茶 安徽省芜湖市徽茶品茶业有限公司;没食子酸、福林-酚试剂、ABTS 都莱生物-中国生化试剂网;DPPH 南京化成工业株式会社;总超氧化物歧化酶(SOD测定试剂盒、丙二醛(MDA)测定试剂盒、谷胱甘肽(GSH)测定试剂盒 南京建成生物工程研究所;DNase/Rnase-Free Water 北京索莱宝科技有限公司;Trizol试剂、SYBR Select Master Mix、RevertAid First Stand cDNA Synthesis Kit 美国Life techmologies公司;qPCR引物COX-2、iNOS、eNOS、nNOS、Cu/Zn-SOD、Mn-SOD、CAT、GAPDH 美国Thermo Scientific公司;其余试剂 均为国产分析纯;清洁级6周龄雄性昆明小鼠50只(体质量20~25 g) 购于重庆医科大学实验动物中心(动物许可证SCXK(渝)2017-0001),在控温(22±4) ℃并保湿(50±20)%条件下,用标准饲料饲养,自由饮水,1周后进行实验。
LUX多功能性酶标仪、StepOne Plus定量PCR仪 美国Thermo Fisher Scientific公司;ICEN-24R高速冷冻离心机、MPC-P25微孔板离心机、Bioprep-24生物样品均质仪、Nano-300微量分光光度计 杭州奥盛仪器有限公司;OLYMPUS-BX43生物显微镜 日本奥林巴斯公司;LDZM-60KCS-Ⅱ立式压力蒸汽灭菌器 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 小叶苦丁茶茶多酚的提取 参考胡蓉[20]的多酚提取工艺,略有改动。称取100 g小叶苦丁茶打碎成粉,加入400 mL的45%(V/V)乙醇溶液,90 ℃浸提30 min,再重复1次,收集2次浸提液后调节提取液pH至6.0,然后加入160 mL 的AlCl3(6 g)和ZnCl2(12 g)混合沉淀剂进行沉淀,接着对混合液进行离心分离(3000 r/min、10 min),将200 mL盐酸(12%,V/V)加入收集到的沉淀中转溶,分离出上清液,分别加入2次200 mL乙酸乙酯进行萃取。最后对萃取液进行旋转蒸发(60 ℃)得到多酚提取物干物质。
1.2.2 小叶苦丁茶多酚含量的测定 分别取1、2、3、4、5 mL已知浓度为0.1 mg/mL的标准没食子酸溶液溶于蒸馏水中,配制成不同浓度的没食子酸溶液,按Folin-Ciocalteu比色法[21]在1 mL不同浓度的没食子酸溶液中加入3 mL的Folin-Ciocalteu显色剂和4.5 mL的饱和Na2CO3溶液后定容至25 mL。取显色后溶液于747 nm处测定吸光度,计算没食子酸的标准曲线。将样品溶于蒸馏水中采用以上方法测定吸光度,根据标准曲线求得小叶苦丁茶多酚的含量。
1.2.3 小叶苦丁茶多酚的体外抗氧化活性测定
1.2.3.1 清除DPPH活性的测定 DPPH是一种稳定的自由基,常应用于抗氧化物对自由基清除能力的测定[22-23]。取3.9 mL 25 μg/mL DPPH溶液分别与100 μL 200、400、600和800 μg/mL的SCKPE(small-leaf kudingcha polyphenol extract)溶液混匀(A1),取3.9 mL无水乙醇与分别与100 μL浓度为200、400、600和800 μg/mL的SCKPE溶液混匀(A2),取3.9 mL浓度为25 μg/mL DPPH溶液与100 μL80%甲醇溶液混匀(A3),然后室温下暗处静止反应30 min,在517 nm波长处测定吸光度。每个样品平均三次,取平均值,以100 μL浓度为200、400、600和800 μg/mL维生素C(VC)为阳性对照,计算清除率,公式如下:
1.2.3.2 清除ABTS活性的测定 根据Ren等[24]的方法,取5 mL 7 mmoL/L ABTS溶液和88 μL 140 mmoL/L的过硫酸钾溶液避光反应12 h,用时再用无水乙醇稀释到在波长为732 nm光下吸光值为0.70±0.02。取5 mL ABTS反应液分别与200 μL 200、400、600和800 μg/mL的SCKPE溶液混匀(A1),取5 mL无水乙醇与分别与200 μL浓度为200、400、600和800 μg/mL的SCKPE溶液混匀(A0),取5 mL浓度为ABTS反应液与200 μL 80%甲醇溶液混匀(A空),在室温下避光反应6 min,在波长734 nm处测定吸光度。重复三次取平均值,以200 μL浓度为200、400、600和800 μg/mL VC为阳性对照,计算清除率,公式如下:
1.2.3.3 清除羟自由基活性的测定 根据Zhang等[25]的方法,取300 μL 80%甲醇溶液加入2 mL FeSO4(9 mmol/L)和50%水杨酸乙醇溶液(9 mmol/L)1.0 mL,再加入H2O2(8.8 mmol/L)1.0 mL混匀(A0);反应混合物(Ai)(4.30 mL)含FeSO4(9 mmol/L)2.0 mL、H2O2(8.8 mmol/L)1.0 mL、样品溶液(1.0、2.0、4.0、6.0、8.0 mg/mL)0.3 mL、50%水杨酸乙醇溶液(9 mmol/L)1.0 mL;反应混合物(Aj)(4.30 mL)含FeSO4(9 mmol/L)2.0 mL、1.0 mL 80%甲醇、样品溶液(1.0、2.0、4.0、6.0、8.0 mg/mL)0.3 mL、50%水杨酸乙醇溶液(9 mmol/L)1.0 mL。最后将反应混合液置于37 ℃水浴锅中加热1 h后,吸取200 μL最终反应液于96孔板中在510 nm波长处测定吸光度。重复三次取平均值,以0.3 mL(1.0、2.0、4.0、6.0、8.0 mg/mL)VC为阳性对照,计算清除率,公式如下:
1.2.3.4 还原力的测定 采用铁离子还原力测定法[26],分别取200 μL不同浓度(200、400、600、800 μmol/L)的VC溶液和样品液,各加入0.2 mol/L pH6.6的PBS缓冲液2.5 mL,分别加入2.5 mL 1%的K3Fe(CN)6溶液充分混匀,置于50 ℃水浴锅加热20 min,取出快速冷却。加入2.0 mL体积分数为10%的三氯乙酸,进行终止反应。分别取混合液与2.5 mL蒸馏水混匀,再加入0.5 mL 0.1%的三氯化铁,充分混合,并在室温下静置10 min。对照组用2.5 mL甲醇溶液反应的混合液代替VC溶液和样品液。于700 nm处测定吸光度。重复三次取平均值,以VC为阳性对照。
1.2.4 动物实验 将小鼠平均分为5组,每组10只,分别为正常组、模型组、雷尼替丁灌胃组(50 mg/kg)、SKCPE低浓度组(100 mg/kg)、SKCPE高浓度组(200 mg/kg)。正常组和模型组小鼠不作任何处理;雷尼替丁灌胃组每天50 mg/kg灌胃雷尼替丁溶液0.2 mL;SKCPE灌胃高、低浓度组小鼠每天按200和100 mg/kg分别灌胃SKCPE溶液0.2 mL,以上灌胃进行14 d,每次灌胃都使用12号灌胃针通过小鼠口腔缓慢插入食道,不对小鼠胃部造成机械损伤。实验期间小鼠自由摄食和饮水,每天进行称重,记录饮食、饮水量。第14 d灌胃上述样品后对小鼠进行禁食,但允许自由饮水。禁食24 h后,第15 d以60%的酒精和40%150 mmol/L盐酸混合液为诱导剂,按小鼠体重每10 g灌胃0.1 mL对小鼠进行胃损伤诱导[27](正常组不诱导)。诱导0.5 h后,眼球取血并取胃组织用一次性注射器吸出胃液测定胃液量和胃液pH。
1.2.5 小鼠胃损伤水平测定 小鼠解剖后取胃组织平铺拍照,通过ImageJ 1.44软件测定胃损伤面积,根据公式计算抑制率,对各组小鼠胃组织损伤程度进行分析。
抑制率(%)=(模型组小鼠胃损伤面积-试验组小鼠胃损伤面积)/模型组小鼠胃损伤面积×100
1.2.6 小鼠血清及胃组织水平测定 将小鼠血浆于4 ℃、4000 r/min离心10 min收集血清,按照试剂盒说明书测定小鼠血清以及胃组织匀浆液中超氧化物歧化酶(SOD)活性和谷胱甘肽(GSH)、丙二醛(MDA)含量。
1.2.7 胃组织病理学观察 取小鼠胃组织于装有10%的福尔马林溶液中进行固定,并用不同浓度乙醇脱水,用二甲苯置换胃组织中乙醇使组织透亮,再用石蜡包埋切片,采用H&E染色法对切片染色,并用光学显微镜进行观察。
1.2.8 qPCR实验测定小鼠胃组织mRNA表达 取小鼠胃组织100 mg匀浆,用Trizol试剂提取胃组织细胞中总RNA,通过微量紫外分光光度计检测RNA浓度并稀释为1 μg/mL,取2 μL稀释后的总RNA提取液,依次加入1 μL的OligodT18、RNase、dNTP、MLV酶和10 μL的5×Buffer,在37 ℃ 120 min,99 ℃ 4 min,4 ℃ 3 min条件下合成cDNA。然后以反转录-聚合酶链反应法扩增nNOS、eNOS、iNOS、COX-2、Mn-SOD、Gu/Zn-SOD和CAT(引物表1),同时以持家基因(GAPDH)作为内参照按同样条件进行扩增。用ImageJ 1.44软件进行半定量分析[28]。

表1 引物的序列Table 1 Primer sequences
1.3 数据统计
对每只小鼠的血清和组织测定实验进行三次平行实验后取平均值,采用SPSS 17.0统计软件中One-Way ANOVA 法进行单因素方差分析,多组均数的两两比较采用LSD法检验,分析各组数据在p<0.05水平上相互是否具有显著差异。
2 结果与分析
2.1 小叶苦丁茶多酚提取物的含量
按照1.2.2方法绘制没食子酸标准液的标准曲线,得出标准曲线的回归方程为y=6.7059x-0.2294(R2=0.9983),小叶苦丁茶多酚吸光度为0.792,通过计算得小叶苦丁多酚提取物含量为5.082 μg/ml。
2.2 小叶苦丁茶多酚提取物体外抗氧化效果
2.2.1 小叶苦丁茶多酚提取物(SKCPE)的DPPH自由基清除能力 DPPH自由基有单电子体,当有自由基清除剂存在时,与其单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系,从而间接定量自由基清除剂的含量。样品对DPPH自由基清除能力的大小可反映该样品抗氧化能力的大小[29]。由图1可以看出,小叶苦丁茶和VC在一定浓度范围内都对DPPH有一定的清除作用,随着浓度的增加对DPPH清除能力也增强。从整个浓度增加趋势看,VC对DPPH自由基的清除率缓慢增强,小叶苦丁茶多酚对DPPH的清除率在600 μg/mL处急剧上升,当浓度800 μg/mL 时,小叶苦丁茶多酚的清除能力达到32.15%,VC的清除能力达到11.56%。由此说明小叶苦丁茶多酚对DPPH的清除能力较VC强。

图1 小叶苦丁茶多酚提取物(SKCPE)的DPPH自由基清除能力
2.2.2 小叶苦丁茶多酚提取物(SKCPE)的ABTS自由基清除能力 ABTS法用于亲水性和亲脂性物质抗氧化能力测定,在适当的氧化剂作用下氧化成绿色的ABTS+·,在抗氧化物存在时ABTS+·的产生受到抑制,自由基减少,使其蓝绿色褪去,褪色越明显,表明该物质的抗氧化能力越强[30]。由图2可以看出,不同的样品不同的浓度对ABTS自由基有不同的清除效率,清除率和质量浓度呈正相关的关系。在相同条件下,小叶苦丁茶多酚的ABTS自由基清除率均高于VC。在实验浓度范围内,当样品浓度为800 μg/mL时,小叶苦丁茶多酚和VC对ABTS自由基的清除率分别为37.47%和25.88%。由此说明小叶苦丁茶多酚对ABTS自由基有较强的清除能力,清除效果优于同浓度下的VC。

图2 小叶苦丁茶多酚提取物(SKCPE)的ABTS自由基清除能力
2.2.3 小叶苦丁茶多酚提取物(SKCPE)的羟自由基清除能力 自由基损伤机体的心、脑、肝等细胞组织,是机体产生某些疾病和衰老症状的主要原因,尤其是羟自由基对机体的损伤尤为严重[31]。羟自由基属于活性氧的一种,能导致许多有害效应,当加入羟自由基去除剂时,去除效果显著。实验对小叶苦丁茶多酚和VC在2、4、6、8 mg/mL的浓度条件下对羟基自由基的清除能力进行分析。由图3可看出,随着样品质量浓度的增加,各样品对羟自由基的清除率逐渐加强,在浓度为8 mg/mL时,小叶苦丁茶多酚和VC的清除率最高,分别为48.40%和44.32%,由此表明小叶苦丁茶多酚清除率明显高于VC。

图3 小叶苦丁茶多酚提取物(SKCPE)的羟自由基清除能力
2.2.4 小叶苦丁茶多酚提取物(SKCPE)的铁离子还原能力 还原能力能够表征物质在氧化还原反应中给出电子自身发生氧化的能力,通过三价铁离子还原法观察物质的还原能力,以吸光度表示结果,吸光度值越大,说明样品的还原能力越强[32]。由图4可看出,随着样品质量浓度的增加,吸光度逐渐增加,即还原力逐渐增强。在浓度为200 μg/mL时,小叶苦丁茶多酚的还原力与VC相近,但小于VC;在浓度为800 μg/mL时,小叶苦丁茶和VC较200 μg/mL时的还原力有所上升,上升趋势较缓慢,VC随浓度增加还原力增强,且趋势较明显。总体上看,VC、小叶苦丁茶多酚的还原力与浓度呈正相关,变化趋势为VC强于小叶苦丁茶多酚。

图4 小叶苦丁茶多酚提取物(SKCPE)的铁离子还原力
2.3 小叶苦丁茶多酚提取物对胃损伤小鼠胃损伤水平的影响
小鼠经盐酸/乙醇诱导剂诱导后,小鼠胃部上皮顶端胞浆膜受到破坏,细胞脱落,出现糜烂和溃疡,损伤严重则会累及血管引起胃出血,并引起胃黏膜上皮层发生改变[33-34]。由图5可知,与正常组相比,模型组小鼠胃黏膜出现明显的糜烂和出血,而SKCPE低剂量组、SKCPE高剂量组和雷尼替丁组小鼠胃黏膜的出血和糜烂面积均明显小于模型组,损伤程度为SKCPE低剂量组>SKCPE高剂量组>雷尼替丁组。
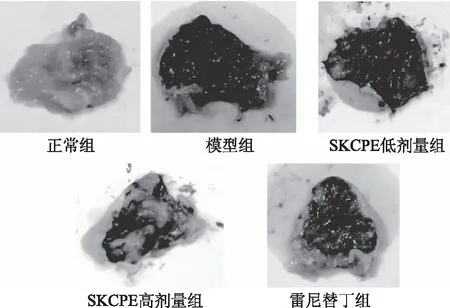
图5 小叶苦丁茶多酚提取物对盐酸/乙醇诱导胃黏膜损伤小鼠的胃外观观察
由图5和表2可知,胃损伤模型组小鼠的损伤程度显著高于其余组(p<0.05)。药物治疗雷尼替丁组小鼠的胃损伤程度显著低于SKCPE高、低剂量组和模型组,抑制率显著高于SKCPE高、低剂量组和模型组(p<0.05),SKCPE高、低剂量组小鼠的胃损伤程度显著低于模型组,抑制率显著高于模型组(p<0.05),SKCPE高剂量组的抑制率达到40.54%,与雷尼替丁组相差21.62%。由此可知,小叶苦丁茶多酚对小鼠胃损伤有一定的预防作用,SKCPE高剂量组的效果更为显著。

表2 小叶苦丁茶多酚提取物治疗盐酸/乙醇诱导胃损伤小鼠的胃损伤程度Table 2 Gastric injury levels of HCl-ethanol-induced gastric injury in rats with polyphenols of small-leaved kudingcha extract treatment
2.4 小叶苦丁茶多酚对胃损伤小鼠胃液量和胃液pH的影响
小鼠胃受到刺激和损伤时会出现胃液分泌过多,胃酸pH下降[35]。由表3可知,与正常组相比,模型组、SKCPE高、低剂量组和雷尼替丁组的胃液量显著增加(p<0.05),胃液pH显著降低(p<0.05),模型组pH最低为1.70±0.67,而雷尼替丁组和SKCPE高剂量组小鼠的胃液量和胃液pH不存在显著性差异,都与正常组的各项指标更为接近。由此说明,小叶苦丁茶多酚对小鼠胃液量分泌及胃液pH以及对小鼠胃部黏膜具有一定的保护作用,其中高剂量的SKCPE与雷尼替丁对小鼠胃损伤的预防保护效果相近。

表3 各组小鼠的胃液量及胃液pH Table 3 Gastric fluid volume and gastric juice pH of each group of mice
2.5 小叶苦丁茶多酚提取物对小鼠胃组织病理学变化的影响
在光学显微镜下观察由盐酸/乙醇诱导胃损伤小鼠的胃组织病理切片如图6所示。正常组小鼠胃粘膜组织结构完整,未出现充血和炎性细胞浸润[36];模型组小鼠胃粘膜大量上皮细胞脱落,腺体结构虽未受到破坏,但细胞受损严重,有大量炎性细胞浸润,区域内可见较多红细胞,充血情况严重;雷尼替丁组小鼠胃粘膜同模型组相比损伤情况明显改善;低浓度小叶苦丁茶多酚灌胃组小鼠胃粘膜组织结构变化同模型组相比,仍有上皮细胞结构脱落,但胃粘膜炎性细胞浸润程度显著降低,红细胞数量也明显减少,损伤状况有所缓解;高浓度小叶苦丁茶多酚灌胃组小鼠胃黏膜组织结构比较完整,炎性细胞及红细胞数量明显下降,较低浓度组改善程度更明显。由此可看出,小叶苦丁茶多酚对小鼠胃损伤有预防作用,并存在剂量效应关系。
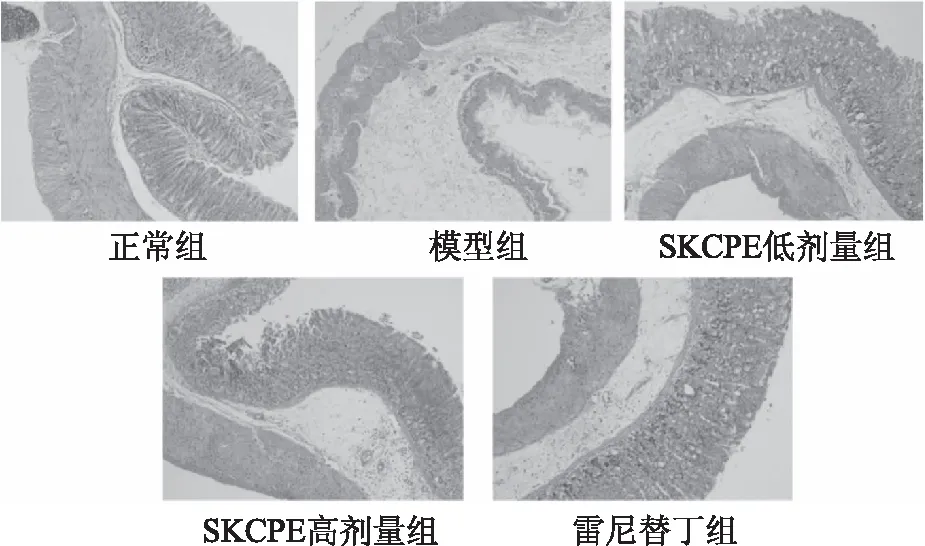
图6 小叶苦丁茶多酚提取物对盐酸/乙醇诱导胃损伤小鼠的胃组织形态学变化的影响(200×)
2.6 小叶苦丁茶多酚提取物对小鼠血清及胃组织SOD、GSH、MDA水平的影响
从表4、表5可知,正常组小鼠血清及胃组织中SOD活性和GSH含量均最高,脂质过氧化终产物MDA含量最低,而模型组小鼠血清及胃组织中SOD活性、GSH含量和MDA含量与正常组相反,并存在显著性差异(p<0.05)。低剂量小叶苦丁茶多酚灌胃组小鼠的SOD、GSH水平与正常组相比显著降低(p<0.05),但与模型组相比其SOD活性和GSH含量显著上升(p<0.05),MDA含量在血清和胃组织中都显著低于模型组、高于正常组(p<0.05)。高剂量小叶苦丁茶多酚灌胃小鼠血清及胃组织中SOD活性和GSH含量较低剂量组显著升高(p<0.05),MDA含量显著降低(p<0.05),各指标水平与雷尼替丁组灌胃小鼠相当,都趋近于正常组水平。高剂量组小鼠血清中SOD与正常组仅相差33.04 U/mL,组织中仅相差6.96(U/mg prot);雷尼替丁组小鼠的SOD、MDA、GSH水平都显著优于模型组和高、低小叶苦丁茶多酚灌胃组小鼠,基本接近正常组。由此可看出,小叶苦丁茶多酚能显著上调胃损伤小鼠血清及胃组织中SOD活性和GSH含量,下调MDA含量,且浓度越高,效果越显著。

表4 小叶苦丁茶多酚提取物对小鼠血清SOD、GSH、MDA水平的影响Table 4 Effect of SKCPE on the level of SOD,GSH,MDA in serum of mice

表5 小叶苦丁茶多酚提取物对小鼠胃组织SOD、GSH、MDA水平的影响Table 5 Effect of SKCPE on the level of SOD,GSH,MDA in gastric tissue of mice
2.7 小叶苦丁茶多酚提取物对相关基因转录水平的影响
2.7.1 小叶苦丁茶多酚提取物对小鼠胃组织中Cu/Zn-SOD、Mn-SOD、CAT mRNA表达的影响 从表6可知,与正常组相比,模型组和经处理过的SKCPE低剂量组、SKCPE高剂量组和雷尼替丁组中CAT、Cu/Zn-SOD、Mn-SOD的表达量均显著降低(p<0.05)。其中模型组中相对表达量最低,小叶苦丁茶多酚高、低剂量组中Mn-SOD、CAT表达量都显著高于模型组低于正常组,且与模型组之间存在显著差异(p<0.05),小叶苦丁茶多酚低剂量组小鼠胃组织中CuZn-SOD在mRNA水平上的相对表达量与模型组不存在显著性差异,但SKCPE低剂量组的相对表达量(1.53±0.38)高于模型组。SKCPE低、高剂量组中Cu/Zn-SOD、Mn-SOD、CAT mRNA表达存在显著性差异(p<0.05),且高剂量组相对表达量高于低剂量组。雷尼替丁组与正常组小鼠胃组织中Cu/Zn-SOD、Mn-SOD、CAT mRNA表达存在显著性差异(p<0.05),但与SKCPE高剂量组不存在显著性差异。由此说明,小叶苦丁茶多酚能显著提高由盐酸/乙醇诱导的胃损伤小鼠模型胃组织中Cu/Zn-SOD、Mn-SOD、CAT的表达量,高剂量的小叶苦丁茶多酚对小鼠胃损伤的预防效果与雷尼替丁效果相当,均能有效降低小鼠胃损伤程度。

表6 小叶苦丁茶多酚提取物对小鼠胃组织中Cu/Zn-SOD、Mn-SOD、CAT相对表达量的影响Table 6 Effect of polyphenols of SKCPE on Cu/Zn-SOD,Mn-SOD,CAT relative experssion in gastric tissue of mice
2.7.2 小叶苦丁茶多酚提取物对小鼠胃组织中eNOS、nNOS、iNOS、COX-2 mRNA表达的影响 胃损伤模型小鼠胃组织相关炎症因子相对表达量如表7所示。由表7可知,模型组的iNOS和COX-2表达最强(p<0.05),正常组的表达最弱;小叶苦丁茶多酚灌胃小鼠胃组织中iNOS和COX-2基因的 mRNA 表达量与其他组具有显著性差异(p<0.05),小叶苦丁茶多酚灌胃组iNOS和COX-2的相对表达量显著低于模型组,其中高剂量组显著低于低剂量组(p<0.05),灌胃组和阳性药物雷尼替丁组高于正常组。eNOS和nNOS的相对表达量则与iNOS和COX-2相反,正常组的相对表达量最高,模型组最低,小叶苦丁茶多酚灌胃组的表达量均显著高于模型组(p<0.05),低于正常组和阳性药物雷尼替丁组(p<0.05),SKCPE高剂量灌胃组小鼠的eNOS和nNOS的相对表达量显著高于SKCPE低剂量组(p<0.05),且与雷尼替丁组小鼠的相对表达量差距较小。由此说明小叶苦丁茶多酚能较好地抑制炎症,对盐酸/乙醇诱导胃损伤模型小鼠胃组织具有保护作用,在高浓度时效果更佳。
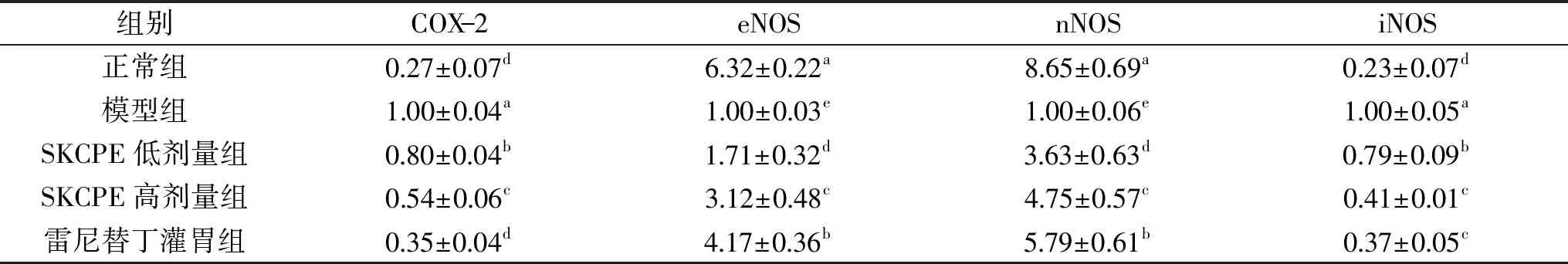
表7 小叶苦丁茶多酚提取物对小鼠胃组织中eNOS、nNOS、iNOS、COX-2相对表达量的影响Table 7 Effect of polyphenols of SKCPE on eNOS,nNOS,iNOS,COX-2 relative experssion in gastric tissue of mice
3 结论
本研究以小叶苦丁茶多酚提取物作为研究对象,测定其在体外的抗氧化效果,观察了SKCPE对盐酸/乙醇诱导胃损伤的预防作用,针对其多酚物质的胃损伤预防效果进行了相关基因的转录水平研究,从胃损伤抑制率、胃液分泌量、胃液pH、胃组织病理切片、血清及胃组织中SOD活性和GSH、MDA含量、胃组织中Cu/Zn-SOD、Mn-SOD、CAT、eNOS、nNOS、iNOS、COX-2的mRNA表达等方面进行了研究,结果显示,SKCPE有较强的体外抗氧化能力,在动物实验中相对模型组小鼠,SKCPE能抑制盐酸/酒精对小鼠胃组织造成的影响,缓解胃黏膜受损,使小鼠机体各项指标向正常状态转变,充分展示了SKCPE可以降低盐酸/乙醇诱导的胃损伤程度,且存在质量效应关系,高浓度小叶苦丁茶多酚的作用更为强烈。基于体外和动物实验结果可以看出,小叶苦丁茶多酚提取物作为有效的天然活性物质,对胃损伤有显著预防效果,其作用机理和人体实验有待进一步挖掘。

