超高压处理对养殖大黄鱼肌动球蛋白生化特性的影响
杨巨鹏,吕春霞,雷叶斯,张慧恩,曹少谦,杨 华
(浙江万里学院,浙江宁波 315100)
大黄鱼(Pseudosciaenacrocea)俗名又称大鲜、大黄花[1],资源丰富,且具有非常高的食用价值[2],是我国传统意义上的四大海产之一。现今对大黄鱼的研究主要集中在养殖、保鲜、鱼肉深加工三个方面[3]。大黄鱼蛋白质含量很高,拥有丰富的微量元素和多种维生素,对人体的滋补效果明显。除了作为常用菜肴之外,还可以作为身体虚弱老人的一道食补菜,它含硒丰富,所以可以很大程度地消灭新陈代谢产生的自由基,延缓衰老,预防多种癌症的发生[4]。中医认为,大黄鱼可以健脾胃、治痢疾、补气、补精,不仅如此,它还对于贫血、失眠、头晕、食欲不振等不良症状有很好的食疗功效[5]。
超高压技术(ultrahigh pressure,UHP)是一种新兴食品加工技术,即将食品通过一定的液体介质(一般情况下为水、甘油等),在一定的温度下对样品采用100~1000 MPa高压处理适当时间[6]。UHP属于一项非热加工技术,利用物理作用,避免热加工的破坏作用,从而达到杀灭食品中的微生物、钝化酶或使其部分失活、使蛋白质变性的效果,实现延长食品货架期、保持食品原有营养成分与风味[7-8]的效果,现阶段UHP已在诸多食品领域有所运用[9]。UHP可以把维持蛋白空间结构的各种化学键破坏,导致其空间结构改变,甚至使蛋白发生变性。目前,超高压对养殖大黄鱼肌动球蛋白生化特性的影响鲜有报道。鉴于此,本文通过研究超高压处理后养殖大黄鱼肌动球蛋白生化特性的变化,为科学加工大黄鱼提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜死的养殖大黄鱼(0.5~1.0 kg) 宁波市水产市场;磷酸二氢钾、磷酸氢二钾、乙酸、马来酸(顺丁烯二酸)、Tris(三羟甲基氨基甲烷)、1-苯胺基8-萘基硕酸盐(ANS)、氯化钾 均为分析纯,国药集团化学试剂有限公司;5.5-二硫代双-C2-硝基苯甲酸(DTNB BR)、EDTA Na2(乙二胺四乙酸二钠)国药集团化学试剂有限公司;Ca2+-ATPase酶测试盒(货号:A070-4) 南京建成生物工程研究所。
Centrifuge 5804R离心机 德国Eppendorf;F-80高速粉碎机 姜堰市新康医疗器械有限公司;J-26XP高速冷冻离心机 美国贝克曼库尔特;Forma-725超低温冰箱 艾本德中国有限公司;BCD-216ZDJ可调式冰箱 青岛海尔特种电冰柜有限公司;UV2000 紫外分光仪 上海舜宇恒平科学仪器有限公司;DK-8恒温水浴锅 上海维诚仪器有限公司;AFS-3100荧光分光光度计 北京市海光仪器有限公司;SYSTEM GelDoc XR+BIO-RAD凝胶成像仪 伯乐公司;HPP.M超高压处理设备 天津市华泰森淼生物工程技术有限公司。
1.2 实验方法
1.2.1 大黄鱼肌动球蛋白的提取 取养殖大黄鱼背部肌肉用绞碎机绞碎,取背部肌肉10 g,放入离心杯,再加入40 mL 4 ℃磷酸缓冲液(pH=7.5),充分搅拌后离心分离10 min,转速6000 r/min,温度4 ℃,取杯内的下部沉淀物,然后将此操作重复4次。然后向最后一次提取好的沉淀中加入60 mL pH7.5 mol/L的氯化钾磷酸缓冲液。在4 ℃冰箱内静置,时间为20 h,静置期间用0.5 mol/L Na2HPO4控制pH为7.5,将提取液在8000 r/min 4 ℃的条件下离心分离15 min。然后取上清液用3层纱布过滤,只保留滤液。提前在容器中准备好10倍提取液体积的冷却水,将提取液随着容器壁慢慢地注入,并缓缓搅拌。此时溶液用5%乙酸调节pH,至5.5~5.6左右,静置冷却。上下分层明显后,弃去上清液,再将沉淀下来的蛋白质在6000 r/min,4 ℃的条件下离心分离10 min。用容器收集蛋白,测定蛋白沉淀量,然后加入一定量3 mol/L的KCl溶液,使得KCl的最终浓度为0.6 mol/L,再用0.6 mol/L KCl-20 mmo1/L Tris-马来酸缓冲液(pH=7.0)透析过夜,在11000 r/min,4 ℃的条件下离心分离15 min,所得上清液即为肌动球蛋白溶液,按照顺序编号,放在4 ℃冰箱冷藏备用[10]。
首先对肌动球蛋白进行高压蒸煮袋真空包装,然后再用聚乙烯塑料进行第二次真空包装,第一次装不得留有气泡或者顶隙,第二次包装是为了防止破坏单层蒸煮袋。放入超高压机器,在300、350、400 MPa下分别保压3、6、9 min,取出后快速采用冰水进行冷却,并进行理化性质分析,未用完的样品放入-20 ℃冰箱保存。
1.2.2 Ca2+-ATPase活性测定 采用南京建成生物工程研究所所提供的超微量Ca2+-ATPase酶测试盒(货号:A070-4)实验方法进行,酶活力单位的定义如下:
式中,酶的活力单位:微摩尔磷/毫克蛋白/小时(μmol Pi/mg prot/h);ATPase活力单位:U/mg prot;标准品浓度:0.02 μmol/mL;待测样本蛋白浓度:mg prot/mL。
注:6:单位上是用小时,但是操作时间只有10 min,所以要乘以6;2.8:在反应体系中进行2.8倍的稀释。
1.2.3 表面疏水性测定 用ANS荧光探针法测定表面疏水性[11]。用0.6 mol/L KCl-磷酸盐缓冲液将肌动球蛋白稀释成5个浓度(0.1、0.2、0.3、0.4、0.5 mg/mL),取2 mL样品,在20 ℃孵育10 min,加入8 mmol/L ANS溶液10 μL,设定激发波长λex=390 nm(狭缝校正5 nm),发射波长λex=470 nm(狭缝校正5 nm),测定荧光强度。以荧光强度对蛋白质质量浓度作曲线,曲线初始阶段的斜率即为蛋白质的表面疏水性指数(S0)。
PPP项目融资指的就是国家政府和个人企业为了公共设施的建设暂时达成的一种具有合作意义的关系。PPP项目最早是由英国政府为了缓解国内的资金流动,建设公共设施而提出的模式,这种模式能够充分的利用民间资本极大的弥补资金上的短缺问题,从而降低投资上的风险问题。就目前国内发展现状来说,我国还处于社会主义初期阶段,各项公共基础设施还不完善,建设资金也十分有限,所以才会引用PPP机制,使得我国的公共基础设施建设得到了很好的发展。
1.2.4 活性巯基含量测定 参照朱东宏等[12]的实验方法,并稍作修改。向1 mL蛋白样液中加入9 mL的Tris-HCl(0.2 mol/L,pH6.8,10 mmol/L EDTA)缓冲液。取4 mL上述混合液,加入0.4 mL 0.1% DTNB溶液,在4 ℃的条件下静置1 h后于412 nm下进行比色。空白样液将蛋白样液换成蒸馏水即可。活性巯基含量计算方法
式中,B是在除去试剂空白之后在412 nm处的吸光值;D是在此反应过程中稀释的倍数,C为蛋白质浓度(mg/mL)。
1.2.5 蛋白质热变性 将超高压处理过的肌动球蛋白溶液进行冷冻干燥处理,所得肌动球蛋白固体样品放入-20 ℃冰箱保存备用。用差示扫描量热法(DSC)分析蛋白质热变性[13]。精确称取冷冻干燥处理过的肌动球蛋白固体样品3~9 mg置于铝坩埚中,记录数值精确到1/10000 g,保持初始温度为30 ℃,密封坩埚,放入仪器,进行测定。保持恒定的温度5 min,加热范围为30~180 ℃,加热速率为10 ℃/min,氮气流量为100 mL/min,反应气体流量50 mL/min,空坩埚作为对照样,平行测定3次。
1.2.6 SDS-PAGE电泳的测定 取适量样品,用0.1 mol/L磷酸盐缓冲液调整浓度为1 mg/mL左右,取5 μL调整好的样品,加入5 μL蛋白质上样缓冲液,100 ℃加热3 min,冷却至室温后取10 μL进行点样,分离胶质量分数为12%,浓缩胶质量分数为5%。电泳结束标志为溴酚蓝到达分离胶底部上方约1 cm处,关闭电源,取出凝胶。用0.1%的考马斯亮蓝R-250对凝胶进行染色20 min,用25%的甲醇和7%的醋酸混合液脱色。用BIO-RAD凝胶成像仪拍照,并保存图片。
1.3 数据处理
数据结果采用Excel与Origin进行处理。
2 结果与分析
2.1 超高压处理对养殖大黄鱼肌动球蛋白的Ca2+-ATPase活性的影响
鱼体中存在的肌球蛋白与肌动蛋白在ATP作用下生成肌动球蛋白,而肌球蛋白的重要生物活性之一就是具有Ca2+-ATPase活性。活性反映肌球蛋白头部性质的变化,是鱼肉在保鲜过程中蛋白质性质的一个重要指标,其活性值越高,说明蛋白质性质越稳定,变性程度越小。同时钙离子ATP酶活力的大小反映了肌球蛋白分子完整性[14-15]。
由图1可得出超高压处理对大黄鱼肌动球蛋白的影响显著(p<0.05),肌动球蛋白的钙离子ATP酶活性出现明显改变。在保压时间3 min下,样品钙离子ATP酶活性随压力上升呈现先增后减又增趋势;在保压时间6 min下,样品钙离子ATP酶活性随压力上升呈现先增后减趋势;而9 min保压时间下,样品钙离子ATP酶活性随压力上升呈现逐渐降低趋势。在同一压力下,在400 MPa压力下随着处理压力时间的增加,钙离子ATP酶活性随保压时间延长呈现逐渐降低趋势;在300、350 MPa压力下随着处理压力时间的增加,钙离子ATP酶活性随保压时间延长呈现呈现先增后减趋势。高压过程中,过高的压力使肌动球蛋白分子的表面结构有所改变,破坏了蛋白质原有的排列方式,使表现出来的钙离子ATP酶活性降低。由于压力越大,表面结构改变越大,400 MPa 9 min处理的样品钙离子ATP酶活性最低。
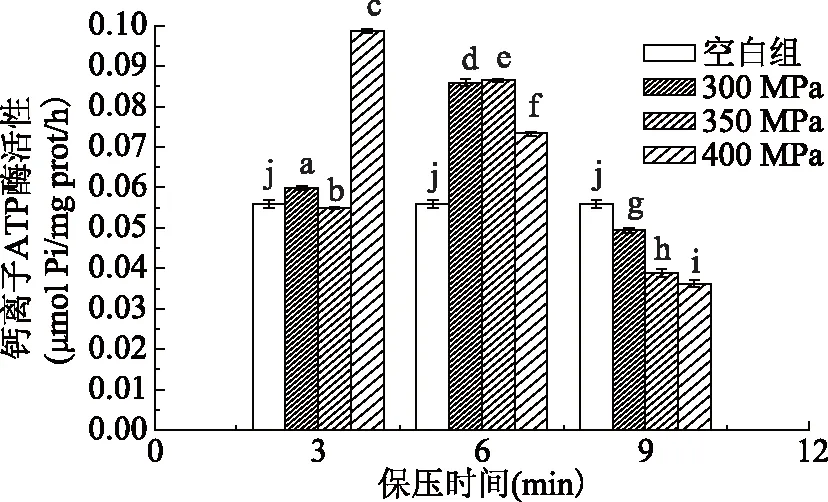
图1 不同压力及不同保压时间作用下Ca2+-ATPase活性变化Table 1 Changes of Ca2+-ATPase activity under different pressure and pressure holding time
2.2 超高压处理对养殖大黄鱼肌动球蛋白的表面疏水性影响分析
表面疏水性属于蛋白质的重要性质,对于维持蛋白质的稳定性和生物活性有着很大的作用[19]。疏水基团和极性溶液环境结合数目的指标是蛋白质表面疏水性,蛋白的表面疏水性是用来衡量蛋白变性程度的,这是因为它能够反应蛋白位点在化学上或物理上的微妙变化,同时可以体现出蛋白表面疏水性氨基酸的相对含量[19]。表面疏水性在蛋白结构研究中是一个普遍的指标。一般认为由于氧化使得埋藏在蛋白天然构像内部的疏水性氨基酸残基暴露出来,继而提高了蛋白表面的疏水性。
由图2可得出超高压处理后大黄鱼肌动球蛋白表面疏水性变化显著(p<0.05)。在同一保压时间下,随着压力增加,表面疏水性也随之增加;在同一压力下,随着保压时间增加,表面疏水性也随之增加。但9 min 350 MPa以后,表面疏水性增加的趋势有所减缓(p>0.05)。可能是由于超高压过程中,过高的压力破坏了蛋白质的表面结构,让内部的疏水性基团暴露在蛋白质表面,破坏了蛋白质原有的排列方式和顺序,提高了蛋白质表面的疏水性。同时,350 MPa的高压处理时,蛋白质内部的疏水性氨基酸已经大部分暴露在蛋白质表面了,故400 MPa处理下表面疏水性增加趋势有所减缓。压力对疏水作用的影响可能主要是由于水化压缩性之间的差量导致蛋白分子的展开[16]。疏水区域的暴露是大的肌球蛋白聚集体形成的先决条件。疏水基团在蛋白质发生凝聚时起了促进作用,促进方式主要是通过加强蛋白质之间的相互作用[15]。
2.3 超高压处理对养殖大黄鱼肌动球蛋白的活性巯基影响分析
绝大多数的巯基存在于半胱氨酸中,其是蛋白质结构的重要组成部分,也是生物体内一些氧化还原反应的基础基团。蛋白质结构中两个巯基脱氢形成的二硫键能使相邻多肽得以连接,这一点在维持蛋白质完整结构上有着十分重要的意义,并且在一定程度上可以反映超高压处理对养殖大黄鱼肌动球蛋白的变性情况[21]。
由图3可以看出,超高压处理对大黄鱼肌动球蛋白的影响显著(p<0.05),在同一保压时间下,随着压力增加,活性巯基含量也随之增加;在同一压力下,随着保压时间增加,活性巯基含量也随之增加。但350 MPa以后,活性巯基含量增加的趋势有所减缓。可能是由于超高压过程中,压力促使蛋白质开始变性和展开,逐渐促进蛋白形成致密有序的三维网络凝胶结构[23]。同时其在350 MPa高压处理下,致密有序的三维网络凝胶结构已经大致形成,故400 MPa处理下活性巯基含量增加趋势有所减缓。肌动球蛋白在变性过程中发生了共价交联,活性巯基大多数会脱氢形成双硫键。此外,巯基脱氢形成双硫键的反应,一定的条件下是可逆的[22]。Lanier等[23]报道二硫键的形成对鱼糜凝胶有重要作用。由于肌动球蛋白中含有巯基的氨基酸在变性过程中形成二硫键,这对凝胶形成具有重要作用。

图3 不同压力及不同保压时间作用下的活性巯基含量变化Table 3 Changes of active sulfhydryl content under different pressure and pressure holding time
2.4 超高压处理对养殖大黄鱼肌动球蛋白的蛋白质热变性影响分析
超高压处理会引起鱼体中肌动球蛋白的变性,蛋白质发生变性其热焓也会发生变化,采用差示扫描量热仪(DSC)进行分析[15],DSC曲线中的吸收峰表示蛋白热量被吸收,也是蛋白质的热变性的过程,目标蛋白会呈现固定的吸收峰;峰值的变化、变性温度的位移和消失可反映蛋白的变性情况。由此可根据DSC图谱的变化推测蛋白构象的变化,进而得到超高压处理后肌动球蛋白结构的稳定性。
如图4所示,经超高压处理后的的热焓高于未处理组样品,超高压组按保压变化时间长短由短到长分别在118、109、101 ℃时出现吸收峰,而空白组在147 ℃出现吸收峰,说明超高压处理降低了肌动球蛋白的热稳定性,超高压处理破坏肌动球蛋白构象,导致变性温度降低。

图4 超高压处理对养殖大黄鱼肌动球蛋白的蛋白质热变性影响分析Table 4 Effects of ultrahigh pressure treatment on protein thermal denaturation of cultured large yellow croaker actin
蛋白质的热变的过程是一个吸热的过程,通常情况为蛋白质吸收能量,内部氢键发生断裂,其高级结构展开,破坏了原有的构象。从DSC曲线中能够间接表现出蛋白质内部结构的变化情况,变性焓值和蛋白质的变性程度有着负相关的关系,变性焓值越小,变性程度就越大,反之亦然[24]。
2.5 超高压处理对养殖大黄鱼肌动球蛋白的SDS-PAGE电泳影响分析
肌动球蛋白并不是一种单一的蛋白,它是由肌动蛋白和肌球蛋白组合形成的复合体[24]。肌球蛋白分子中有6条肽链,其中有2条分子质量约200 kDa的重链(MHC)和4条分子质量约20 kDa的轻链(MLC);而肌动蛋白则较为简单,其内部一般只有分子质量在45 kDa左右的单链多肽链。
由图5可知,超高压处理对肌动球蛋白影响明显。与对照组相比,经过超高压处理的样品在200 kDa左右的条带均有明显变淡和变浅,说明超高压破坏了肌球蛋白中的重链结构。随着超高压压力的增加和保压时间的延长,下部分子量较低的条带各有不同程度的加粗和加深,说明在此区域内的蛋白有所增加,很有可能是因为超高压破坏了肌动球蛋白分子的结构,将一部分的大分子蛋白破碎成小分子蛋白,总体分子量有所减少。

图5 超高压处理对养殖大黄鱼肌动球蛋白的电泳图Table 5 Electrophoresis of actin in cultured large yellow croaker (Pseudosciaena crocea)by ultrahigh pressure treatment
3 结论
利用超高压对养殖大黄鱼肌动球蛋白进行处理,发现肌动球蛋白在不同的压力和保压下肌动球蛋白分子结构发生改变和破坏。随保压时间的增加和压力的增大,大黄鱼肌动球蛋白的钙离子ATP酶活性整体呈下降趋势,表面疏水性随之增大,活性巯基含量增加,蛋白质热变性变性焓值也随之减少,蛋白质分子量有所下降。故超高压能使肌动球蛋白发生聚集或断裂,进而影响蛋白质生化特性。本文通过超高压,研究肌动球蛋白在不同的压力以及不同保压的影响,以便为养殖大黄鱼的贮藏和加工中提供理论依据,降低了获取高质量凝胶的难度,更易得到优质的鱼糜制品。

