单核细胞增生李斯特氏菌标准物质冻干保存方法*
罗超 李妍 赵珂珂 李智玮 刘刚/上海市计量测试技术研究院
0 引言
随着生物技术的发展,涉及生物安全、食品安全等相关的微生物标准物质、微生物检测方法、有效分析测量手段和量值溯源技术俨然是一个重要课题。微生物检测过程由于受到个体差异影响,同时对于环境污染特别敏感,绝大多数情况对于同一样品无法复检,所以急需加提高微生物标准物质研制能力。通过使用具有明确量值、基体接近实际样品的微生物菌体标准物质,实现微生物检测结果质量控制,保证检测结果的准确性、公正性[1-3]。
单核细胞增生李斯特氏菌(Listeria monocytogenes)简称单增李斯特菌,是一种人畜共患病的病原菌。它能引起人畜的李氏菌的病,感染后主要表现为败血症、脑膜炎和单核细胞增多。它广泛存在于自然界中,食品中存在的单增李氏菌对人类的安全具有危险,该菌在4 ℃的环境中仍可生长繁殖,是冷藏食品中威胁人类健康的主要病原菌之一,因此,在食品卫生微生物检验中,必须加以重视[4,5]。
对单增李斯特活菌冻干过程中添加的保护剂种类和含量进行筛选研究,比较不同配方保护剂对活菌冻干后及长时间低温存放后存活率的影响,从而筛选出一种保护剂配方,为后续微生物标准物质研制提供实验基础。
1 实验部分
1.1 主要仪器与试剂
生物安全柜(美国Labconco公司);冷冻干燥机(美国Labconco公司);恒温培养箱(上海慧泰仪器制造有限公司);高压灭菌锅(上海申安医疗器械厂);Milli-Q纯水仪(美国默克公司);电子天平(美国Mettler Toled公司);超低温冰箱(美国thermo公司);拍打氏均质器(法国Interscience公司)。
单核细胞增生李斯特氏菌标准菌株(ATCC 菌株编号19115);李斯特氏菌显色培养基(北京陆桥技术有限责任公司);李氏菌增菌肉汤(LB1,LB2)(北京陆桥技术有限责任公司);胰酪胨大豆酵母浸膏琼脂(TSA-YE)(北京陆桥技术有限责任公司);磷酸盐缓冲液(北京陆桥技术有限责任公司);0.85%无菌生理盐水(北京陆桥技术有限责任公司);肉粉(上海市计量测试技术研究自制);脱脂牛奶(德运公司);聚乙烯吡咯烷酮(国药集团);酪氨酸(国药集团);蔗糖(国药集团)。
1.2 实验方法
1.2.1 菌种复活、鉴定与培养
将冷冻保存的标准菌株在血营养平板琼脂上划线复活,37 ℃培养18~24 h。从平板上挑取单个单增李斯特菌落接种到营养肉汤中,37 ℃,培养18~24 h,取菌液接种到 TSA-YE 培养基上,37 ℃至长出菌落后,进行革兰氏染色后在显微镜下观察,细菌排列呈短杆状,大小约为(0.4~0.5 μm)×(0.5~2.0 μm)。随机挑取菌落用VITEK全自动生化分析仪进行鉴定,挑取纯培养的单个菌落穿刺SIM动力培养基,30 ℃培养48 h,在SIM培养基上方呈伞状生长。挑取纯培养的单个菌落穿刺到血平板上,37 ℃培养48 h,溶血圈狭窄、清晰、明亮。综上实验结果,最终鉴定为单增李斯特菌。
1.2.2 不同保护剂的灭菌和复水方式考察
常用的灭菌方式有高压蒸汽灭菌、过滤灭菌、辐射灭菌[6]。其中高压蒸汽灭菌法是可杀灭包括芽胞在内的所有微生物的一种灭菌方法,是灭菌效果中最好的。适用于普通培养基、生理盐水、手术器械、玻璃容器及注射器、敷料等物品的灭菌;过滤灭菌法是用细菌不能通过致密具孔滤材的原理以除去气体或液体中微生物的方法,常用于气体、热不稳定的药品溶液或原料的除菌;辐射灭菌法是利用紫外辐射和电离辐射杀灭微生物,如杀灭空气中或物体表面的微生物,其特点是不升高产品温度,穿透力强,灭菌效率高,但设备费用较高,对操作人员存在潜在危险性,可能使某些药物(特别是溶液型)药效降低或产生毒性或发热物质等[7]。
本实验采用高压蒸汽灭菌(121 ℃,20 min和115 ℃,20 min)和过滤灭菌两种方法进行保护剂的灭菌方法考察。首先将各保护剂成分按照适当比例配制,然后分别进行高压蒸汽灭菌(蔗糖和脱脂牛奶因不耐高温需采用115 ℃灭菌,其余保护剂成分均采用121 ℃灭菌20 min的方式)和过滤灭菌(采用孔径为 0.45 μm 的滤膜)。
由于后期研制的标准物质将以菌粉加肉粉的混合粉末方式制备,所以需考察混合粉末的复水方法,针对9.9 g肉粉和0.1 g菌粉混合后的样品复水计数方式,具体设计了三种复水方法:
1)将样品加入 100 mL PBS 复水后直接使用平板涂布法进行计数;
2)将肉粉样品加入带滤网的均质袋,加入100 mL PBS复水,经过拍打式均质器拍打均匀后,取清液使用平板涂布法进行计数;
3)将样品加入100 mL PBS复水,然后将样品在磁力搅拌机上充分混匀,吸取上清液使用平板涂布法进行计数。
本实验将0.1 g纯菌粉使用平板涂布法进行计数的结果设为阳性对照。
1.2.3 冻干保护剂的筛选方法
由于不同比例的冻干保护剂,对样品的作用有很大的影响,因此,设计正交实验优化保护剂的具体成分。将脱脂牛奶、聚乙烯吡咯烷酮(PVP)、蔗糖、酪氨酸四种冻干保护剂设计为单因素试验,其水平设计见表1。选择L9(34)正交表安排实验,实验设计见表2。将新鲜培养的单增李斯特菌悬液,按适当的体积比添加到保护剂中混合均匀,用无菌移液器分装至冻干瓶中,在-80 ℃冰箱中预冻2 h以上后按照冻干程序冻干。然后将冻干好的细菌菌粉用拍打式均质器拍碎后混匀。随机抽取样品三次,每次0.1 g, 对冷冻干燥前后的活菌数进行测定,得出保护率(保护率/%=冷冻干燥后活菌数/冷冻干燥前活菌数×100)。独立重复实验A、B、C三次,以保护率为指标,记录检测结果。

表1 冻干保护剂单因素添加水平设计
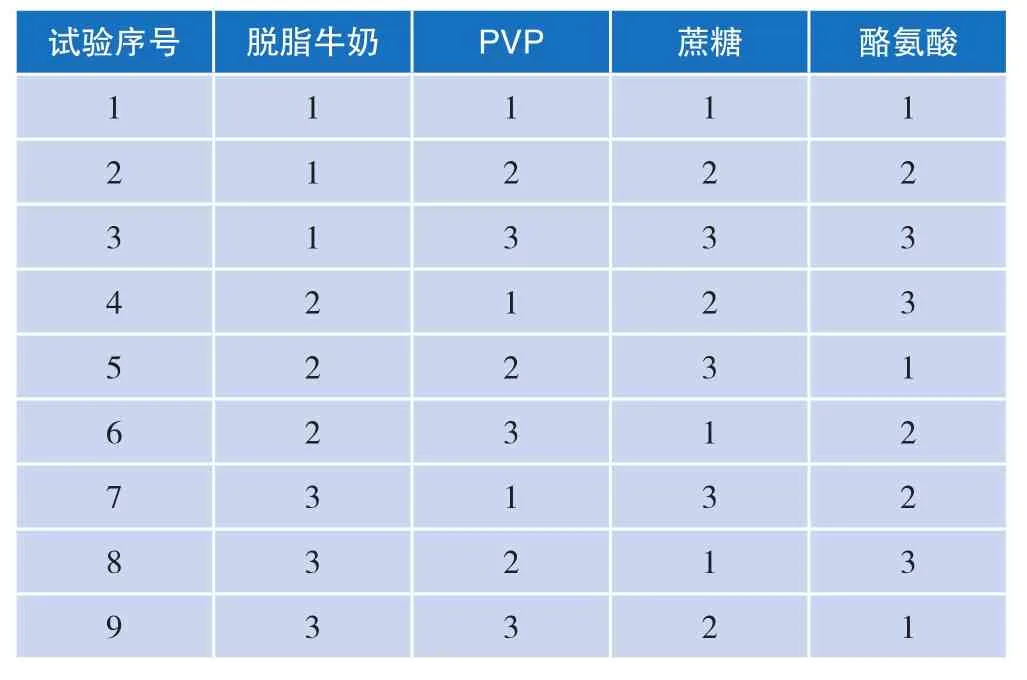
表2 L9(34)正交试验设计
1.2.4 样品制备方法
在冷冻干燥的过程中,温度降低和水分蒸发(冰晶体的形成)对菌种活性会造成很大的影响,为了提高菌种在冷冻干燥过程中的存活率,向菌液中加入保护剂是一种非常有效的方法,保护剂的种类较多,主要分四种类型:渗透型抗冻剂、非渗透型抗冻剂、抗氧化剂、胶体。研究表明,不同比例的保护剂,对样品的作用也有很大的影响[8]。
将新鲜培养的单核细胞增生李斯特菌悬液,按一定的体积比添加到保护剂中混合均匀,用无菌移液器分装至棕色西林瓶中,每瓶1 mL, 在-80 ℃冰箱中预冻8 h以上后,在0.015 mbar真空度下冷冻干燥36~48 h。然后将冻干好的标准物质压盖密封。随机抽取8瓶样品,对冷冻干燥前后的活菌数进行测定,得出存活率(存活率/%=冷冻干燥后活菌数/冷冻干燥前活菌数×100)。
2 实验结果
2.1 标准物质菌种的鉴定
随机挑取活化后接种到TSA-YE培养基的8个菌落进行VITEK全自动生化分析鉴定,结果表明标准物质菌种均为单增李斯特菌。
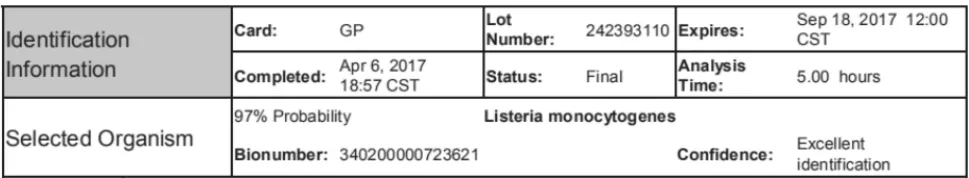
图1 样品的VITEK生化分析检测结果
2.2 不同保护剂的灭菌和复水方式考察
对采用高压蒸汽灭菌(121 ℃,20 min 和 115 ℃,20 min)和过滤灭菌两种方法进行保护剂的灭菌方法考察,结果发现过滤灭菌操作耗时长,且对于部分保护剂(酪氨酸)无法充分过滤,偶尔会有样品阻塞过滤孔的情况发生。因此,本实验中的保护剂优先选择高压蒸汽灭菌,其中蔗糖和脱脂牛奶因不耐高温需采用115 ℃ 灭菌20 min,其余保护剂成分均采用 121 ℃灭菌 20 min。
由于后续实验会将菌粉与肉粉混合配置标准物质样品,因此考察了不同复水方法对检测结果的影响,结果详见表3。可见方法二的检测结果与纯菌(阳性对照)的结果一致性较高,因此,优选方法二作为本标准物质候选物的复水方法,即将肉粉样品加入带滤网的均质袋,加入100 mL PBS 复水,经过拍打式均质器拍打均匀后,取清液使用平板涂布法进行计数。
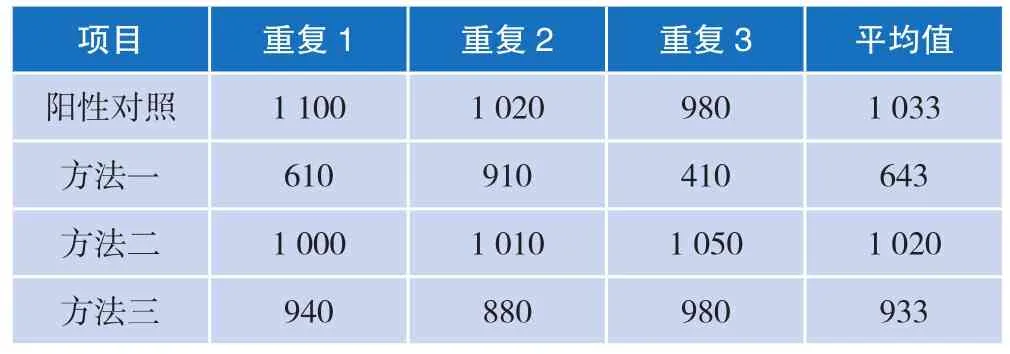
表3 不同复水方法的检测结果 单位:CFU/mL
2.3 不同冻干条件对细菌冻干存活率的影响
将冻干机的冷冻干燥程序按照表4设置,得到冻干曲线(图2)。在样品温度预冻阶段-10 ℃处的波动,说明样品的共晶点在-10 ℃。在升华阶段样品温度和隔板温度都逐渐上升,最终在解析阶段样品温度高于隔板温度,并趋于稳定,证明样品已充分冻干(冻干脱水率为90%以上)。为了缩短样品的冻干时间,将样品的预冻温度设为-80 ℃,在超低温冰箱中冻干2 h后再放入冻干机中进行冻干实验,冻干程序按照表4中的第2~5步进行。
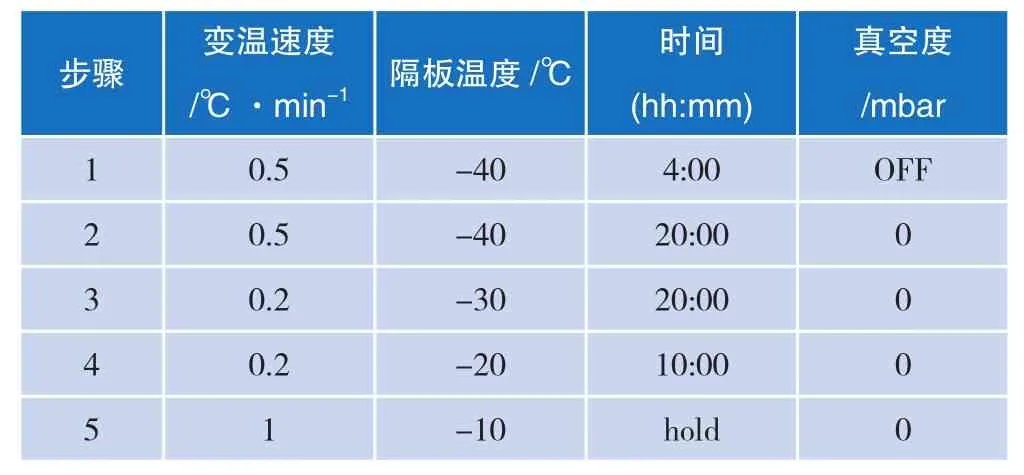
表4 冻干程序
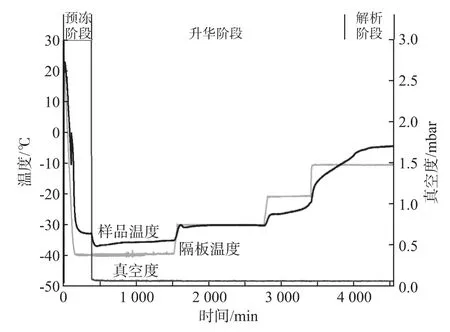
图2 冻干曲线
通过采用真空压盖和非真空压盖两种不同的压盖方式,考察不同的压盖方式对冻干样品在不同储存温度下稳定性的影响。根据图3结果可知,非真空压盖的样品在-80 ℃储存的前3 d其保护率急速下降,并在3 d至7 d内维持稳定;而经过真空压盖后的冻干样品不仅在-80 ℃储存7 d内保护率稳定,而且可以在4 ℃温度条件下稳定保存7 d。因此,经过真空压盖后的冻干样品可以满足生物样品冷链运输(加装冰袋)7 d内稳定的基本储存运输条件。
2.4 不同冻干保护剂对保护率的影响
实验前期初步确定保护剂为以下四种:脱脂牛奶、PVP (聚乙烯吡咯烷酮)、蔗糖 、酪氨酸 。按照保护剂正交实验设计L9(34)的细菌冻干保护率结果见表5,采用单因素方差分析统计结果见表6。因此,实验筛选出冻干保护率最高的保护剂配方为:50%脱脂牛奶,0.5%PVP,4%蔗糖,0.5%酪氨酸。
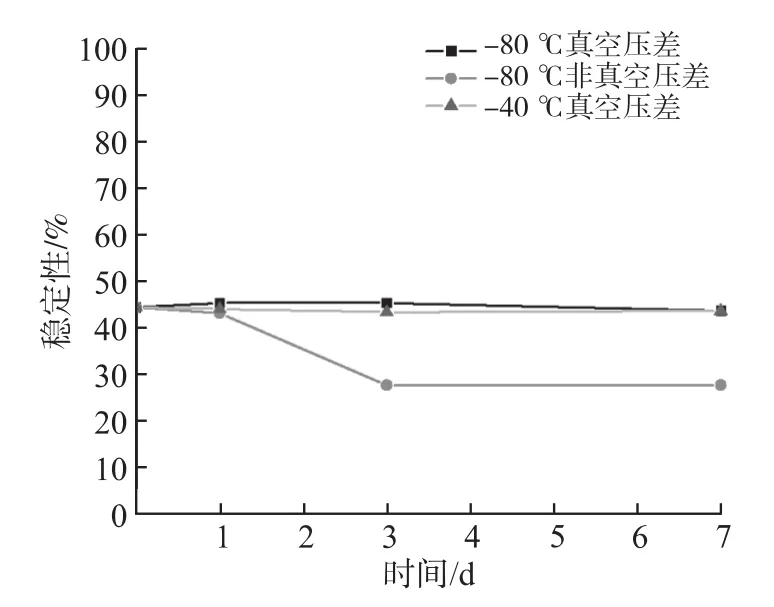
图3 不同的压盖方式的冻干样品在不同储存温度下的稳定性

表5 冻干保护率
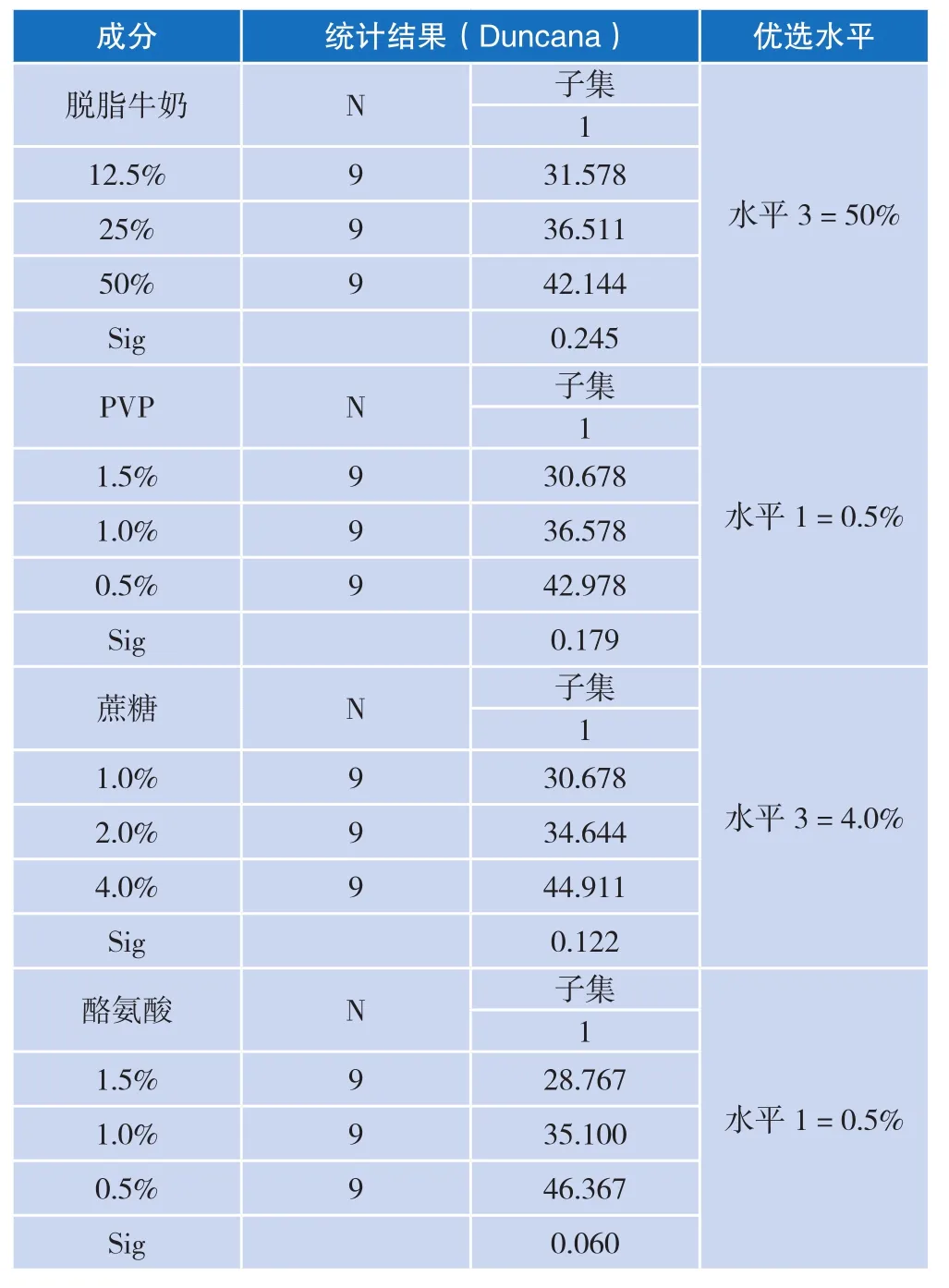
表6 冻干保护率单因素方差统计分析结果
2.5 不同菌体密度标准物质在保护剂保护下的长期储存情况
标准物质的稳定性,是其基本性质之一。稳定性是指在规定的储存环境下,在规定的时间周期内,标准物质的特性值保持在一定范围内的能力。
由于食品标准物质属于生物有机体,其稳定性通常较差,所以长期贮存条件选择在低温环境下,一般生物实验室常用的-20 ℃对标准物质进行长期的稳定性考察。按正交实验结果选择的最优保护剂成分和冷冻干燥条件进行低密度菌和高密度菌的冻干实验,冻干完成后进行拍打均质,获得均匀菌粉,等量分装低密度菌样品和高密度菌样品各50瓶。将样品置于温度设置为-20 ℃储箱储存,分别在不同时间各随机选取3瓶样品,采用单增李斯特平板计数法[4]测定低密度菌体和高密度菌体标准物质中的活菌数,以天为时间单位,监测第0、3、7、15、30 d标准物质中活菌的保护率变化情况。
根据标准物质在-20 ℃稳定性监测结果图(图4)可知,在-20 ℃保存条件下的两种菌体密度标准物质在30 d内活菌数目稳定,且高密度菌体标准物质的保护率持续维持在30% 以上。
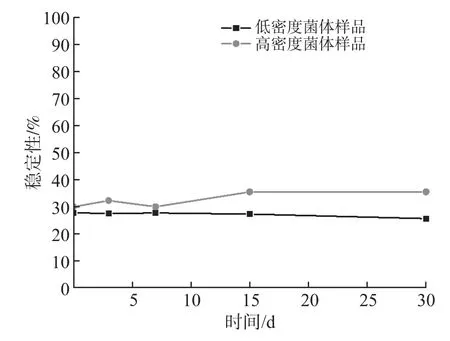
图4 单增李斯特菌稳定性监测趋势图
3 结语
本文通过研究各个保护剂的灭菌方式,及复水方式对平板计数方法的操作影响,设计正交试验,筛选出最优的保护剂含量水平组合。通过研究不同冻干条件和样品压盖方式,按照文中的冻干程序,并采用冻干样品真空压盖,可以保证细菌冻干后保护率在30%以上。还对不同菌体密度的样品储存环境进行考察,通过比较冻干菌粉的保护率发现,高密度菌体在-20 ℃储存30 d稳定。本项目制备的活菌在冷链运输(加冰袋)条件下7 d内稳定,满足标准物质的发放运输要求,满足实验室质控和方法验证的基本需求。本文的单核细胞增生李斯特菌标准物质研究结果将为其他微生物标准物质的冻干保护方法和稳定性研究提供理论指导。有助于保障量值统一,保证检测结果的有效性、可比性及国际国内互认度[9,10]。

