杜蛭丸灌胃对缺血性脑卒中大鼠的保护作用及其机制探讨
王瑞雪,张 敬,赵 珍,李春蕾,王志勇
(中国医药工业研究总院上海医药工业研究院 上海市生物物质成药性评价专业技术服务平台,上海 200437)
脑卒中是继冠心病和肿瘤之后居第3位的世界危险疾病,我国脑卒中死亡人数占世界脑卒中死亡人数的33%,是近年来导致我国城乡居民残疾和死亡的主要疾病之一[1]。临床上,缺血性脑卒中占全部脑卒中患者的60%~80%,是由于大脑部分区域缺血缺氧引起的级联反应,包括兴奋性氨基酸毒性、氧自由基和活性氧类的产生、炎症以及细胞凋亡等[2-3]。本病治疗的关键在于改善患者脑血循环通路和神经保护,但目前的治疗方案和用药疗效尚有进一步优化的空间[4]。有研究报道杜蛭丸对气虚血瘀型缺血性脑卒中具有显著的临床疗效,在降低大脑缺血状态下血管通透性的同时可提高脑组织耐缺氧功能,而且还具有抗血小板聚集和抗血栓形成的功效,从而有效改善脑部血液循环[5]。为进一步研究杜蛭丸对缺血性脑卒中的作用及其可能的机制,本研究拟通过线栓法诱导大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型,从神经行为评分、脑梗死百分率等方面评价杜蛭丸对MCAO模型大鼠的保护作用,期望能为临床应用杜蛭丸治疗缺血性脑卒中提供参考依据。
1 材料与方法
1.1实验材料
1.1.1实验动物 SPF级雄性SD大鼠共142只,体重250~280 g,购自上海斯莱克实验动物有限公司。实验动物生产许可证号:SCXK(沪)2012-2002,使用许可证号:SYXK(沪)2014-0018。
1.1.2药物与试剂 杜蛭丸(吉林敖东延边药业股份有限公司生产,批号:1603101;规格:每25粒重5 g)为黑色水蜜丸,组分:杜仲(制)、巴戟天、淫羊藿、黄芪、当归、水蛭、赤芍、益母草、地黄、白薇、石菖蒲及伸筋草;依诺肝素钠注射液购自赛诺菲(北京)制药有限公司(规格:0.6 mL∶6000AxalU,批号:5SJ78);2,3,5-三苯基氯化四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC,批号:20120315)和水合氯醛(批号:20101026)均购自上海国药集团化学试剂有限公司;腺苷二磷酸(adenosine diphosphate,ADP)购自美国Sigma公司(批号:SLBB1854V)。
1.1.3主要仪器 全自动血液流变仪(型号:LBY-N6 COMPACT)购自北京普利生仪器有限公司;血小板聚集仪(型号:560CA)购自美国CHRONO-LOG公司。
1.2试验分组及药物干预 将142只健康雄性SD大鼠随机分为以下7组:A组(正常对照组,n=16,给予等量氯化钠溶液灌胃)和B组[n=6,给予中剂量杜蛭丸溶液,1.0 g/(kg·d)灌胃]均每日1次,连续7 d,第8天予水合氯醛腹腔注射麻醉后,分别采集腹腔主动脉血各5 mL;C组、D组、E组和 F组各24只,依次分别给予等量氯化钠溶液、低剂量杜蛭丸溶液[0.5 g/(kg·d)]、中剂量杜蛭丸溶液[1.0 g/(kg·d)]、高剂量杜蛭丸溶液[2.0 g/(kg·d)]灌胃,均每日1次,连续7 d,第8天予水合氯醛腹腔注射麻醉后,采用线栓法建立大鼠MCAO模型,造模成功第24小时采集大鼠腹腔主动脉血各5 mL。G组(阳性对照组,n=24)第1~7天不予任何处理,自由喂食和饲养,第8天时在大鼠尾静脉注射依诺肝素钠(500 U/kg),10 min后给予水合氯醛腹腔注射麻醉,其他后续操作同C组、D组、E组和F组。以上灌胃药物均为100 g/mL。
1.3MCAO模型的制备 参考既往文献[6]对 C组、D组、E组、F组和G组(均n=24)大鼠施行MCAO造模手术,并进行缺血再灌注,改进方法如下:以12%的水合氯醛分别对大鼠进行腹腔注射麻醉(360 mg/kg)后,将大鼠取仰卧位并固定于手术台上,室温约25 ℃,切开大鼠右侧颈部皮肤,分离和结扎右侧颈总动脉、颈外动脉及其分支动脉,分离右侧颈总、颈内及颈外动脉,至鼓泡处可见其颅外分支翼腭动脉,从根部结扎该分支。在颈外动脉远端结扎备线和放置动脉夹,拉直颈外动脉后,在分叉处切口,插入直径为0.26 mm的尼龙线17~20 mm,栓线从颈外动脉进入经颈内至大脑中动脉起始端附近,阻断大脑中动脉供血区全部血流。扎紧备线,阻断血流90 min后,拔出栓线,使血流再灌注,结扎备线,缝合皮肤,将各组手术后大鼠分笼饲养。参照贾淑伟和夏青[7]研究中MCAO模型判定标准判定本研究中各组大鼠造模成功与否。
1.4检测指标和方法
1.4.1神经行为学评估及脑梗死面积测量 对C组(n=12)、D组(n=12)、E组(n=12)、F组(n=12)、G组(n=12)共60只施行MCAO造模手术的大鼠检测梗死面积及神经性为评分,待缺血再灌注24 h后,应用Longa评分法评估其神经行为学改变情况,评分标准[8]:0分为没有神经功能障碍;1分为提起大鼠尾巴时,其对侧前肢屈曲;2分为大鼠在地面行走时出现打转现象,静止时身体未见偏向对侧;3分为大鼠在地面行走时出现打转现象,静止时身体偏向对侧;4分为出现严重意识障碍;5分为大鼠死亡。评分完毕后剪断大鼠头颈部,取出脑组织,剔除小脑组织,将大脑组织均等分为5片,进行TTC染色后,应用数码相机拍照,Image J软件统计全部脑区面积和梗死区面积,脑梗死百分率(%)=脑梗死区面积(cm2)/全脑区面积(cm2)[9]。
1.4.2血小板聚集实验 包括体内实验和体外实验两部分。体外实验用A组5只正常大鼠制备血小板,杜蛭丸水溶液浓度依次为0.01、0.03、0.1、0.3及1.0 mg/mL,以0.9%氯化钠溶液作为空白对照组。血小板聚集率测定时,每组重复测定7次,最终统计以重复测定结果为准,体内外实验测定次数保持一致,测定方法参考文献[10]并略有改进,具体如下:血小板聚集仪中加入198 μL血小板及2 μL待测杜蛭丸溶液,连续搅拌并孵育5 min,再加入ADP,使其与处理后的待检血小板充分反应,并用血小板聚集仪记录加入ADP后的反应过程,即为血小板聚集率,并由此计算相应的血小板聚集抑制率。体内实验应用上述制备好的血小板,用A组5只大鼠制备含药血清,方法如下:4只大鼠分别给予杜蛭丸(0.5 g/kg,2只;2.0 g/kg,2只)灌胃1 h后,予以水合氯醛腹腔注射麻醉,经腹主动脉采血5 mL,以1 811×g离心15 min得上清,即为含药血清;1只大鼠给予等量氯化钠溶液作为空白对照组。血小板聚集抑制率(%)=[聚集率(溶剂组)-聚集率(实验组)]/聚集率(溶剂组)×100%[9]。
1.4.3血液黏度和凝血检测 对A组(n=6)、B组(n=6)及C、D、E、F、G各组剩余的12只施行MCAO造模手术的大鼠进行血液黏度和凝血检测。缺血再灌注24 h后在其腹主动脉采集血标本各5 mL 用于后续实验研究,其中取1 mL全血加肝素钠抗凝,应用全自动血液流变仪测定全血黏度、全血相对黏度及血细胞比容;同时取2 mL全血加3.2%枸橼酸钠抗凝,用于测定凝血酶原时间(prothrombin time,PT)、凝血酶时间(thrombin time,TT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)及纤维蛋白原(fibrinogen,FIB)。

2 结 果
2.1各组MCAO模型大鼠神经行为学评分和脑梗死百分率的比较 线栓法致大鼠局灶性脑缺血后,C组、D组、E组、F组、G组分别死亡5只、3只、3只、0只和6只,存活的43只大鼠均有明显的神经行为缺陷,表现为手术对侧前肢内收或屈曲,并向一侧旋转等,脑组织切片染色检查可见明显脑梗死病灶,见图1。本研究中有43只大鼠造模成功。术前1周对各组大鼠予以不同浓度杜蛭丸溶液进行灌胃,各组大鼠神经行为学评分和脑梗死百分率比较差异均有统计学意义(P<0.05),其中F组和G组大鼠神经行为学评分、脑梗死百分率低于C组(P<0.01);其余各组大鼠神经行为学评分和脑梗死百分率与C组比较差异均无统计学意义(均P>0.05)。见表1。
MCAO:大脑中动脉阻塞;C组:0.9%氯化钠溶液+MCAO组;D组:低剂量杜蛭丸溶液(0.5 g/kg)+MCAO组;E组:中剂量杜蛭丸溶液(1.0 g/kg)+MCAO组;F组:高剂量杜蛭丸溶液(2.0 g/kg)+MCAO组;G组:阳性对照(依诺肝素钠,500 U/kg)+MCAO组
图1 杜蛭丸对线栓法致大鼠局灶性脑缺血的影响(TTC染色)


组别只数神经行为学评分(分)梗死百分率(%)C组73.29±0.7620.51±7.79D组93.00±0.8719.19±10.76E组92.89±0.9319.07±11.89F组122.33±0.49a12.23±6.09aG组62.17±0.41a6.95±3.41aF值3.2763.215P值0.0210.023
MCAO:大脑中动脉阻塞;C组:氯化钠溶液+MCAO组;D组:低剂量杜蛭丸溶液+MCAO组;E组:中剂量杜蛭丸溶液+MCAO组;F组:高剂量杜蛭丸溶液+MCAO组;G组:阳性对照+MCAO组;a与C组比较,P<0.05
2.2各组MCAO模型大鼠血小板聚集情况的比较 体外实验时,血小板同ADP在不同浓度的杜蛭丸水溶液(0.1 mg/mL,0.3 mg/mL和1.0 mg/mL)中充分反应时,随着杜蛭丸溶液浓度的逐渐升高,血小板聚集率逐渐下降(均P<0.01),见表2。体内含药血清实验结果显示,空白对照组、0.5 g/kg杜蛭丸和2.0 g/kg杜蛭丸组血小板聚集率分别为(28.6±4.6)%、(29.0±4.9)%、(21.9±5.1)%,各组比较差异有统计学意义(F=4.516,P=0.028),其中2.0 g/kg 杜蛭丸组血小板聚集率低于空白对照组和0.5 g/kg杜蛭丸(均P<0.05)。
2.3各组MCAO模型大鼠血细胞比容改变情况的比较 MCAO模型大鼠缺血再灌注24 h后,A组、B组、C组、D组、E组、F组、G组分别死亡0只、1只、2只、2只、2只、3只和3只,最终有59只大鼠存活。各组MCAO模型大鼠血细胞比容比较差异有统计学意义(P<0.01),其中C组大鼠血细胞比容明显高于A组(P<0.01),G组、F组大鼠血细胞比容明显低于C组(P<0.01)。G组与F组大鼠血细胞比容比较差异无统计学意义(P>0.05)。见表3。
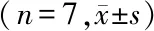

组别血小板聚集率(%)空白对照组100.0±7.1 0.01 mg/mL93.2±11.3 0.03 mg/mL96.7±9.4杜蛭丸组 0.10 mg/mL73.3±12.9a 0.30 mg/mL72.5±10.9a 1.00 mg/mL40.6±9.1a F值31.642 P值<0.001
MCAO:大脑中动脉阻塞;a与空白对照组比较,P<0.01


组别只数血细胞比容A组60.346±0.007B组50.357±0.018C组100.435±0.042aD组100.408±0.050E组100.422±0.029F组90.389±0.037bG组90.386±0.032bF值5.870P值<0.001
MCAO:大脑中动脉阻塞;A组:氯化钠溶液+正常大鼠组;B组:中剂量杜蛭丸溶液+正常大鼠组;C组:氯化钠溶液+MCAO组;D组:低剂量杜蛭丸溶液+MCAO组;E:中剂量杜蛭丸溶液+MCAO组;F:高剂量杜蛭丸溶液+MCAO组;G:阳性对照+MCAO组;a与A组比较,P<0.01;b与C组比较,P<0.01
2.4各组MCAO大鼠血液黏度与凝血情况的比较 各组大鼠低切全血黏度比较差异有统计学意义(P<0.05),其中B组低于A组(P<0.05),C组高于A组(P<0.05),缺血再灌注24 h后,G组和 D组血液黏度均较C组明显降低(均P<0.05);各组大鼠高切全血黏度比较差异有统计学意义(P<0.05),B组低于A组,C组高于A组(P<0.05),G组低于C组(P<0.05);各组大鼠低切全血相对黏度比较差异有统计学意义(P<0.05),其中D组、E组和G组低于C组(P<0.05);各组大鼠高切全血相对黏度比较差异无统计学意义(P>0.05)。见表4。各组大鼠APTT、PT水平比较差异无统计学意义(均P>0.05);各组大鼠TT、FIB水平比较差异有统计学意义(均P<0.01),其中B组和C组TT、FIB水平高于A组(P<0.05)。见表5。
3 讨 论
缺血性脑卒中的高发病率、高致残率、高死亡率严重影响人们的正常生活。目前有多种中药复方研究用于治疗缺血性脑卒中,但基于中药的多种化学成分、多个作用靶点、多条作用通路使其在治疗应用的特异性上有一定的局限性。为探究杜蛭丸对缺血性脑卒中大鼠的作用,本研究事先予大鼠以低(0.5 g/kg)、中(1.0 g/kg)、高(2.0 g/kg)剂量杜蛭丸药液灌胃7 d,发现MCAO模型大鼠手术后24 h,给予高剂量杜蛭丸溶液灌胃+MCAO模型大鼠脑梗死面积比其他组大鼠明显减少,而且神经行为缺陷改善明显,提示杜蛭丸发挥神经保护和治疗缺血再灌注损伤作用的最佳剂量为2.0 g/kg。
目前已知异常血小板激活在脑卒中的发病机制中起关键作用,在脑缺血时,血小板功能亢进,血液处于高凝状态[11]。本研究结果显示在体内含药血清实验中,高剂量杜蛭丸溶液组大鼠血小板聚集率明显降低,而聚集抑制率明显增加,提示该组大鼠具有良好的抑制血小板聚集能力,而且体外实验结果与此相同。血液流变学异常改变与缺血性脑卒中有关。血液黏度升高时易形成血栓,阻碍血液循环,导致组织供血供氧不足。脑缺血后,血液黏度显著升高,血细胞比容是影响血液黏度的重要因素,血液黏度会随血细胞比容升高而增高,故血细胞比容增高提示红细胞变形能力变低,且聚集能力升高,这可能导致血液黏滞性增加和流动性降低。陆春燕[12]对≤

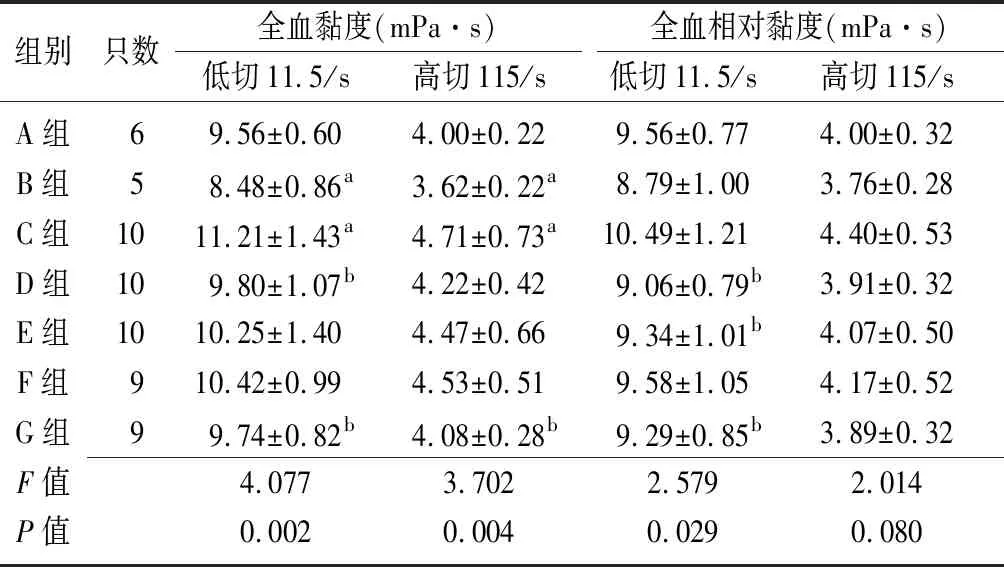
组别只数全血黏度(mPa·s)低切11.5/s高切115/s全血相对黏度(mPa·s)低切11.5/s高切115/sA组69.56±0.604.00±0.229.56±0.774.00±0.32B组58.48±0.86a3.62±0.22a8.79±1.003.76±0.28C组1011.21±1.43a4.71±0.73a10.49±1.214.40±0.53D组109.80±1.07b4.22±0.429.06±0.79b3.91±0.32E组1010.25±1.404.47±0.669.34±1.01b4.07±0.50F组910.42±0.994.53±0.519.58±1.054.17±0.52G组99.74±0.82b4.08±0.28b9.29±0.85b3.89±0.32F值4.0773.7022.5792.014P值0.0020.0040.0290.080
MCAO:大脑中动脉阻塞;A组:氯化钠溶液+正常大鼠组;B组:中剂量杜蛭丸溶液+正常大鼠组;C组:氯化钠溶液+MCAO组;D组:低剂量杜蛭丸溶液+MCAO组;E:中剂量杜蛭丸溶液+MCAO组;F:高剂量杜蛭丸溶液+MCAO组;G:阳性对照+MCAO组;a与A组比较,P<0.05;b与C组比较,P<0.05

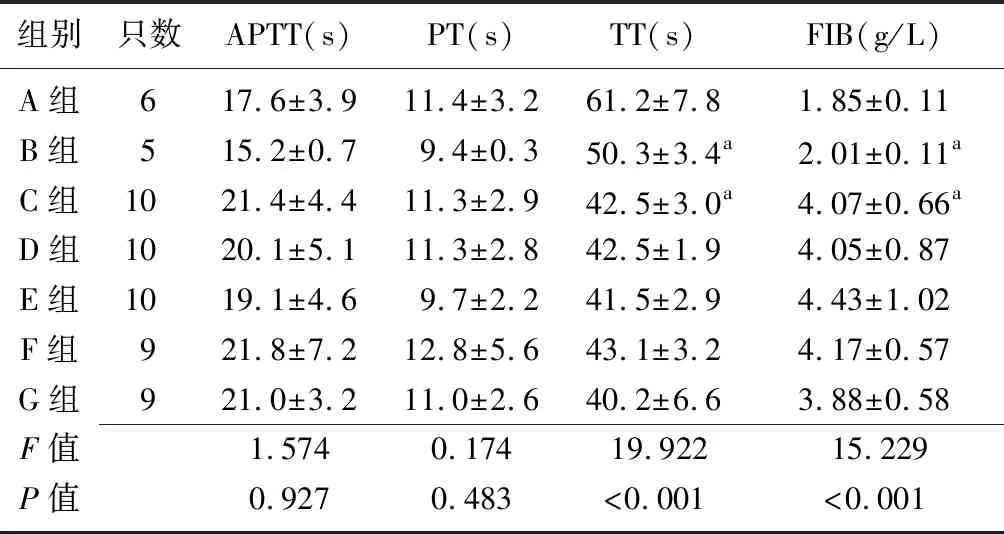
组别只数APTT(s)PT(s)TT(s)FIB(g/L)A组617.6±3.911.4±3.261.2±7.81.85±0.11B组515.2±0.79.4±0.350.3±3.4a2.01±0.11aC组1021.4±4.411.3±2.942.5±3.0a4.07±0.66aD组1020.1±5.111.3±2.842.5±1.94.05±0.87E组1019.1±4.69.7±2.241.5±2.94.43±1.02F组921.8±7.212.8±5.643.1±3.24.17±0.57G组921.0±3.211.0±2.640.2±6.63.88±0.58F值1.5740.17419.92215.229P值0.9270.483<0.001<0.001
MCAO:大脑中动脉阻塞;PT:凝血酶原时间;TT:凝血酶时间;APTT:活化部分凝血活酶时间;FIB:纤维蛋白原;A组:氯化钠溶液+正常大鼠组;B组:中剂量杜蛭丸溶液+正常大鼠组;C组:氯化钠溶液+MCAO组;D组:低剂量杜蛭丸溶液+MCAO组;E:中剂量杜蛭丸溶液+MCAO组;F:高剂量杜蛭丸溶液+MCAO组;G:阳性对照+MCAO组;a与A组比较,P<0.05
125例缺血性脑卒中患者和125名健康人进行研究发现,脑缺血患者的全血黏度、全血高切黏度、全血低切黏度水平均高于健康人。由此可见,罹患缺血性脑卒中的患者血液流变学指标会明显升高。本研究结果与既往研究结果[12]相一致。本研究结果显示,在给予大鼠高剂量杜蛭丸溶液后,血细胞比容与C组的差异有统计学意义,但与G组比较差异无统计学意义,表明高剂量杜蛭丸治疗可降低大鼠血细胞比容,保护红细胞数量及形态,其作用强度与 G组应用的依诺肝素钠相近。本研究中F组和 G组大鼠血细胞比容和血液黏度的差异均无统计学意义,提示杜蛭丸与依诺肝素钠治疗缺血性脑卒中大鼠的疗效相当,但是前者口服给药,方法便捷。另外,各组大鼠APTT、PT水平比较差异无统计学意义;各组大鼠TT、FIB水平比较差异有统计学意义(均P<0.01),其中B组和C组TT、FIB水平高于A组(P<0.05),说明杜蛭丸对缺血性脑卒中具有保护作用,这可能与其降低血细胞比容及抑制血小板聚集有关。
目前,治疗缺血性脑卒中重在改善脑血循环和神经保护,中医称前者为活血化瘀[13]。杜蛭丸主要成分为杜仲(制)、巴戟天、淫羊藿、黄芪、当归、水蛭、赤芍、益母草、地黄、白薇、石菖蒲、伸筋草,其中杜仲、巴戟天、淫羊藿、黄芪具有补中益精和强筋骨之效;当归可补血活血;水蛭、赤芍、白薇、益母草和地黄可活血祛瘀;石菖蒲和伸筋草可舒经活络[14]。现代药理学的研究认为杜仲、巴戟天、淫羊藿、黄芪等具有补中益精气功效,可清除氧自由基,具有降低红细胞过氧化物含量和提高细胞超氧化物歧化酶活性的作用[15-18];水蛭中所含水蛭素是迄今为止发现的最强的凝血酶天然特异抑制剂,具有高效抗凝作用[19];益母草、赤芍和当归均能通过抑制血小板聚集[20-22],降低血液黏度,从而抑制血栓形成。此外,石菖蒲能抑制缺血再灌注大鼠细胞凋亡;地黄能够促进血细胞增殖[23];白薇和伸筋草有抗炎作用[24-25]。本研究中,杜蛭丸能够发挥对缺血性脑卒中的保护作用,可能与杜仲、巴戟天、淫羊藿、黄芪的抗氧化应激作用有关[15-18]。同时,益母草、赤芍和当归抑制血小板聚集,从而具有抑制血栓形成作用。
综上所述,高剂量杜蛭丸溶液对缺血性脑卒中具有保护作用,这为临床治疗缺血性脑卒中提供了选择应用参考,但其作用机制尚未明确,可能涉及抗氧化应激及抗血栓形成等方面,还需进一步论证。

