具核梭杆菌感染对结肠癌转化生长因子-β1表达及肿瘤浸润淋巴细胞的影响
卫利民 谷变利 原翔
河南科技大学第一附属医院(开元院区)1甲状腺乳腺肿瘤外科,2肿瘤表观遗传学重点实验室(河南洛阳 471003)
结肠癌是造成肿瘤死亡的主要原因之一,近年来在中国的发病率逐年上升[1]。结肠癌的发生发展受饮食、环境和微生物暴露以及宿主免疫等的影响[2]。研究[3-4]表明具核梭杆菌(Fusobacterium nucleatum,Fn)与结肠癌的发生发展密切相关,是结肠癌发生的重要危险因素。作为消化道菌群中的桥梁微生物,Fn感染造成结肠病变加剧直至结肠癌发生发展的重要机制可能是对肠道上皮细胞有促炎症作用,并诱导或招募免疫抑制淋巴细胞,从而造成肿瘤细胞以及病原菌本身逃避免疫监视,促进肿瘤发生发展[5-6]。
转化生长因子β1(transforming growth factor-β1,TGF-β1)是肿瘤微环境重要的炎症因子。肿瘤来源的TGF-β1与肿瘤免疫逃逸相关[7]。TGF-β1的表达受病原微生物感染影响而上调,过量表达的TGF-β1能诱导FoxP3转录因子表达,促进初始T细胞分化为调节性T细胞(regulatory T cell,Treg)[8-10]。CD4+CD25+Treg的功能维持依赖 FoxP3的表达。FoxP3蛋白水平在抗原刺激后上调,且上调幅度与其抑制功能呈正相关。研究表明幽门螺杆菌(Helicobacter pylori,Hp)可诱导胃上皮细胞产生TGF-β1,促使初始CD4+T 细胞分化为Tregs,这些Tregs细胞抑制激活的CD4+效应T细胞增殖[11-12]。这种免疫抑制作用与Fn潜在的免疫抑制作用可能相似。研究[13]显示,感染Fn的肿瘤组织中Fn的载量与T淋巴细胞数量呈负相关。因此,笔者假设,Fn通过上调结肠癌细胞TGF-β1表达,促进Tregs分化,抑制T细胞的活性。本研究拟通过Fn感染引起结肠癌细胞TGF-β1表达变化和对肿瘤浸润淋巴细胞的影响,对Fn感染引起结肠癌免疫抑制机制进行探讨。
1 材料与方法
1.1 病例选择和样本采集选择2016年7月1日至9月30日在河南科技大学第一附属医院开元院区胃肠外科行手术治疗的结肠癌患者。纳入标准:术前未接受放化疗者以及无其他部位肿瘤发生,病理检查确定为结肠腺癌。排除标准:不符合纳入标准者均排除。最终纳入结肠腺癌病例36例,病例信息为:男22例,女14例;年龄37~75岁(中位年龄61岁);淋巴结转移阴性17例,阳性19例;临床TNM分期Ⅰ、Ⅱ期16例,Ⅲ~Ⅳ期20例;左半结肠15例,右半结肠9例,乙状结肠12例。新鲜结肠癌组织取自癌灶中心,癌旁组织取自距离癌组织近端边缘10 cm以上的正常肠粘膜组织。手术标本在离体后15 min内收集,冻存于液氮运送,-80℃低温保存至核酸抽提。
1.2 荧光定量PCR结肠癌组织和癌旁组织、结肠癌细胞系和T淋巴细胞总RNA采用Trizol总RNA提取试剂盒(Invitrogen公司)提取,-80℃保存。RNA浓度和完整性经紫外分光光度计和1%琼脂糖凝胶电泳检测。按照HiScript II 1st Strand cDNA Sythesis Kit(南京,诺唯赞公司)说明进行反转录合成cDNA,-20℃保存。以cDNA为模板,特异引物(由苏州金唯智合成)进行PCR扩增,β-actin为内参。β-actin:上游:5′-TGGCACCCAGCACAATGAA-3′,下游:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′;Fn:上游:5′-CTTAGGAATGAGACAGAGATG,下 游 :5′-TGATGGTAACATACGAAAGG;TGF-β1:上游:5′-CGACTCGCCAGAGTGGTTAT,下游:5′-GCTAAGGCGAAAGCCCTCAA;FoxP3:上游:5′-ATGCCTCCTCTTCTTCCTTGAA,下游:5′-GGGCATCCACCGTTGAGA。cDNA扩增体系及扩增条件,按照AceQ qPCR SYBR Green Master Mix试剂盒(南京,诺唯赞)说明书中进行,熔解曲线评估是否存在非特异扩增。反应在BioRad CFX96仪器上进行,每组设置3复孔,采用2-ΔΔCt法计算 Fn及各个基因的相对表达。
1.3 免疫组织化学染色及结果判定按照SP染色步骤(SP-9000及DAB染色试剂购自福建迈新)进行癌组织 TGF-β1(ab92486,Abcam 公司)和FoxP3(ab20034,Abcam公司)免疫组化染色,PBS替代一抗作阴性对照,以商品化的阳性片为阳性对照。根据阳性细胞百分比和染色强度计算评分:阳性细胞百分数:≤5%计分0、6%~25%计分1、26%~50%计分2、51%~75%计分3、≥75%计分4;着色强度:无着色计分0,浅黄色计分1,棕黄色计分2,褐色计分3;两项指标积分相加为阳性等级:0分为(-)、1~2分为(+)、3~4分为(++)、5~7分为(+++),“++”及以上判断为阳性。
1.4 细胞和细菌培养人结肠癌细胞系SW480、HT29、HCT116和具核梭杆菌ATCC 25586标准菌株由路易斯维尔大学医学院王会智教授惠赠。SW480、HT29、HCT116细胞分别用含10%胎牛血清(FBS)的DMEM或PRMI 1640完全培养基(Gibco公司),放置5%CO2、饱和湿度、37℃细胞培养箱培养。Fn标准菌株ATCC 25586接种于新鲜配制的脑心浸液培养基(梅里埃公司)(含5%无菌脱纤维绵羊血,1%氯化血红素和0.1%维生素K1),37℃厌氧(5%CO2、10%H2、85%N2)条件下培养。液体增菌后,细菌重悬计数,以100∶1比例(Fn:细胞株)加入培养至对数生长后期的细菌,37℃、5%CO2孵育24 h。共培养方法及分组:处于对数生长期的结肠癌细胞用0.25%胰蛋白酶(Solarbio公司)消化后计数,加至48孔板中与CD4+T细胞共培养。实验分组为:对照组(加入PBS)、Fn感染组和Fn感染中和组(加入人源TGF-β1中和抗体,R&D公司)。
1.5 ELISA检测TGF-β1将共培养的培养液吸出至EP管内,常温下10 000 r/min离心5 min,取上清,ELISA法测定TGF-β1含量。实验过程按照Human TGF-β1 ELISA检测试剂盒(EH010-48,Ex-Cell Bio公司)说明书进行,用酶标仪(PerkinElmer EnSpire多功能酶标仪)在450 nm波长测定光密度(OD值),根据绘制的标准曲线计算TGF-β1含量(ng/mL),换算成pg/mL作图。
1.6 初始CD4+T细胞分离及与HCT116共培养外周血淋巴细胞分离液购自GE公司,T细胞活化磁珠、CD4+T细胞磁珠分选试剂盒、Treg检测试剂盒购自德国美天旎生物技术公司。采集Fn感染阴性的健康志愿者全血20mL,外周血淋巴细胞分离制备,阴性磁珠分选法分离初始CD4+T细胞。Fn感染HCT116的上清经过滤,去除残留细菌,制成Fn-条件培养基(Fn-CM);HCT116细胞在与CD4+T细胞共培养前,用PBS洗两次,去除表面结合的细菌。TGF-β1中和抗体在加入CD4+T细胞前先加进Fn-CM体系中(取5 μL抗体至5 mL Fn-CM中,使抗体工作浓度为1 μg/mL),作用30 min。共培养体系中,每孔初始CD4+T细胞:HCT116比例为10∶1,37 ℃,5%CO2条件下培养5 d做增殖检测,培养7 d做Treg检测。
1.7 羧基荧光素二醋酸盐琥珀酰亚胺酯(CFSE)检测细胞增殖新鲜分离的CD4+T细胞按照CFSE Division Assay Kit(Abnova公司)说明书进行操作,采用抗CD3和抗CD28抗体双激活方法活化CD4+T细胞。具体:细胞激活培养使用24孔培养板(用2 μg/mL CD3单克隆抗体包被),每孔加入1×106个细胞和溶解的2 μg/mL CD28单克隆刺激性抗体,同时加入2 ng/mL的人重组IL-2维持细胞生长。激活3 d的T细胞加入至HCT116培养体系中5 d,收集CD4+T细胞,流式细胞仪分析增殖。未活化的细胞用作对照。
1.8 流式细胞术(1)CD4+T细胞纯度测定。新鲜分离的初始CD4+T细胞,经抗人CD4-FITC抗体(eBioscience公司)标记,流式细胞仪检测纯度;(2)Treg实验。CD4+T细胞与HCT116体系共培养7 d。7 d后,收获细胞,洗涤,加入抗人CD25-FITC抗体(eBioscience公司)4℃下孵育1 h。再洗涤,根据FoxP3固定和透膜试剂盒(eBioscience公司)操作说明加入透膜试剂,然后加入鼠抗人FoxP3-PE偶联的抗体,4℃孵育1 h。在Moflo XDP(Beckman)流式细胞分选仪上检测,Summit 5软件分析。
1.9 统计学方法采用SPSS 19.0软件进行数据分析。计量资料用(±s)表示。各组间比较采用单因素方差分析、独立样本t检验,表达率的比较及相关性分析采用Fisher确切概率法,检验水准α=0.05,以P<0.05为差异有统计学意义
2 结果
2.1 具核梭杆菌在结肠癌组织和癌旁组织中的表达丰度qPCR结果显示,69.44%(25/36)结肠癌组织和63.89%(23/36)癌旁组织中检测到Fn表达。在Fn表达阳性病例,Fn表达丰度在癌组织中较高,与癌旁组织比较差异有统计学意义(t=3.079,P=0.004)(图1)。
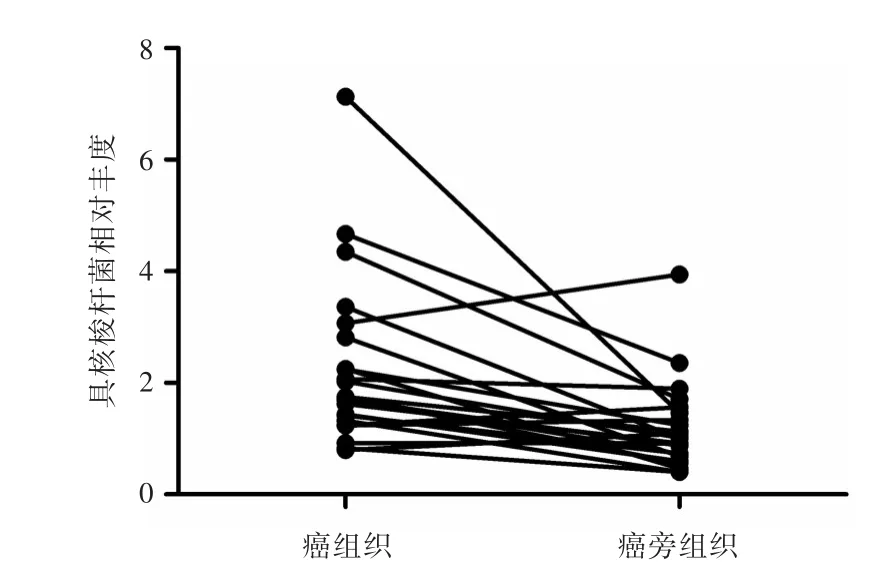
图1 Fn在结肠癌及癌旁组织中的表达丰度Fig.1 The mRNA expression abundance of Fusobacterium nucleatum in colon cancer and matched adjacent tissues
2.2 结肠癌组织TGF-β1表达和FoxP3+Treg细胞数量及其相关性IHC结果显示,TGF-β1表达于癌细胞和正常上皮细胞胞浆,FoxP3定位于淋巴细胞胞核(图2)。TGF-β1在Fn感染组织中的阳性表达率为80.00%(20/25),高于无感染组45.45%(5/11),但差异无统计学意义(表1)。Fn感染结肠癌组织中FoxP3+Treg细胞的阳性表达率60%(15/25),高于无感染组27.27%(3/11),但差异无统计学意义(表2)。而Fn感染阳性组,结肠癌组织中FoxP3表达与TGF-β1的表达呈显著正相关(χ2=9.375,P=0.005,表3)。
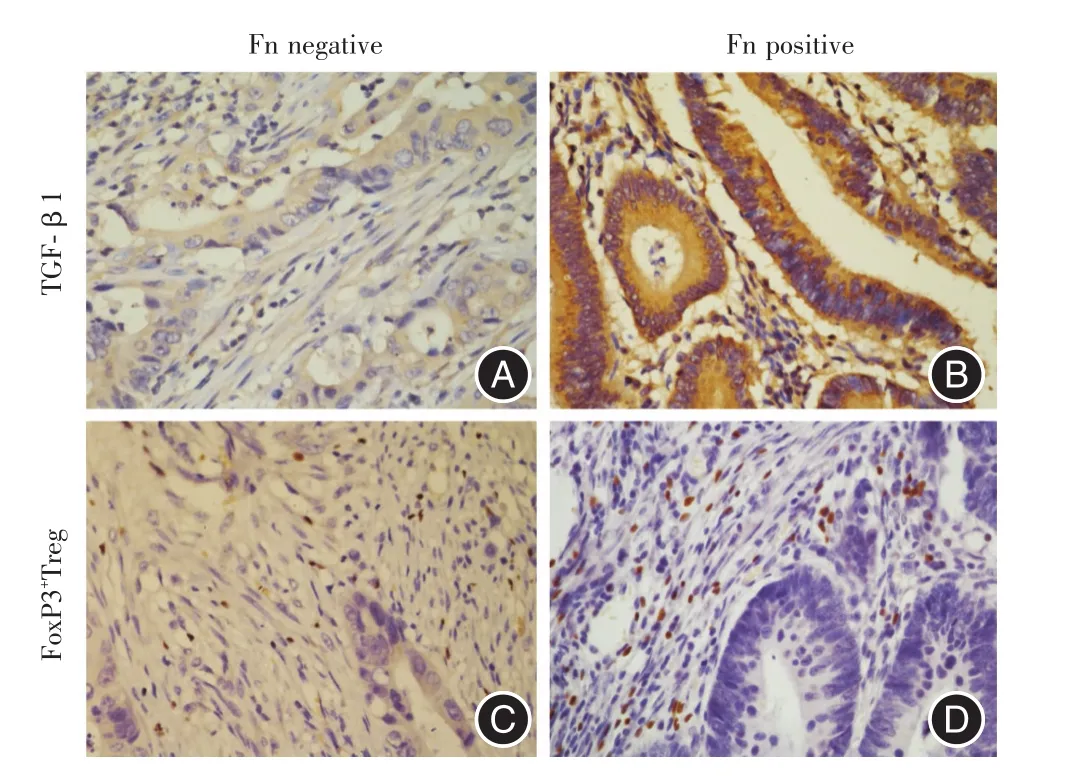
图2 结肠癌组织中TGF-β1的表达和FoxP3+Treg细胞分布Fig.2 Expression of TGF-β1 and distribution of FoxP3+Treg cells in colon cancer tissues

表1 结肠癌组织中TGF-β1表达与Fn感染的相关性Tab.1 The correlation between TGF-β1 expression and Fusobacterium nucleatum infection in colon cancer tissues例

表2 结肠癌组织中FoxP3表达与Fn感染的相关性Tab.2 The correlation between FoxP3 expression and Fusobacterium nucleatum infection in colon cancer tissues例
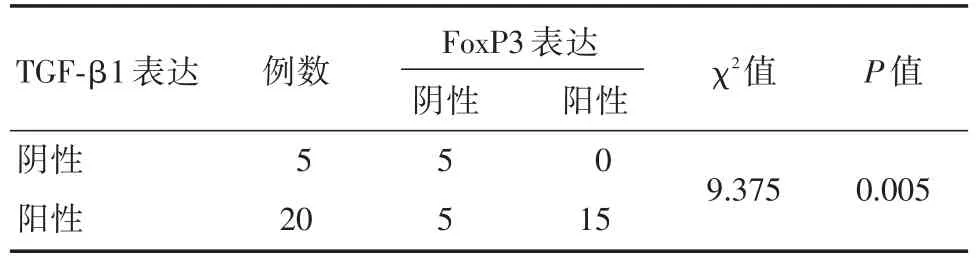
表3 Fn感染阳性结肠癌组织中FoxP3与TGF-β1表达的相关性Tab.3 The correlation between FoxP3 and TGF-β1 expression in Fusobacterium nucleatum-positive colon cancer tissue例
2.3 Fn感染对结肠癌细胞株TGF-β1表达的影响Fn以100:1比例(Fn:细胞)感染SW480、HT29、HCT116细胞。ELISA检测感染的3个细胞系TGF-β1增加分别是对照组的2.905、3.411、6.304倍;qPCR检测感染16 h结果显示,TGF-β1 mRNA相对表达量增加,分别是对照组的1.546±0.080(t=10.531,P=0.009)、1.325 ± 0.064(t=7.163,P=0.019)、1.817 ± 0.234(t=11.720,P=0.007)倍(图3)。由于HCT116变化较为显著,本研究选择HCT116细胞进行后续研究。

图3 Fn感染对肿瘤细胞TGF-β1表达的上调作用Fig.3 Effect of Fusobacterium nucleatum infection on expression of TGF-β1 in tumor cells
2.4 Fn感染的HCT116细胞对CD4+T细胞增殖的影响CD4+T细胞增殖经CFSE标记后流式细胞仪检测,休眠CD4+T细胞的荧光强度与未增殖细胞相同(图4A),活化的CD4+T细胞与未感染的HCT116细胞共培养增殖传代(图4B),以及活化的CD4+T细胞与Fn感染的HCT116细胞共培养后(图4C),结果显示CD4+T细胞增殖百分比与对照组相比减少将近28%[(59.69±1.28)%vs.(87.11±1.50)%],差异具有统计学意义(t=25.540,P=0.002);加入抗TGF-β1的中和抗体后(图4D),CD4+T细胞增殖比例与感染组相比有所升高[(72.71± 1.12)%vs.(59.69± 1.28)%],差异具有统计学意义(t=10.840,P=0.008)。

图4 Fn感染HCT116细胞产生的TGF-β1抑制活化的CD4+T细胞增殖Fig.4 The TGF-β1 produced by HCT116 cells in the conditions of Fusobacterium nucleatum infection inhibits the proliferation of activated CD4+T cells
2.5 Fn感染的HCT116细胞对CD4+CD25+FoxP3+Treg的影响流式细胞检测结果显示,Fn感染的共培养组,CD4+CD25+FoxP3+Treg细胞比例增加,达到(7.41±0.01)%,与对照组 Treg的(2.12±0.01)%相比,上调将近4倍,差异具有统计学意义(t=5.387,P=0.033)。Fn感染的共培养组加入TGF-β1中和抗体后,Treg细胞数量下降将近50%(4.16±0.01)%,差异无统计学意义(t=3.504,P=0.073,图5)。qPCR检测T细胞FoxP3 mRNA相对表达结果为对照组(1.100±0.009)、感染共培养组(3.853±0.074)、加入中和抗体组(2.322±0.049),感染共培养组与对照组相比FoxP3 mRNA表达上调(t=37.190,P<0.001),加入中和抗体组,FoxP3 mRNA表达与感染共培养组相比有所下降(t=17.380,P< 0.001,图5)。
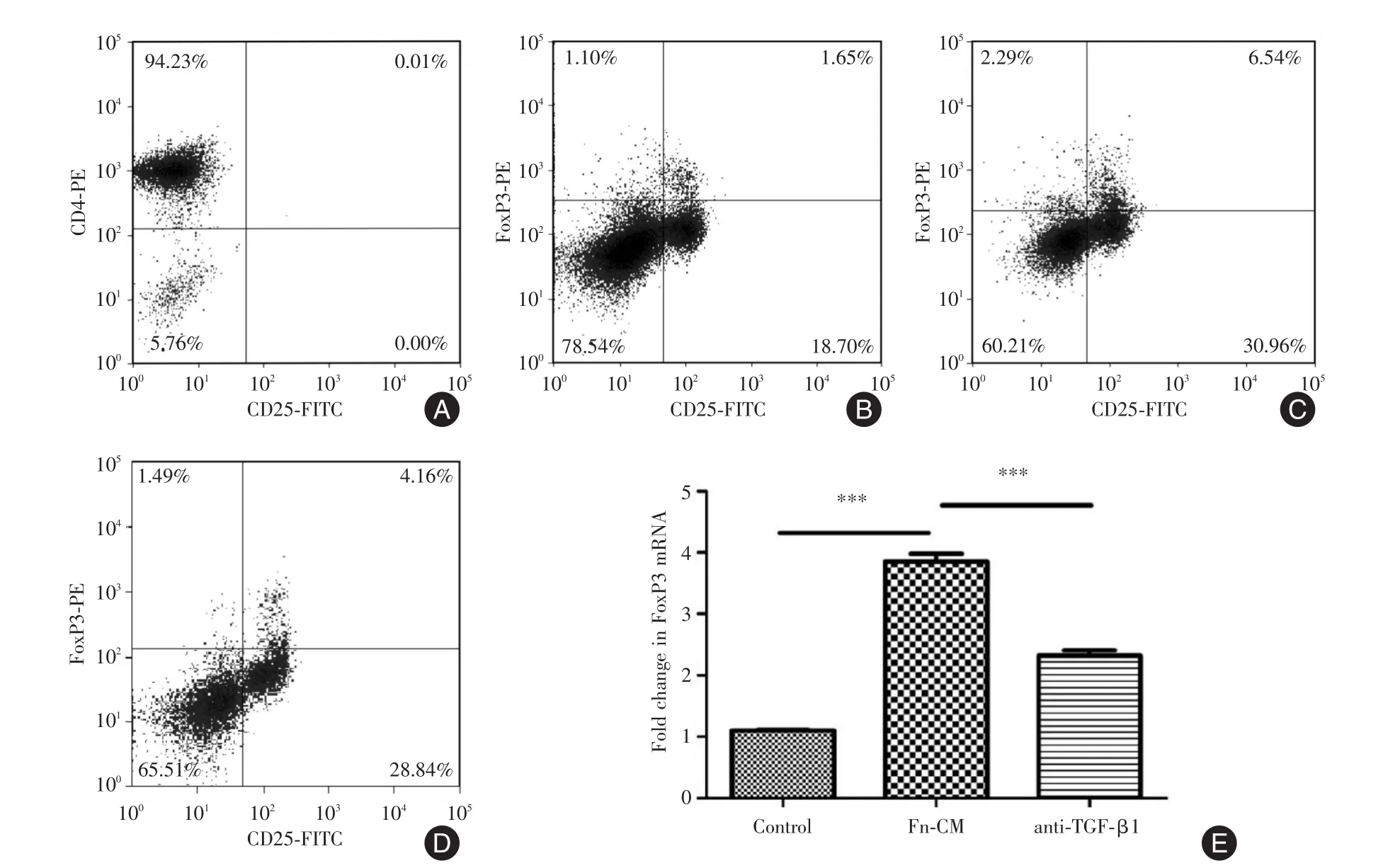
图5 Fn感染结肠癌细胞产生的TGF-β1促进休眠期初始CD4+T细胞发育为FoxP3+Tregs细胞Fig.5 The TGF-β1 produced by colon cancer cells in the conditions of Fusobacterium nucleatum infection promotes the development of the initial CD4+T cells in the dormant period into FoxP3+Tregs cells
3 讨论
近年来,Fn感染与结肠癌发生发展以及机体抗肿瘤免疫之间关系的研究越来越多地受到关注[2-3]。本研究采用qPCR方法验证了Fn在大多数结肠癌组织中的过量表达。在Fn感染阳性的组织中,TGF-β1表达与CD4+FoxP3+Treg细胞分布呈正相关。ELISA和qPCR检测结果表明Fn感染引起SW480、HT29和HCT116结肠癌细胞TGF-β1表达上调。流式细胞分析结果表明,上调的TGF-β1显著抑制CD4+T细胞增殖。另外,qPCR检测到TGF-β1上调促进FoxP3 mRNA表达,流式细胞检测到CD4+CD25+FoxP3+Treg亚群数量增加。结果提示,Fn感染后能够在肠道内长期定植,与结肠癌的发生发展关系密切,其机制可能与上调的TGF-β1对肿瘤微环境中免疫细胞的抑制作用有关。
研究表明,TGF-β可通过影响免疫细胞发育、分化、诱导耐受及免疫稳态等引起广泛的免疫抑制;此外,TGF-β通过抑制肿瘤患者的免疫监视在癌症中发挥重要的作用[8,14]。在哺乳动物TGF-β的3个高度同源的家族成员中,最主要的是TGF-β1,它具有免疫调节的重要特性[15-16]。研究发现,Fn感染会引起人牙龈成纤维细胞及单核细胞分泌TGF-β增加[17];目前发现Hp感染胃癌细胞引起TGF-β1上调的研究较多[8,18],但Fn感染引起肿瘤细胞TGF-β1变化的研究极少。最近,一项研究[19]显示,在基于qPCR检测确定的Fn高表达丰度的结肠癌组织中,靶向下一代测序结果显示TGF-β信号通路明显比低表达丰度组织上调。因此,本研究首次在临床和细胞分子水平研究了Fn感染与结肠癌TGF-β1的相关性,及Fn感染对结肠癌细胞TGF-β1分泌的影响,结果发现Fn感染的人结肠癌组织中TGF-β1高表达,而Fn感染24 h后,结肠癌细胞上清中TGF-β1及细胞TGF-β1 mRNA均有不同程度升高,这与LEE等[19]报道的Fn感染高表达TGF-β信号通路活化结果相符合。
TGF-β1是维系CD4+CD25+Treg功能的重要因子。本研究通过流式细胞分析和qPCR技术检测到活化的CD4+T细胞增殖抑制、FoxP3 mRNA水平上调以及CD4+CD25+FoxP3+Treg亚群增加。本研究结果显示Fn感染的共培养体系强烈抑制活化的CD4+T细胞增殖,而在加入TGF-β1的中和抗体后这种抑制作用被部分解除,表明Fn感染上调的TGF-β1抑制活化的CD4+T细胞的增殖。已有研究表明,TGF-β1能引起抗原刺激的(初始效应)CD4+CD25-T细胞FoxP3的表达上调,从而促进FoxP3+Treg细胞的产生,抑制CD4+T细胞增殖[20],与本研究结果一致。肠道中的Fn可直接或间接地作用于淋巴细胞,通过诱导淋巴细胞凋亡或产生促炎症微环境,以及招募肿瘤浸润免疫细胞等机制,抑制局部免疫应答,从而产生肿瘤免疫逃逸[5]。
综上所述,本研究发现Fn感染的人结肠癌组织中TGF-β1高表达和FoxP3+Treg分布密集,且二者相关;Fn感染引起人结肠癌细胞TGF-β1上调表达,可明显抑制活化的CD4+T细胞增殖,促进初始CD4+T细胞FoxP3 mRNA表达以及CD4+CD25+FoxP3+Treg亚群的增多。因此,Fn感染可能经由上调TGF-β1影响肿瘤免疫微环境,产生局部免疫抑制效应,介导肿瘤细胞免疫逃逸,但Fn感染与TGF-β1表达之间的具体分子机制需进一步设计实验研究。

