3D打印技术在腹腔镜保脾胰体尾切除术中的应用
刘文瑛 杨剑 朱剑华 谭勇 欧阳再兴 刘欣 朱玉珍 黄从云
1汕头大学附属粤北人民医院(广东韶关 512025);2南方医科大学珠江医院(广州 510280)
胰腺体尾部同脾脏和脾脏血管紧密相连,以往在切除胰体尾部常同时切除脾脏,导致“无辜性脾切除”。随着对脾脏功能重要性的不断强调,保留脾脏和脾脏功能逐渐被外科医师接受并为之不断探索和挑战[1]。随着腹腔镜微创外科技术的发展,胰体尾手术方式从联合脾脏切除逐渐扩展至技术操作要求更高的腹腔镜保脾胰体尾切除术(laparoscopic splenic-preserving distal pancreatectomy,LSPDP),但LSPDP手术难度大、技术要求高、风险高,较难开展,目前其开展多限于少数大型医院[2-3]。三维可视化、3D打印等数字医学精准诊疗技术在肝胆胰外科的应用,降低了手术难度和手术风险,提高了诸多复杂手术的可行性,促进了手术精准微创化的发展[4-5]。但三维可视化、3D打印等数字医学技术在腹腔镜胰腺外科的应用目前鲜有报道。为降低LSPDP手术难度、提高手术安全性,笔者将3D打印技术应用于LSPDP的术前评估和手术指导,效果良好,现总结报告如下。
1 资料与方法
1.1 一般资料收集2014年10月至2018年12月粤北人民医院肝胆外科行LSPDP的胰体尾占位性病变患者临床资料,纳入标准:(1)术前影像学检查、术中病理证实为胰体尾良性、交界性或低度恶性占位性病变;(2)无上腹部手术史。排除标准:(1)腹腔镜手术禁忌;(2)术中病理证实为胰体尾恶性肿瘤,腹腔镜保脾手术达不到根治目的。本研究共纳入50例患者,分成两组:3D打印技术指导手术组(3D组)22例,非3D技术指导组(对照组)28例,临床资料见表1。入院及术前充分告知病情,签署由医院伦理委员会批准的知情同意书和手术同意书。
1.2 方法
1.2.1 CT扫描和数据收集所有患者术前行上腹部256排螺旋CT(美国GE公司)扫描,在CT自带工作站上推薄处理CT数据,分析患者平扫期、动脉期、门静脉期和平衡期的亚毫米CT数据;导出3D组患者的DICOM格式CT数据并储存。
1.2.2 三维重建、3D打印将3D组患者四期薄层CT数据导入3D-DOCTOR 4.0软件平台,进行腹腔脏器和血管系统的三维重建,得到个体化的胰腺、脾脏、血管及肿瘤三维重建模型。对三维可视化图像模型进行旋转、透明化、放大等操作,三维立体观察患者胰体尾肿瘤的大小、形态,胰体尾部及肿瘤同脾脏、腹腔血管等的空间解剖,计算肿瘤、胰腺的体积,行仿真手术演练。
输出STL格式文件,导入Repetier-host 1.06软件按正常大小将胰腺、肿瘤、脾脏和血管系统切片后保存,链接CoLiDo3D打印机(珠海西通)使用聚乳酸材料,打印出3D实物模型。通过3D模型进一步实景分析解剖结构,评估腹腔镜保脾手术和Kimura法的可行性、胰腺手术平面、手术入路,手术难点和风险及应对方案,预推演手术方案并进行优化。
1.2.3 手术手术为同一组医师完成,3D组术中使用3D打印模型实时指导。采用气管插管全麻,优先Kimura法,常规5孔法操作。STORZ高清腹腔镜探查腹腔,超声刀或Ligasure切开胃结肠韧带、脾胃韧带,使结肠下移;分离胃后壁与胰腺粘连,向上牵开胃体,显露胰腺;腹腔镜超声探查,3D组结合3D打印模型确定胰腺肿瘤及周围毗邻。切开胰腺下缘后腹膜,游离胰腺上缘,分离保护胰腺后上方的脾动、静脉,离断进入胰腺实质血管分支,建立胰腺后隧道,置入血管吊带提起胰腺实质,在距肿瘤约1 cm处用腹腔镜下切割闭合器(Endo-GIA)切断胰腺。向左上方提起胰体尾及肿瘤,离断进入胰体尾的脾动、静脉分支,向脾门部完全游离胰体尾部。若术中脾动、静脉无法分离或保护等则改行Warshaw法,结扎脾动脉和(或)脾静脉,保留胃短血管和胃网膜左血管等侧支循环;若术中发现脾脏血运差则切除脾脏;若发生难以控制的大出血等情况则中转开腹手术。移除标本装入标本袋,脐下腹部正中切口取出标本。胰腺断端外侧留置腹腔引流管。术中常规冰冻病理学检查明确肿瘤性质及切缘情况。
1.3 观察指标手术时间、术中出血量、术后住院时间、术后腹腔引流管引流量及淀粉酶水平、并发症:如胰漏、腹腔积液、出血、腹腔感染等。
1.4 统计学方法采用SPSS 19.0统计软件进行分析,计量资料采用(±s)表示,两组间比较采用t检验,计数资料采用χ2检验及Fisher确切概率法检验,P<0.05为差异有统计学意义。
2 结果
2.1 患者基本情况大部分患者无典型临床症状,通过体检或偶然发现胰体尾肿物。术前肿瘤标志物检查如糖类抗原CA19-9、CA12-5均为阴性,3D组通过三维重建计算出肿瘤体积(82.1±43.4)cm2。两组患者年龄及肿瘤大小等差异无统计学意义(P>0.05,表1)。
2.2 三维重建及3D打印结果3D组患者亚毫米CT数据(图1A)通过3D-DOCTOR 4.0软件重建获得立体的腹腔脏器三维重建模型,全方位观察了解个体化的胰腺三维解剖;可视化处理观察胰管、脾动静脉的走行,同肿瘤的关系,胰尾、肿瘤同脾门的空间三维解剖(图1B)。按比例打印出胰腺3D模型,实景化观察胰腺、肿瘤、脾动静脉等的立体解剖结构、关系和间隙(图1C),结合三维重建图像模评估LSPDP及Kimura法的可行性,术中需要注意的解剖结构,制定个体化的手术方案;并直观地预演手术方案、入路,保留脾脏血管的难点和要点,手术团队对手术方案的理解和执行达到高度的一致。
表1 两组患者的临床资料Tab.1 Clinical data of two groups ±s
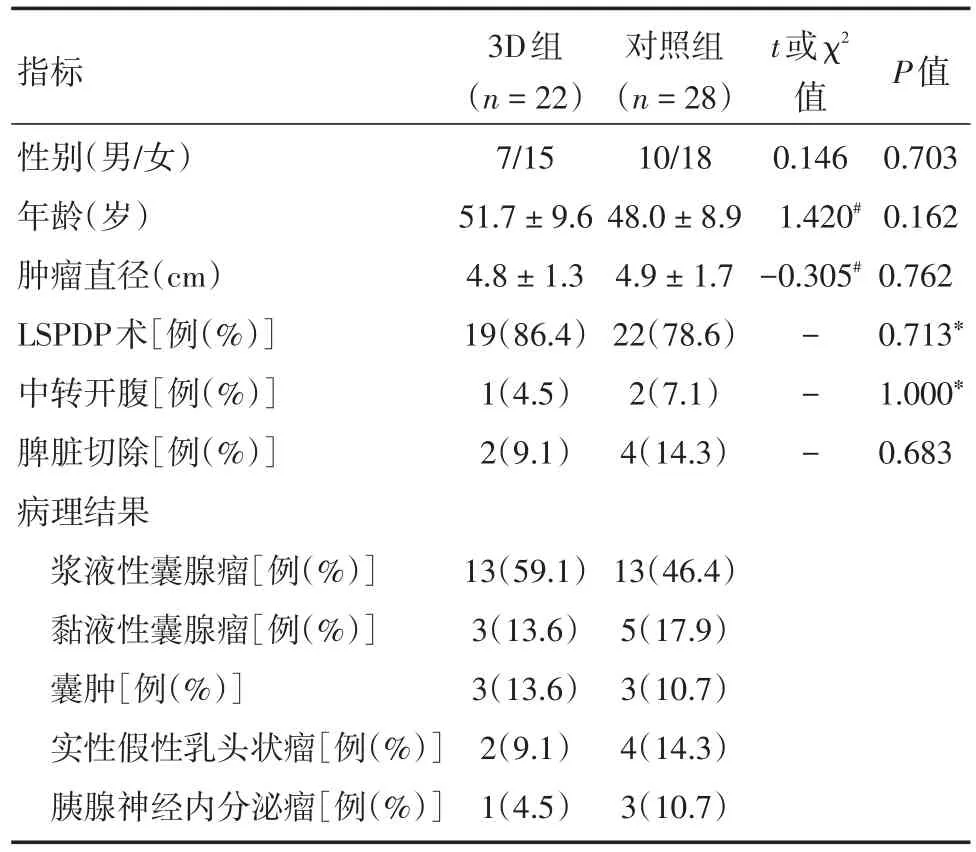
表1 两组患者的临床资料Tab.1 Clinical data of two groups ±s
注:*为Fisher Exact Test结果,#为t值
指标性别(男/女)年龄(岁)肿瘤直径(cm)LSPDP术[例(%)]中转开腹[例(%)]脾脏切除[例(%)]病理结果浆液性囊腺瘤[例(%)]黏液性囊腺瘤[例(%)]囊肿[例(%)]实性假性乳头状瘤[例(%)]胰腺神经内分泌瘤[例(%)]3D组(n=22)7/15 51.7±9.6 4.8±1.3 19(86.4)1(4.5)2(9.1)对照组(n=28)10/18 48.0±8.9 4.9±1.7 22(78.6)2(7.1)4(14.3)t或χ2值0.146 1.420#-0.305#---P值0.703 0.162 0.762 0.713*1.000*0.683 13(59.1)3(13.6)3(13.6)2(9.1)1(4.5)13(46.4)5(17.9)3(10.7)4(14.3)3(10.7)
2.3 手术结果手术过程见图2,术后病理结果见表1。两组患者的手术方式差异无统计学意义(P>0.05),但3D组的LSPDP术成功率高于对照组;3D组1例、对照2例中转开腹;3D组2例,对照组4例保脾不成功。剔除中转开腹和脾脏切除患者,两组共41例(3D组19例、对照组22例)患者成功施行LSPDP术。对比成功施行LSPDP术的患者资料(表2),两组患者一般情况差异无统计学意义(P>0.05)。手术方式(Kimura法和Warshaw法)差异无统计学意义,但3D组的Kimura法手术比例明显高于对照组。3D组的手术时间、术中出血量、术后第1、2天腹腔引流管引流量低于对照组,差异有统计学意义(P<0.05);术后第3天腹腔引流量两组差异无统计学意义(P>0.05)。术后第3~4天恢复全流饮食。两组术后第1、3天腹腔引流液淀粉酶水平差异无统计学意义(P>0.05),术后第3~4天拔除腹腔引流管,均无B、C级胰瘘发生,无腹腔感染、出血等并发症发生。患者均获随访,生存质量良好;影像学检查(CT、B超)未见复发、腹腔积液等。
表2 成功行LSPDP的41例患者临床资料Tab.2 Clinical data of 41 patients who successfully implemented LSPDP ±s
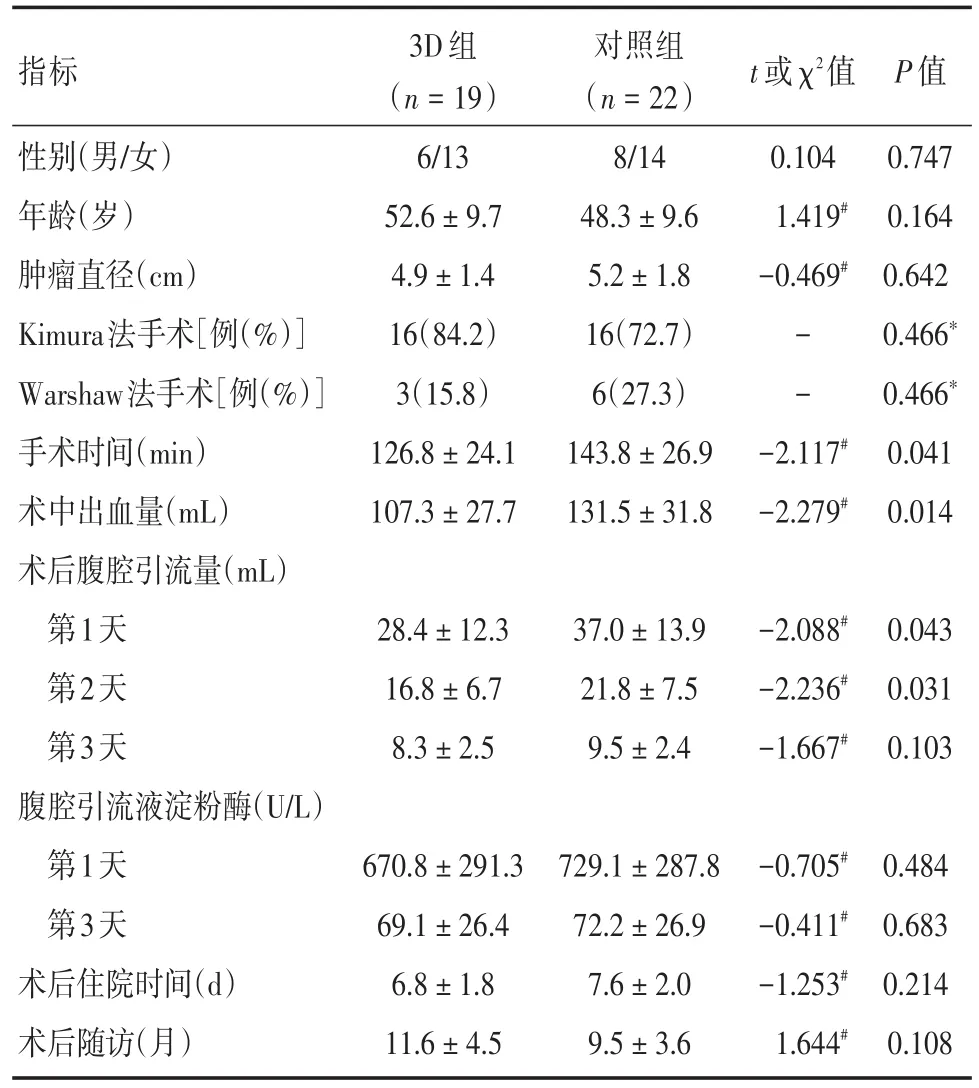
表2 成功行LSPDP的41例患者临床资料Tab.2 Clinical data of 41 patients who successfully implemented LSPDP ±s
注:*为Fisher Exact Test结果,#为t值
t或χ2值P值指标性别(男/女)年龄(岁)肿瘤直径(cm)Kimura法手术[例(%)]Warshaw法手术[例(%)]手术时间(min)术中出血量(mL)术后腹腔引流量(mL)第1天第2天第3天腹腔引流液淀粉酶(U/L)第1天第3天术后住院时间(d)术后随访(月)3D组(n=19)6/13 52.6±9.7 4.9±1.4 16(84.2)3(15.8)126.8±24.1 107.3±27.7对照组(n=22)8/14 48.3±9.6 5.2±1.8 16(72.7)6(27.3)143.8±26.9 131.5±31.8 0.104 1.419#-0.469#- --2.117#-2.279#0.747 0.164 0.642 0.466*0.466*0.041 0.014 28.4±12.3 16.8±6.7 8.3±2.5 37.0±13.9 21.8±7.5 9.5±2.4-2.088#-2.236#-1.667#0.043 0.031 0.103 670.8±291.3 69.1±26.4 6.8±1.8 11.6±4.5 729.1±287.8 72.2±26.9 7.6±2.0 9.5±3.6-0.705#-0.411#-1.253#1.644#0.484 0.683 0.214 0.108
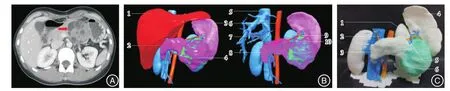
图1 胰体尾肿瘤患者的CT扫描、腹腔脏器三维重建图及3D打印模型Fig.1 CT scan image three-dimensional reconstruction of abdominal organs and 3D printed model of the body or tail of the pancreas

图2 手术过程Fig.2 Surgical procedure
3 讨论
随着腹腔镜胰腺外科技术的发展,其在胰腺良恶性肿瘤手术中的应用越来越广,具有创伤小、并发症少、恢复快等优点,让更多的患者受益[6-8]。对于胰体尾部的良性病变、交界性或低度恶性病变,LSPDP是最佳选择[9]。保留脾脏的关键是保证脾脏的血液供应,目前常用的保脾方法有两种:保留脾脏血管的Kimura法和切除脾动静脉保留侧支循环的Warshaw法。Kimura法保留脾脏的原有血供,更有利于脾脏生理解剖功能的保护,可避免术后脾脏血供障碍或区域性门静脉高压,术后脾梗死、脾脓肿等发生率低[10]。Warshaw法手术操作相对简单,难度及风险较低,但脾梗死和胃底静脉曲张出血等并发症高,影响脾脏功能,严重时需再次手术[11]。因此,Kimura法LSPDP为首选,但其技术要求高、手术操作难度大,术中易损伤脾脏血管导致大出血,被迫转行Warshaw法手术或中转开腹,甚至保脾不成功[12-13]。
如何降低LSPDP的难度和风险,提高手术的可行性和安全性一直是研究的热点。杨鸿国等[14]提倡“动脉优先”,3D腹腔[15]以及机器人的辅助[16]等在一定程度上提高了LSPDP成功率。数字医学技术广泛应用于肝胆外科,能帮助外科医师掌握复杂多变的肝胆内部解剖、全面反映病变信息、优化手术方案、减少手术创伤等,实现了精准的肝胆外科数字化微创手术[4-5]。有理由相信,三维可视化、3D打印等数字医学技术也能提高LSPDP的可行性和安全性,促进该技术的发展[17]。
本研究在成功将3D打印技术运用于肝脏切除手术的基础上[18],将其应用于LSPDP的术前评估和手术指导,进一步探讨3D打印技术在LSPDP中的作用。实践中发现,3D打印技术在LSPDP应用优势如下:
3.1 3D打印技术精准实景化再现个体化的胰腺解剖3D打印技术是三维重建和三维可视化技术的进一步发展和延伸,高精度的3D打印模型能更真实地实景化再现患者个体化的胰腺、肿瘤和脾动、静脉以及脾门部的三维立体解剖,尤其是脾动静脉与胰腺和肿瘤、胰尾同脾门的空间解剖关系。术前通过3D打印对手术难点和风险的准确判断,做到提前预知;实景化的解剖再现、身临其境的模拟分析均有利于手术团队对病情、解剖、手术方案理解的一致性,增加了手术的操作性和协调性,从而提高了手术的可行性和安全性。具体体现在加快了实际手术的手术进程,减少了手术创伤从而减少了手术并发症,故3D组的手术时间要明显短于对照组。
3.2 3D打印技术可降低手术难度、减少手术创伤Kimura法LSPDP手术难度主要体现在对脾动静脉血管的分离和保护、胰后隧道的建立[19]。由于肿瘤的长期压迫和慢性炎症等,脾动、静脉解剖常常发生变异和移位,深藏的脾动静脉及分支常导致意外出血[20-21]。胰后隧道的建立需要分离胰腺实质和脾动静脉,过多的分离增加手术创伤和出血等风险。3D打印技术主要从三个方面来降低手术难度、减少手术创伤:(1)指导对脾血管的精准保护:通过三维可视化、3D打印技术对解剖的精准理解和术中实时导航,分离保护脾动静脉是可避免盲目性,对分支血管的提前预知减少了术中出血尤其意外出血等的发生。3D组中未能成功实施LSPDP术的3例患者,术前通过3D打印技术了解到肿瘤同脾血管粘连致密,成功施行LSPDP术的可能性不大,术中证实后及时更改手术方式,避免了大出血等意外情况的发生。(2)指导精准的胰后隧道的建立:3D打印技术的解剖实景化、身临其境的手术演练,能帮助术者在胰腺实质相对薄、血管相对易显露的地方快速建立胰后隧道,避免对了对胰腺实质和脾血管过多的分离,减少了手术创伤;(3)3D打印技术精准再现个体化的胰腺、脾血管、脾脏和肿瘤的解剖结构,帮助了3D组患者术中精细的脾门部解剖分离。因此3D组LSPDP手术成功率和Kimura法手术成功率均高于对照组,差异无统计学意义,考虑样本量偏小导致。3D组的手术时间、术中出血和术后引流量明显低于对照组,差异无统计学意义;同时术后腹腔引流量和引流液的淀粉酶水平要低于对照组。
3.3 3D打印技术是虚拟和现实之间的“桥梁”3D打印技术和三维可视化技术相辅相成,实物、实景化弥补了术者对原始CT二维影像、电脑虚拟的三维重建图像认识的差异,可触摸、可感知,使精准的个体化三维解剖和术中真实解剖精准配准,毫无违和感。能够帮助术者变被动为主动,提前预知、主动选择手术方式,改变传统的“边做边选”模式。
虽然3D打印技术诸多优点,但也有不足:(1)无法准确判断局部粘连的致密程度;(2)3D打印质量同材料等相关,本研究采用的聚乳酸材料虽然价格低廉、可降解,适合临床广泛使用,但模型的透明度和光滑性同昂贵的树脂材料有一定差距;(3)传统腹腔镜不具有三维立体感和手术操作的纵深感,术中3D打印和三维可视化模型导航的实景性能会打折扣。下一步研究笔者将继续增加样本量,优化3D打印技术,并引进3D腹腔镜配合手术。
综上所述,3D打印技术可进一步提高腹腔镜保脾胰体尾切除术的成功率和安全性,使手术更加精准和微创。

