遮阴对玉带草光合特性的影响
安佰义 范爱淇 吴双
摘要:以分株繁殖自然生长的玉带草(Phalaris arundinacea var. Picta)为试验材料,在30%、70%、90%遮阴度下处理 50 d 后,以全光照对其进行光合特性研究。结果表明,不同遮阴条件下的玉带草叶片光合日变化曲线均为单峰型。随遮阴程度的增加,玉带草叶片的最大净光合速率(Pnmax)、日均净光合速率(Pn)、水分利用率(WUE)逐渐减小,遮阴度达90%时达最小值;30%与70%遮阴度下的玉带草叶片光合光响应曲线与表观量子效率(AQY)均高于对照,90%遮阴时低于对照。气孔导度(Gs)、蒸腾速度均随遮阴程度增加而先增后降,90%遮阴度时为最小值;70%遮阴度处理的CO2响应曲线与羧化效率(CE)高于对照,其他处理均低于对照。遮阴处理降低了叶片的CO2补偿点和暗呼吸速率(Rd);遮阴处理提高了玉带草叶片的叶绿素的含量,且70%遮阴度处理的叶片叶绿素a、叶绿素b与类胡萝卜素含量较高。
关键词:玉带草;遮阴;光合特性
中图分类号: S184 文献标志码: A 文章编号:1002-1302(2019)12-0157-04
玉带草(Phalaris arundinacea var. picta),又名丝带草,为禾本科草属多年生草本植物,分布于我国东北、华北、华中及欧洲和北美洲部分地区。生性喜光耐寒。近年来玉带草作为观赏草在园林绿化中的应用逐渐增多,可以布置路边花镜或花坛镶边,主要用作水景园背景材料,也可点缀于桥、亭、榭四周,可盆栽用于庭院观赏[1]。
目前,国内对玉带草的研究仅限于光合特性、耐盐性、耐旱性、解剖结构观察以及花镜选材等方面[2-4],而对玉带草遮阴下的光合特性研究未见报道。本试验研究了玉带草在吉林长春地区的引种栽培过程中不同光照条件对其光合特性的影响,旨在明确玉带草对光环境的适应性,以明确遮阴环境对玉带草光合生理性状的影响,以及玉带草叶片适阴性的变化特点,并判断荫蔽的环境是否利于玉带草的生存生长,进而为园林设计中乔、灌、草多层次景观结构以及林阴植物种的选择提供合理的依据。
光是植物光合作用所必需的環境因子。近年来,随着城市的快速发展,高大建筑物及高层建筑设施迅速增多,城市园林绿地面积越来越小,城市弱光环境限制了植物的生存和生长。导致喜光的玉带草不得不脱离原有的最适合生境,光成了影响玉带草生长发育的重要环境因子之一。
1 材料与方法
1.1 试验地概况和样地描述
试验在吉林省长春市吉林农业大学园艺学院园林实验基地内进行。该试验地位于125°24′~125°36′E、43°47′~43°61′N,海拔为251 m,为大陆性季风气候;年均气温为 4.9 ℃,年均降水量为565 mm,年日照时间为2 698 h。
1.2 试验设计和样本采集
供试材料为2014年6月分株繁殖自然生长的玉带草植株,培养土为园土,pH值为7.3。于2016年5月16日对生长良好的玉带草进行遮光处理。试验设4个遮阴度处理(用TES-1335型数位式照度计测定各处理的透光率):0(CK)、30%、70%、90%,用不同遮光度的遮阴网搭建遮阴棚(长 3.8 m×宽1.6 m×高1.5 m),遮阴棚南北朝向,2个遮阴棚间隔3 m,以避免交叉遮光。遮阴处理期间进行正常水分管理。处理50 d后测定玉带草光合响应参数及色素含量。
1.3 试验方法
2016年7月5—8日均为晴朗无云天气,采用美国PP-Systems公司生产的CIRAS-2型光合测定系统测定玉带草的净光合速率(Pn)、气孔导度(Gs)、细胞间隙CO2浓度(Ci)等光合参数。
1.3.1 光合日变化的测定 2016年7月5日,晴朗无云。于6:00~18:00进行净光合速率的日变化测定,每隔 2 h 测定1次。测定指标包括净光合速率、气孔导度、细胞间隙CO2浓度、蒸腾速率,计算水分利用效率(WUE)=Pn/Tr;气孔限制值(Ls)按照Berry等的方法计算[5],即Ls=1-Ci/Ca(Ca为大气CO2浓度);表观量子效率(AQY)=Pn/光合有效辐射(PAR)。测定时每处理选3 株,为3次重复。
1.3.2 光响应曲线的测定 2016年7月6日,晴朗无云。在09:00—11:30间,控制CIRAS-2型光合测定系统的CO2浓度为380 μmol/mol,温度控制在(25±1) ℃,用发光=极管(LED)红蓝光源控制光合有效辐射为0~2 000 μmol/(m2·s),并测定玉带草叶片净光合速率。设置14个光合有效辐射梯度,分别为 2 000、1 800、1 600、1 400、1 200、1 000、800、600、400、300、200、100、50、0 μmol(m2·s)。制作Pn-PAR响应曲线,在每个光照度下适应 3 min 后测定。Pn-PAR响应曲线由直角双曲线修正模型拟合[6],决定系数均达到0.96以上,拟合度良好。根据拟合模型得出表观量子效率等。
1.3.3 CO2响应曲线的测定 2016年7月7—8日,在 09:00—11:30晴朗无风时,测定不同处理组内健康成熟叶片的光合特征曲线,每个测定重复3次。在设定1 200 μmol/(m2·s)的光照度下测定在0、50、100、150、200、300、400、600、800、1 000、1 200、1 400、1 600、1 800、2 000 μmol/mol CO2浓度条件下的Pn和Ci,制作Pn-Ci响应曲线,在每个CO2浓度下适应3 min后测定。Pn-Ci响应曲线均由直角双曲线修正模型拟合[7],决定系数均在0.96以上,拟合度良好。根据拟合模型得出羧化效率(CE)等。
1.3.4 色素含量的测定 从进行光合测定的每株植物上采集1~5张完全展开的健康叶片,参考苏正淑等的乙醇丙酮混合液法进行光合色素含量的测定[8]。
1.4 数据处理
試验数据采用Excel 2010和SPSS 18.0软件进行数据统计与分析。
2 结果与分析
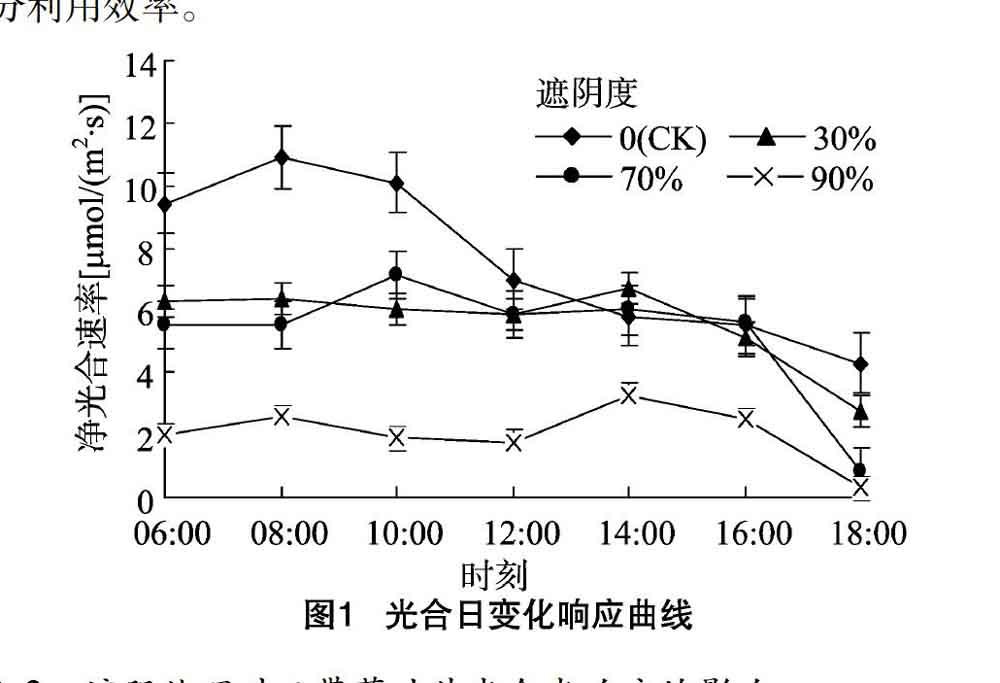
2.1 遮阴处理对玉带草叶片光合日变化的影响
净光合速率日变化常因植物种类和环境条件的不同而表现出差异,同一植物不同部位的叶片在不同月份、不同环境条件下可呈现不同的类型[9],通常在自然条件下,净光合速率日变化可分为“双峰”型、“单峰”型和“三峰”型。从图1、表1可以看出,不同遮阴处理下玉带草叶片的净光合速率均表现出先增加后减少的单峰型变化规律,没有光合午休现象,峰值随遮阴程度加大而逐渐延后。最大净光合速率(Pnmax)、日均Pn与WUE均随着遮阴程度增加而减小。由于光能明显降低,90%遮阴度的玉带草日均Gs、Pn、WUE和Pnmax均为最小值,与其他3个处理间存在极显著差异,表明玉带草受重度遮阴影响最敏感。气孔的行为直接影响大气与表皮层之间的CO2和水汽的交换,气孔阻力占叶片与大气之间CO2和水汽交换总阻力相当大的部分,蒸腾作用是光合作用不可避免的结果,蒸腾流从根到蒸腾器官的流动使土壤中的营养物质和溶液运输到根表[10]。90%遮阴度的日均Gs、Tr与WUE最小,可能是过度遮阴使玉带草叶片的气孔关闭,减少了蒸腾作用,使玉带草根部从土壤中吸收的水分减少,从而也降低了水分利用效率。
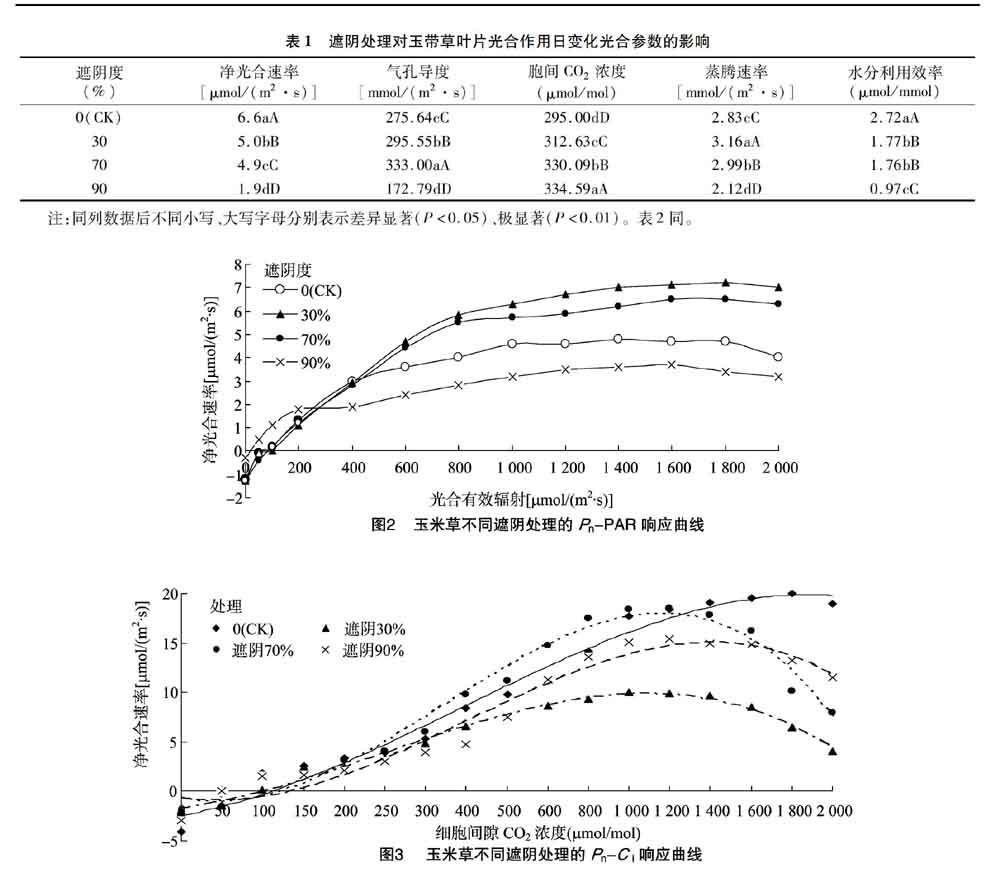
2.2 遮阴处理对玉带草叶片光合光响应的影响
从图2可以看出,30%遮阴度的Pn-PAR曲线整体高于CK,90%遮阴度的最低,但在初始阶段,90%遮阴度的净光合速率明显高于其他3个处理,可能是由于重度遮阴下玉带草叶片的应激反应。植物的光补偿点越低,越能在弱光条件下顺利进行光合作用,开始增加有机物质;而植物的饱和光照度越小则表明植物叶片的光合速率随光合有效辐射的增加很快达到最大值,然后光合速率随光合有效辐射的增加而降低[11-12]。玉带草叶片光补偿点在90%遮阴度环境下骤减,说明90%遮阴度下玉带草对弱光的利用能力较强;WUE与Pn均随遮阴程度的增加呈递减趋势,90%遮阴度下玉带草叶片的Pn骤减,依据许大全的报道[13],遮阴环境下玉带草叶片的Pn下降的原因之一是气孔限制,Gs下降阻止了CO2的供应。表观量子效率是光合作用中光能转化最大效率的一种度量,可以正确反映光合机构机能的变化,也可以反映叶片对弱光的利用能力[14]。玉带草叶片的AQY随遮阴程度的增加呈现先上升后下降趋势,70%遮阴度下AQY达最大值,为0.015 1,这与张哲等在60%透光下处理的白三叶的结果[15]相似,但遮阴处理的玉带草叶片AQY均低于全光照处理,说明玉带草叶片对弱光有一定的适应和利用能力。最大净光合速率越大,植物叶片在遮阴胁迫下的光合潜力就越大。本试验中不同处理的Pnmax分别为4.7、7.2、6.4、4.1 μmol/(m2·s),说明30%、70%遮阴度下玉带草的光合潜力较大,但90%遮阴度影响玉带草叶片的光合能力。
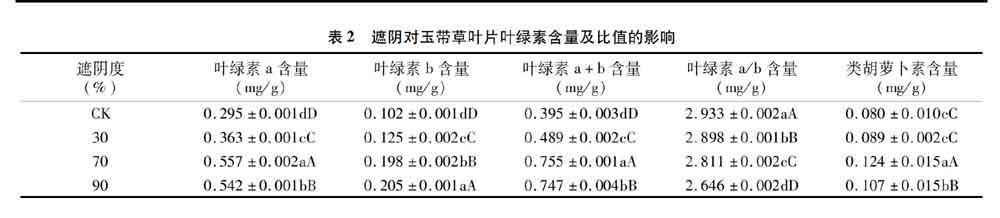
2.3 遮阴处理对玉带草叶片光合CO2响应的影响
从图3可以看出,70%遮阴度下的玉带草叶片的Pn整体上高于对照,其他处理整体上均低于对照。暗呼吸是植物维持自身正常代谢而进行物质氧化分解获得能量的过程,植物可以通过降低暗呼吸速率来适应低光环境[16]。玉带草叶片暗呼吸速率(Rd)随遮阴程度增加而减小,说明玉带草能通过降低Rd来适应弱光环境。CO2是光合作用的原料,在一定浓度范围内,其含量越高光合作用就越强。CO2浓度的升高,一方面可以增加CO2对核酮糖-1,5-二磷酸羧化酶结合位点的竞争,从而提高羧化效率;另一方面可以抑制光呼吸来提高光合效率[17]。70%遮阴度处理的玉带草叶片的羧化效率(CE)最高,其他处理的玉带草叶片的CE均低于对照,90%遮阴度处理的玉带草叶片的CE明显低于CK,说明70%遮阴度能提高玉带草的碳同化能力,但重度遮阴对其影响很大。遮阴处理的玉带草叶片CO2补偿点均低于CK,70%遮阴度处理的玉带草叶片CO2补偿点最低。
2.4 遮阴处理对玉带草叶片光合色素的影响
从表2可以看出,遮阴处理的玉带草叶片叶绿素a、叶绿素a+b、与叶绿素b含量整体上随遮阴程度的增加而增加,叶绿素a/b的变化规律则相反,这与宋洋等的研究结果[18]一致。其中,70%遮阴度的叶绿素a+b与类胡萝卜素含量最高,均与CK差异极显著。类胡萝卜素所吸收的光传递给叶绿素后才能启动光合作用的辅助性作用,亦有利于遮阴叶提高光能利用效率。遮阴处理的类胡萝卜素含量均高于CK,其中70%遮阴度的类胡萝卜素含量最高,表明70%遮阴度环境能提高玉带草叶片的光能捕获能力从而提高光能利用效率,但90%遮阴度处理会使其能力减弱。
3 讨论与结论
光合作用日变化是植物生产过程中物质积累与生理代谢的基本单元,常因植物种类和环境条件的变化而有差异,它是分析环境因素影响植物生长和代谢的重要手段[19]。玉带草的净光合速率日变化均呈单峰型曲线,不存在光合午休现象。90%遮阴度使玉带草的Pn峰值推迟到14:00,玉带草对30%、70%的遮阴环境有一定的适应性,但90%遮阴度对玉带草的生长代谢明显造成伤害。
光响应曲线在一定程度上可以反映不同光照下植物光合速率的变化规律,还可直观地表示遮阴对植物净光合速率的抑制情况。30%、70%遮阴度有利于玉带草叶片的光合作用,而90%遮阴度已是过度遮阴,抑制了玉带草叶片的光合作用。
CO2浓度升高不仅为光合作用提供了较多的原料,而且提高了1,5-二磷酸核酮糖(RuBp)羧化酶的活性,增加了对CO2的固定能力;同时抑制了RuBP加氧酶的活性,减少了光合呼吸底物乙醇酸的生成,降低了植物的光呼吸强度,从而提高了光合作用效率[20]。30%、70%遮阴度的玉带草叶片通过提高对CO2的固定能力,降低了呼吸强度,从而提高了净光合速率,但90%的遮阴度则大大降低了玉带草叶片的光合作用效率。
比较玉带草的光合特征值与C4、C3阳性和阴性植物的光合生理生态特征值[21],玉带草的光饱和点、CO2补偿点与最大净光合速率均在C3阴性植物的光合生理特征值范围内,而光补偿点则符合C4植物范围。综合判断后,玉带草更近似于C3阴性植物。
植物吸收光能主要是由植物的叶绿素完成的,所以,其含量的多少直接影响植物光合作用的强弱。叶绿素的重要功能是能选择性地吸收光,叶绿素a在红光部分的吸收带偏向长红波方面,叶绿素b则在蓝紫光部分的吸收带较宽[22]。本试验中遮阴下的玉带草叶片中叶绿素的含量均高于CK,说明遮阴环境有利于玉带草叶片叶绿素的合成与积累,其中70%遮阴度处理的玉带草叶绿素含量最高,叶色更具观赏性,表明70%遮阴度的效果最好。
参考文献:
[1]张相伟. 天津市花境植物材料選择及设计研究[D]. 天津:天津大学,2013.
[2]刘晓嘉,范爱淇,安佰义,等. 玉带草光合特性的研究[J]. 湖北农业科学,2017,56(15):2893-2896,2901.
[3]李洋洋. 水分胁迫对玉带草生理特性的影响[D]. 哈尔滨:东北林业大学,2012.
[4]刘晓东,李洋洋,何 淼. PEG模拟干旱胁迫对玉带草生理特性的影响[J]. 草业科学,2012,29(5):687-693.
[5]叶子飘,于 强. 一个光合作用光响应新模型与传统模型的比较[J]. 沈阳农业大学学报,2007,38(6):771-775.
[6]叶子飘,于 强. 光合作用对胞间和大气CO2响应曲线的比较[J]. 生态学杂志,2009,28(11):2233-2238.
[7]Berry J A,Downton W J S. Environmental regulation of photosynthesis[J]. Photosynthesis,1982(2):263-343.
[8]苏正淑,张宪政. 几种测定植物叶绿素含量的方法比较[J]. 植物生理学通讯,1989(5):77-81.
[9]郭宝林,杨俊霞,鲁韧强,等. 遮光处理对扶芳藤生长和光和特性的影响[J]. 园艺学报,2007,34(4):1033-1036.
[10]黄振英,董学军,蒋高明,等. 沙柳光合作用和蒸腾作用日动态变化的初步研究[J]. 西北植物学报,2002,22(4):93-99.
[11]彭晓邦,蔡 靖,姜在民,等. 渭北黄土区农林复合系统中大豆辣椒的光合生理特性[J]. 生态学报,2009,29(6):3173-3180.
[12]孙 颖. 百子莲繁殖生物学研究[D]. 哈尔滨:东北林业大学,2009.
[13]许大全. 光合作用气孔限制分析中的一些问题[J]. 植物生理学通讯,1997,33(4):241-244.
[14]张永霞,李国旗,张 琦,等. 不同遮阴条件下罗布麻光合特性的初步研究[J]. 西北植物学报,2007,27(12):2555-2558.
[15]张 哲,黄淑萍,杜桂娟,等. 遮阴对4种豆科牧草光合特性的影响[J]. 草业科学,2013,30(1):44-51.
[16]Garnier E,Cortez J,Billès G,et al. Plant functional markers capture ecosystem properties during secondary succession[J]. Ecology,2004,85(9):2630-2637.
[17]朱万泽,王金锡,薛建辉,等. 四川桤木光合生理特性研究[J]. 西南林学院学报,2001,21(4):196-204.
[18]宋 洋,廖 亮,刘 涛,等. 不同遮阴水平下香榧苗期光合作用及氮分配的响应机制[J]. 林业科学,2016,52(5):55-63.
[19]孙 磊,章 铁,李宏开,等. 柿树光合速率日变化及其影响因子的研究[J]. 北方果树,2006(2):4-6.
[20]陈翠琴,吕洪飞,黄四娣,等. 三白草科2种植物光合作用和叶绿素荧光特性的比较研究[J]. 浙江农业学报,2011,23(4):725-730.
[21]杜占池,杨宗贵. 冰草叶片光合速率与生态因子的关系[J]. 草地学报,2000,8(3):155-163.
[22]Boardman N K. Comparative photosynthesis of sun and shade plants[J]. Annual Review of Plant Physiology,1977,28(1):355-377.王薇薇,祖艳侠,吴永成,等. 盐胁迫对豇豆幼苗离子分布的影响[J].

