井冈霉素、多菌灵和不动杆菌A2混用对水稻纹枯病病菌的抑制作用
朱彤彤 陈达川 袁梦思

摘要:为探索能够高效防治水稻纹枯病的方法,以水稻纹枯病菌强致病菌株A111为供试菌株,通过室内平板试验测定井冈霉素、多菌灵和不动杆菌A2混用对水稻纹枯病菌的抑制作用。结果表明,井冈霉素对水稻纹枯病菌的毒力较大,其EC50为0.026 4 mg/L;多菌灵的EC50为0.183 5 mg/L。研究发现,井冈霉素处理后的水稻纹枯病菌菌落呈不规则形态生长,菌丝和菌核的干质量随药剂浓度增加明显下降;而多菌灵处理后的水稻纹枯病菌菌丝生长缓慢,菌丝和菌核的干质量降低程度低于井冈霉素。而井冈霉素、多菌灵与不动杆菌A2混用后对水稻纹枯病菌的抑制作用均高于单独使用时的效果。由此可见,将井冈霉素和多菌灵与不动杆菌A2混用能够更好地防治水稻纹枯病,为杀菌剂和生防菌的混用奠定了理论基础。
关键词:井冈霉素;多菌灵;不动杆菌;水稻纹枯病菌;生防菌混用
中图分类号: S435.111.4+2 文献标志码: A 文章编号:1002-1302(2019)12-0146-03
水稻纹枯病由立枯丝核菌(Rhizoctonia solani)引起,在南方稻区发生严重,是水稻上的主要病害之一,给水稻生产造成了巨大的经济损失[1-3]。对于水稻纹枯病的防治,主要采用化学药剂。其中,井冈霉素和多菌灵属于高效低毒的广谱内吸性杀菌剂,自20世纪70年代发现并使用以来,对水稻纹枯病的防治达到了显著的效果。但由于药剂的不合理使用及长期使用单一杀菌剂,造成菌株产生严重的抗药性[4-6]。
生物防治是一种高效、安全的防治植物病害的方法,而且不污染环境,从而受到了人们的青睐,先后发现了芽孢杆菌(Bacillus)、假单胞菌(Pseudomonas)、放线菌(Actinomycetes)等常见的纹枯病拮抗菌[7-9]。但生防菌易受到不适宜土壤环境及其本身特性的影响,很难达到预期的防病效果。有研究证实,将杀菌剂和生防菌混合使用,可以有效延缓纹枯病菌的抗药性,提高对水稻纹枯病的防治效果[10-11]。笔者在获得1株高效拮抗水稻纹枯病菌的不动杆菌A2的基础上[12],仍以水稻纹枯病强致病菌株A111为供试菌株,在室内测定井冈霉素和多菌灵及其与不动杆菌A2混用后对纹枯病菌的抑制作用,旨在为深入探索杀菌剂和生防菌混用对水稻纹枯病的作用机制和提高防治效果提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 水稻纹枯病菌A111、不动杆菌A2均由长江大学微生物实验室采集、分离和纯化。
1.1.2 供试药剂 5%井冈霉素A可湿性粉剂(武汉科诺生物科技有限公司)、25%多菌灵可湿性粉剂(山东省禾宜生物科技有限公司)。
1.1.3 培养基 马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,水补足至1 000 mL,pH值自然;马铃薯葡萄糖(PD)培養基:马铃薯200 g,葡萄糖20 g,水补足至1 000 mL,pH值自然;营养琼脂(NA)培养基:牛肉膏 5 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,水补足至 1 000 mL,pH值7.0。
1.2 试验方法
1.2.1 药剂毒力测定 将2种药剂分别加入到融化好的PDA培养基中,使井冈霉素浓度为0、0.048、0.096、0.192、0.384、0.768 mg/L,多菌灵浓度为0、0.2、0.4、0.6、0.8、1.0 mg/L。将培养48 h的水稻纹枯病菌菌块(直径7 mm)接种至含药的PDA培养基中央,于28 ℃恒温培养箱培养,48 h后依照十字交叉法测定各个处理的菌落直径,以不含药剂的培养基为对照,每个浓度重复3次。通过菌丝生长抑制率和各药剂的有效浓度对数值之间的线性回归分析,求出各药剂的EC50值和EC90值。抑制率的计算公式如下:
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.2.2 菌落与菌丝形态观察 将直径7 mm的水稻纹枯病菌菌块分别接种到上述药剂浓度的PDA培养基中央,28 ℃培养。24 h后用插片培养法[13]添加盖玻片,继续培养72 h,苏木精染色,采用倒置显微镜观察,每个浓度重复3次。观察并记录不同浓度井冈霉素和多菌灵处理的菌落和菌丝的形态,并比较其差异。
1.2.3 菌核、菌丝干质量的测定 采用“1.2.2”节的方法,28 ℃ 培养15 d,收集菌核,烘干后称其质量,每个浓度重复3次。
将2种药剂分别加入装有100 mL PD培养基的三角瓶中,使井冈霉素和多菌灵浓度如“1.2.1”节所述。每瓶接种10块水稻纹枯病菌菌块(直径7 mm),每个浓度重复3次,以不加药剂的培养基为对照,于28 ℃、120 r/min振荡培养6 d,用布氏漏斗过滤收集菌丝体,烘干,称质量。
1.2.4 井冈霉素、多菌灵和不动杆菌A2混用对水稻纹枯病菌的抑制作用 将不动杆菌A2在NA培养基上划线后,挑取单菌落于5 mL NA液体培养基中,28 ℃、120 r/min过夜培养。分别配制含有不同浓度井冈霉素、多菌灵的PDA培养基,将直径7 mm的水稻纹枯病菌菌块接种至中央,在距离菌块约2 cm处接种不动杆菌菌液,培养2 d后,以十字交叉法测量菌落直径,计算菌丝生长抑制率。以不动杆菌和纹枯病菌的混合接种及只接种纹枯病菌为对照,每个处理重复3次。
2 结果与分析
2.1 井冈霉素和多菌灵的毒力测定结果
由表1可见,井冈霉素对水稻纹枯病菌的毒力强于多菌灵,其EC50值为0.026 4 mg/L,而多菌灵的EC50值为 0.183 5 mg/L。测定2种药剂的EC90结果表明,两者的毒力相当,分别为0.440 8、0.459 0 mg/L,均可以用来防治水稻纹枯病。
2.2 井冈霉素和多菌灵对菌落形态的影响
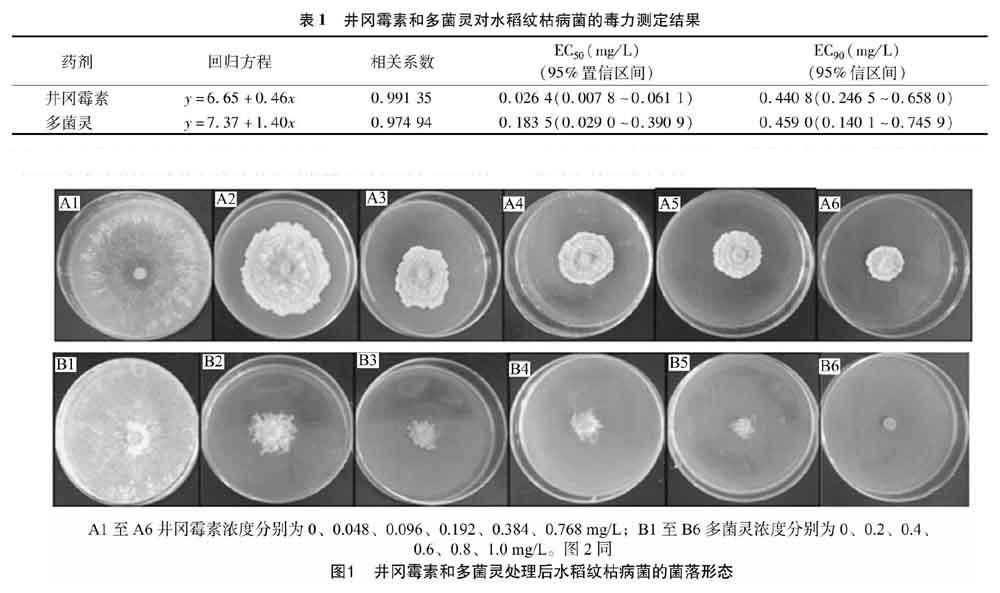
由图1中的A1至A6可以看出,在含有不同浓度井冈霉素的培养基上,水稻纹枯病菌生长缓慢,菌落边缘凹凸不平,菌丝更为密集,且随着浓度的增加菌落直径明显减小,甚至停止生长;而在对照培养基上,病菌生长良好,菌落形态规则。同样,由B1至B6可知,多菌灵也能够引起水稻纹枯病菌生长慢、菌落不规则和菌丝稀疏,但两者对水稻纹枯病菌菌落形态的影响明显不同。
2.2 井冈霉素和多菌灵对菌丝形态的影响
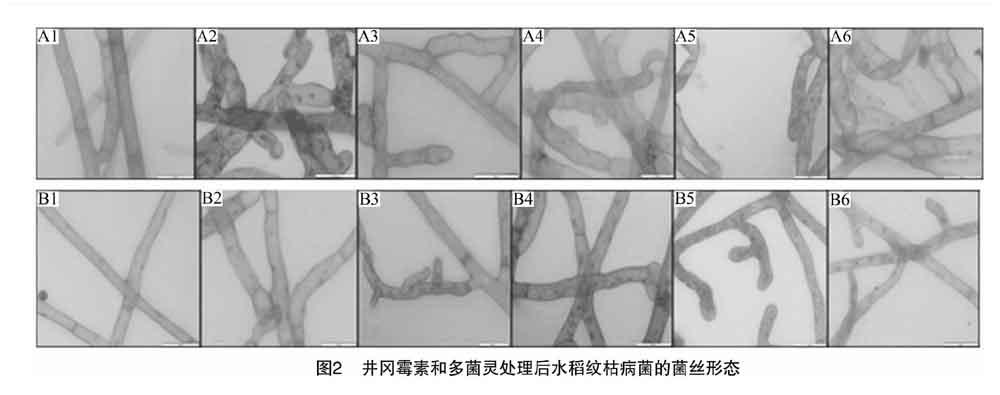
倒置显微镜观察结果发现,井冈霉素和多菌灵处理后的水稻纹枯病菌菌丝分支增多、弯曲、畸形肿大、原生质渗漏、细胞核分布不均匀等,而未经处理的水稻纹枯病菌菌丝细长、原生质均匀、节间距大(图2)。从菌丝形态来看,井冈霉素对水稻纹枯病菌菌丝的影响明显强于多菌灵。
2.3 井冈霉素和多菌灵对菌核和菌丝干质量的影响
由表2可知,随井冈霉素和多菌灵浓度增大,水稻纹枯病菌菌核和菌丝的干质量均明显下降。更重要的是,随药剂浓度增大,在单位面积培养基上的菌核数量却有所增加。研究还发现,井冈霉素在较低浓度时就可达到抑制菌核和菌丝生长的效果(数据略),这可能与井冈霉素抑菌效率较高有关系。
2.4 井冈霉素、多菌灵和不动杆菌A2混用对水稻纹枯病菌的抑制作用
由表3可知,不同浓度的井冈霉素和多菌灵与不动杆菌A2混合处理水稻纹枯病菌后,其抑制效果均高于井冈霉素、多菌灵和不动杆菌A2单独处理。0.768 mg/L井冈霉素与不动杆菌A2混合处理抑菌率高达94.23%,而且井冈霉素与不动杆菌A2混用的抑菌效果略高于多菌灵与A2混用的效果。
3 结论与讨论
目前,井冈霉素是防治水稻纹枯病高效、经济、与环境相容性较好的抗生素农药;多菌灵是苯并咪唑类杀菌剂,能够与病原真菌的微管蛋白相结合,抑制细胞的有丝分裂,可以用来防治水稻纹枯病。但由于长期单一使用井冈霉素,导致水稻纹枯病菌产生了较强的抗性[14-15]。为此,研究不同浓度的井冈霉素和多菌灵对水稻纹枯病菌生长发育的影响具有重要意义。本研究结果显示,井冈霉素和多菌灵均能抑制水稻纹枯病菌的生长,且井冈霉素防治效果要好一些,这与前人研究结果[16]基本一致。本试验结果还表明,随着井冈霉素和多菌灵浓度的增加,水稻纹枯病菌菌核和菌丝的干质量呈下降趋势,但单位面积菌核数量有所增加,这与杨媚等的研究结果[17]有所不同,这可能与水稻纹枯病菌的菌核形成机制有关。
关于多菌灵的防病机制研究比较成熟,普遍认为能够抑制病原菌的微管形成,从而导致病原菌不能增殖。而对于井冈霉素的防病机制则认为其不能杀死水稻纹枯病菌,但能抑制菌丝生长,导致菌丝畸形而影响其致病力,并可诱导水稻产生抗性防卫反应[18]。本试验结果证明了井冈霉素和多菌灵均能引起水稻纹枯病菌菌丝的畸形和缓慢生长,从而防治病害的发生,但其对水稻植株防卫反应的影响等还需进一步研究。同时,为了减轻和避免水稻纹枯病菌抗药性的产生,可以采取与生物防治相结合的方法。本研究结果表明,井冈霉素、多菌灵与不动杆菌A2混用后对水稻纹枯病菌的抑制作用均高于单独使用时的效果,与张科等的研究结果[19-21]基本一致,为更高效地防治水稻纹枯病奠定了理论基础。
总而言之,井冈霉素和多菌灵都可以用来单独防治水稻纹枯病,且前者的防病效果更好一些。而井冈霉素、多菌灵与不动杆菌A2混用后对水稻纹枯病菌的抑制作用均高于单独使用时的效果。笔者认为,对水稻纹枯病菌的综合防治已经刻不容缓,今后需要加大对其抗药性的动态监测、抑菌机制的探索以及多种杀菌剂混用的研究,进一步提高防治效果。
参考文献:
[1]徐桂红,吴息正,钱荣明,等. 几种药剂对水稻纹枯病防治效果的影响[J]. 现代农业科技,2015(3):112-113.
[2]余应龙,刘正鹏. 水稻纹枯病的危害癥状与综合防治[J]. 农技服务,2010,27(4):475-476.
[3]张楷正,李 平,李 娜,等. 水稻抗纹枯病种质资源、抗性遗传和育种研究进展[J]. 分子植物育种,2006,4(5):713-720.
[4]吴 婕,席亚东,李洪浩,等. 四川省水稻纹枯病菌对井冈霉素抗药性监测[J]. 西南农业学报,2015,28(6):2501-2504.
[5]许文耀,吕伟成,胡秀荣. 水稻纹枯病菌抗井冈霉素突变体的生物学特性[J]. 福建农林大学学报(自然科学版),2007,36(3):230-233.
[6]张 穗,郭永霞,唐文华,等. 井冈霉素A对水稻纹枯病菌的毒力和作用机理研究[J]. 农药学学报,2001,3(4):31-37.
[7]胥 川,赵春田,何文艳,等. 抗井冈霉素水剂蜡状芽孢杆菌的选育[J]. 浙江农业学报,2011,23(6):1187-1191.
[8]郑爱萍,李 平,王世全,等. 水稻纹枯病菌强拮抗菌B34的分离与鉴定[J]. 植物病理学报,2003,33(1):81-85.
[9]任小平,谢关林,王 笑. 铜绿假单胞菌ZJ1999对水稻纹枯病的防治及其在水稻上的定殖[J]. 中国生物防治,2006,22(1):54-57.
[10]农 倩,黎起秦,袁高庆,等. 内生细菌菌株B196与戊唑醇混配对水稻纹枯病的作用防治[J]. 农药,2010,49(11):838-841.
[11]陈志谊,刘永锋,陆 凡. 井冈霉素和生防菌Bs-916协同控病作用及增效机理[J]. 植物保护学报,2003,30(4):429-434.
[12]袁梦思,李建文,刘梦华,等. 1株不动杆菌发酵液对水稻纹枯病菌的抑菌作用[J]. 江苏农业科学,2016,44(2):164-165.
[13]孙建广,周 欣,肖佳雷,等. 一种便于丝状真菌显微观察的培养方法[J]. 植物生理学报,2014,50(2):229-232.
[14]张 穗,许文霞,薛银根,等. 郑州郊区水稻纹枯病菌对井冈霉素敏感性的初步研究[J]. 中国生物防治,1995,11(4):171-173.
[15]Bahuguna R N,Joshi R,Shukla A,et al. Thiamine primed defense provides reliable alternative to systemic fungicide carbendazim against sheath blight disease in rice (Oryza sativa L.)[J]. Plant Physiology and Biochemistry,2012,57:159-167.
[16]Peng D,Li S D,Wang J X,et al. Integrated biological and chemical control of rice sheath blight by Bacillus subtilis NJ-18 and jinggangmycin[J]. Pest Management Science,2014,70(2):258-263.
[17]楊 媚,杨迎青,李明海,等. 井冈霉素对水稻纹枯病菌生长发育的影响[J]. 华中农业大学学报,2012,31(4):445-449.
[18]Shibata M,Mori K,Hamashima M. Inhibition of hyphal extension factor formation by validamycin in Rhizoctonia solani[J]. The Journal of Antibiotics,1982,35(10):1422-1423.
[19]张 科,方中义,周永力. 井冈霉素和蜡质芽孢杆菌混剂防治稻曲病试验[J]. 种子世界,2016(4):38-39.
[20]Hu F,Su W H,Li C C,et al. Control efficacy of validamycin A·(0.2 billion spores/mL) Paenibacillus polymyxa DN-1 3%AS for rice sheath blight[J]. Agricultural Science&Technology,2016,17(11):2615-2618.
[21]彭双强,张 亚,廖晓兰,等. 拮抗细菌发酵提取物与井冈霉素混配对水稻纹枯病的毒力研究[J]. 湖南农业科学,2015(9):20-23. 彭 琦,张椿雨,费维新,等. 江苏省主栽油菜品种根肿病抗性鉴定及分子标记检测[J].

