Ca2+-磷脂依赖性蛋白激酶通路参与氨致星形胶质细胞水肿
贾桂枝 王蕊 岳怡 戴红良
(锦州医科大学 1生理学教研室,辽宁 锦州 121001;2第一临床学院2016级本科;3护理学院)
肝性脑病是引起肝病患者死亡的重要原因。通过尸体解剖与动物实验发现肝性脑病中发生的脑水肿、颅内高压及脑疝是导致死亡的病理基础〔1〕。人体磁共振成像研究显示肝性脑病脑水肿属细胞性水肿,即星形胶质细胞水肿〔2〕。研究证实在严重肝病时,机体不能对氨进行有效清除,导致患者脑组织氨浓度过度升高,从而引起星形胶质细胞水肿及肝性脑病的发生〔3,4〕。Ca2+是细胞内重要的第二信使分子,之前有研究发现,氨刺激星形胶质细胞后可导致细胞内Ca2+瞬时增加,进而引起星形胶质细胞水肿〔5〕。Ca2+-磷脂依赖性蛋白激酶通路是细胞内介导各种生理、病理效应的重要信号通路〔4〕。本文旨在探讨该通路是否介导氨引起的星形胶质细胞水肿,为进一步理解肝性脑病的发病机制提供依据。
1 材料与方法
1.1 主要实验试剂 DMEM培养基购自美国康宁公司;马血清购自Gibco公司;dBcAMP购自美国Sigma公司;Calcein/AM荧光探针购自美国Invitrogen公司;表皮生长因子受体(EGFR)抗体购自美国Cell Signaling公司;细胞外调节蛋白激酶(ERK)及磷酸化(p)-ERK购自美国Santa Cruz公司;磷脂酶(PL)C抗体购自美国Abcam公司。
1.2 原代星形胶质细胞培养及分组 取出生24 h内的CD-1小鼠大脑皮层,在显微镜下剥离脑膜及血管后,将脑组织切碎,加入含20%马血清的DMEM培养液中,旋涡震荡1 min。将组织悬液先后用孔径为80 μm和10 μm的滤膜过滤。将所得到的细胞悬液接种到铺有盖玻片的24孔培养板或60 mm培养皿中,培养液为含7.5 mmol/L葡萄糖的 DMEM培养基,最初加20%马血清,置于37℃,5% CO2培养箱中培养。每周换液2次,第1周为含20%马血清的DMEM培养液,第2周为10%马血清的DMEM培养液,第3周在培养液中加0.25 mmol/L dBcAMP促进细胞分化成熟。将培养成熟的星形胶质细胞分为对照组、氧化铵组、U73122+氯化铵组、BAPTA+氯化铵组、BGF 109203X+氯化铵组、AG1478+氯化铵组。
1.3 荧光探针技术测定细胞体积 将盖玻片上培养成熟的星形胶质细胞以5 μmol/L Calcein 37℃避光孵育30 min,然后吸弃荧光染料,再用等渗液洗涤细胞2次,以除去细胞外未负载的荧光探针。最后,将细胞置于活细胞荧光显微镜载物台上,检测细胞内Calcein荧光强度(激发波长和发射波长分别为490和535 nm),以间接反映细胞体积水平。
1.4 免疫凝胶电泳及免疫印迹分析 将含有0.1%苯甲基磺酰氟(PMSF)的RIPA裂解液加入培养皿中以获得全细胞裂解物并利用聚氰基丙烯酸正丁酯(BCA)法进行蛋白定量。将等量蛋白行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并电转印至聚偏氟乙烯(PVDF)膜上。PVDF膜依次经5%脱脂牛奶封闭,一抗4℃过夜孵育和二抗室温2 h孵育后,利用增强化学发光法显色。利用ImageJ 1.42软件对条带灰度进行分析,从而半定量确定各组蛋白的相对表达水平。
1.5 免疫共沉淀 用免疫共沉淀裂解液收集样品并匀浆。将1 mg蛋白与特异性一抗于4℃、垂直旋转状态下过夜孵育。次日,将protein G加入上述体系继续孵育2 h。随后,经磷酸盐缓冲液(PBS)洗涤后,将获得的免疫沉淀物与上样缓冲液混合,100℃变性5 min后,13 000 r/min离心5 s取上清,后续用于SDS-PAGE电泳及蛋白质免疫印迹分析。
1.6 细胞内Ca2+瞬变检测 将5 μmol/L Fura-2 Ca2+荧光探针与盖玻片上培养成熟的星形胶质细胞共同避光孵育30 min,充分去除细胞外未负载的荧光探针后,在340和380 nm激发波长,510 nm发射波长下,检测细胞内Ca2+水平。
1.7 统计学分析 采用SPSS17.0统计软件进行t检验及单因素方差分析。
2 结 果
2.1 U73122、BAPTA、GF109203X抑制氨诱导的星形胶质细胞水肿 与对照组(1.00±0.04)相比,氯化铵组(1.48±0.17)星形胶质细胞相对体积明显增加(P<0.05);与氯化铵组比较,U73122+氯化铵组、BAPTA+氯化铵组、GF109203X+氯化铵组(0.98±0.09、1.02±0.14、0.99±0.10)显著降低(P<0.05)。
2.2 U73122及AG1478抑制氨诱导的细胞内Ca2+瞬时增加 与对照组比较,氯化铵组细胞内Ca2+(340/380峰值:0.66±0.07)瞬时增加,而U73122+氯化铵组及AG1478+氯化铵组(0.41±0.07、0.41±0.03)显著低于氯化铵组(均P<0.05),见图1。
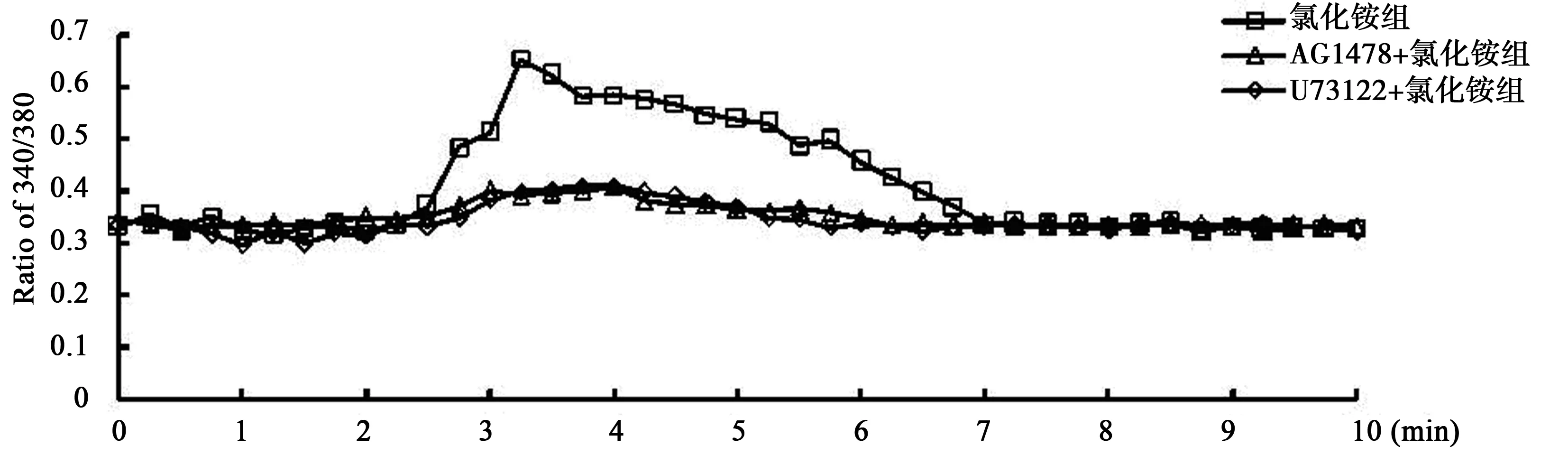
图1 各抑制剂对星形胶质细胞内Ca2+水平的影响
2.3 氨刺激增加PLC与EGFR的结合 与对照组(1.00±0.11)相比,氯化铵组EGFR/PLC(1.82±0.26)显著增加(P<0.05),见图2。
2.4 GF109203X抑制氨诱导的ERK磷酸化 与对照组(1.00±0.12)相比,氨刺激显著增强ERK的磷酸化(1.87±0.16,P<0.05)。与氯化铵组相比,GF109203X组和GF109203X+氯化铵组(0.98±0.05、1.00±0.12)显著降低(P<0.05),见图3。

图2 氨对星形胶质细胞EGFR/PLC结合的影响

图3 GF109203X对星形胶质细胞ERK磷酸化的影响
3 讨 论
EGFR属于ErbB受体酪氨酸激酶家族。该家族包含4个密切相关的成员,即ErbB1/EGFR、ErbB2、ErbB3和ErbB4。在静息状态下,EGFR以非活化的形式表达于胞质膜。当受到体内外环境中各种因素的刺激后,某些激酶和(或)其特异性配体(该配体往往源于对跨膜前体的蛋白水解释放)可诱导EGFR的间接激活。激活后的EGFR导致同源或异源二聚体的形成,进而刺激其内源性酪氨酸激酶活性,导致其胞质结构域内特定酪氨酸残基的磷酸化,最终导致下游信号级联的激活〔5〕。因为EGFR在肿瘤发生发展中起重要作用,故目前对EGFR的研究主要集中于肿瘤领域〔6〕。前期研究显示EGFR间接激活介导的丝裂原活化蛋白激酶(MEK)/ERK和磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号级联在氨诱导星形胶质细胞过程中也起到了至关重要的作用〔7,8〕。除MEK/ERK和PI3K/AKT信号级联外,Ca2+-磷脂依赖性蛋白激酶通路也是传递EGFR活化信号的重要机制〔9〕。细胞内Ca2+水平的增加是氨引起星形胶质细胞水肿的重要机制之一。Ca2+诱导水肿的机制与其激活Ca2+依赖性的、促进活性氧氮簇(RONS)生成的酶类有关。这些酶包括还原型辅酶Ⅱ氧化酶(NADPH)、组成型一氧化氮合酶、磷脂酶A2等〔3〕。本研究发现,Ca2+-磷脂依赖性蛋白激酶通路各关键分子的抑制剂U73122(针对PLC)、BAPTA(针对Ca2+)、GF109203X(针对PKC)均可显著抑制氨诱导的星形胶质细胞水肿,同时,氨诱导的细胞内Ca2+升高可被U73122所抑制,表明该通路的激活参与了氨诱导星形胶质细胞水肿的过程。
此外,本文还表明在高氨毒性状态下,Ca2+-磷脂依赖性蛋白激酶通路的激活与EGFR间接激活有关。本研究结果显示,氨刺激可增加EGFR免疫沉淀物中PLC的水平,表明氨的确有可能促进EGFR与PLC的相互作用。前期研究已显示,高浓度氨可刺激各信号复合物Na/K-ATP酶α1、EGFR、Src、ERK、AKT在星形胶质细胞胞质膜内陷形成的细颈瓶状特殊膜结构小窝(caveolae)中的集装,进而导致相关分子的活化〔7〕。本研究进一步证实,PLC也可能通过加入上述信号复合物介导下游分子的激活。
研究显示,在β肾上腺素受体诱导心肌细胞肥大〔10〕及P2X7受体介导神经前体细胞神经元分化〔11〕等过程中也存在PKC作为上游分子激活ERK的机制〔12,13〕。Ca2+-磷脂依赖性蛋白激酶通路可作为ERK的上游信号分子介导氨诱导细胞水肿的过程。

