CARMA3在宫颈癌组织中的表达及相关性
朱佩茹 杨喆 杨丽云 李海燕 李小红 李荣丽
(河南省人民医院妇产科,河南 郑州 450003)
宫颈癌是女性最高发的恶性肿瘤之一〔1,2〕。根治性手术及放疗可显著延长患者生存期〔3〕,但其病因不清楚,新的治疗靶点仍有待研究。CARMA3是新型接头蛋白,在G蛋白耦联受体(GPCR)激活核因子(NF)-κB通路过程中发挥重要作用〔4〕。然而CARMA3在宫颈癌中的表达及临床意义尚不清楚。本研究拟分析CARMA3在宫颈癌组织中的表达及其与宫颈癌患者临床病理特征及生存的关系。
1 资料与方法
1.1 对象 收集2009年1月至2012年12月于河南省人民医院妇产科接受宫颈癌根治术且术后病理显示为宫颈癌患者的肿瘤组织及癌旁组织标本45例,≤40岁28例,>40岁17例;肿瘤直径>4 cm 25例,≤4 cm 20例;分化程度:低分化18例,中/高分化27例;淋巴结转移19例;国际妇产科协会(FIGO)分级:Ⅰ~Ⅱ级21例,Ⅲ~Ⅳ级24例。组织标本收取后蜡块包埋储存于病理科。入组患者在术后3个月后开始随访记录,术前均未进行放疗、化疗。本研究经河南省人民医院伦理委员会审核批准,入组患者均签署知情同意书。
1.2 材料 反转录、RNA提取试剂盒、实时定量聚合酶链反应(QPCR)试剂盒购于天根生化科技有限公司。液氮灌、细胞培养箱购于美国Thermo公司,PCR仪购于美国ABI公司,高速离心机购于德国Eppendorf公司。
1.3 生物信息学分析 利用GEPIA网站(http://gepia.cancer-pku.cn/) 分析医学癌症数据库(TCGA)中宫颈鳞状细胞癌及癌旁组织中CARMA3〔即含有半胱天冬酶募集域的蛋白(CARD)10〕的表达,并分析CARMA3的表达与宫颈癌患者预后的关系。
1.4 RNA提取及反转录 石蜡组织RNA提取方法按说明书进行,石蜡切片加入1 ml裂解液裂解呈透明状,12 000 r/min,4℃离心5 min,上清转至一新离心管中,加入裂解液1/5体积的氯仿,用力振荡至充分乳化,12 000 r/min,4℃离心15 min,吸取上清液至一新的离心管中,加入等体积异丙醇,上下颠倒15次,静置10 min,12 000 r/min,4℃离心15 min,弃去上清,加入75%的乙醇 1 ml,12 000 r/min,4℃离心5 min。所得沉淀加入20 μl去离子水,即为所需RNA。反转录采用10 μl体系,RNA定量后,取1 μl RNA,加入5倍PrimeScript RT master 2 μl,7 μl去离子水。轻柔混匀后进行反转录反应,反应条件:37℃ 15 min,85℃ 5 s,4℃。
1.5 QPCR 采用天根试剂盒进行实时定量PCR,配置PCR反应液,PCR反应采用25 μl体系,组分如下:SYBR premix Ex TaqⅡ 12.5 μl,CARMA3或β-actin正义链引物1 μl,CARMA3或β-actin反义链引物1 μl,实时定量产物2 μl,去离子水8.5 μl。PCR反应条件:预变性 95℃ 30 s;扩增95℃ 15 s,60℃ 30 s,共40个循环。反应结束后样品4℃保存。CARMA3引物正义序列:5′-TCTTCCACCGTTGCCAATCT-3′;反义序列:5′-TTCGCCTGCCAGGAACATC-3′。β-actin引物正义序列:5′-CGTCTTCCCCTCCATCGT-3′;反义序列为:5′-GAAGGTGTGGTGCCAGATTT-3′。 CARMA3相对表达量用2-ΔΔCt表示,ΔΔCT=(CT CARMA3-CT β-actin) 待测样本-(CT CARMA3-CT β-actin) 校准样本。
1.6 统计学方法 采用SPSS22.0进行t检验、Spearman秩相关分析及Kaplan-Meier(K-M)生存曲线分析。
2 结 果
2.1 TCGA中CARMA3在宫颈癌组织中的表达 CARMA3在306例宫颈癌组织中的表达水平为3.277±2.713,13例正常宫颈组织中的表达水平为2.745±0.471,差异无统计学意义(t=0.510 9,P=0.105)。CARMA3高表达的宫颈癌患者(146例)生存周期低于低表达者(146例),但差异无统计学意义(P=0.68,HR=0.91),见图1。
2.2 宫颈癌及癌旁组织中CARMA3 mRNA的表达 宫颈癌组织中CARMA3 mRNA表达水平为6.367±3.384,癌旁组织为1.617±0.689,差异有统计学意义(t=4.311,P=0.017)。
2.3 CARMA3的表达与宫颈癌患者临床病理特征的关系 根据CARMA3在宫颈癌中的相对表达水平,利用X-tile软件确定最佳分界点为5.143,将宫颈癌患者分为CARMA3高表达组(n=27)及低表达组(n=18),Spearman秩相关分析结果显示,CARMA3的表达水平与宫颈癌患者FIGO分级(Ⅰ~Ⅱ级高表达7例,Ⅲ~Ⅳ级20例;r=0.814,P=0.013)、淋巴结转移情况(有转移高表达19例,r=0.768,P=0.019,表1)呈正相关,而与年龄(≤40岁高表达16例,>40岁11例)、肿瘤直径(>4 cm高表达14例,≤4 cm 13例)、分化程度(低分化高表达12例,中/高分化15例)无相关性(P>0.05)。
2.4 CARMA3的表达与宫颈癌患者术后5年总体生存率的关系 CARMA3高表达组术后5年总体生存率显著低于低表达组(χ2=4.306,P=0.038,图2)。
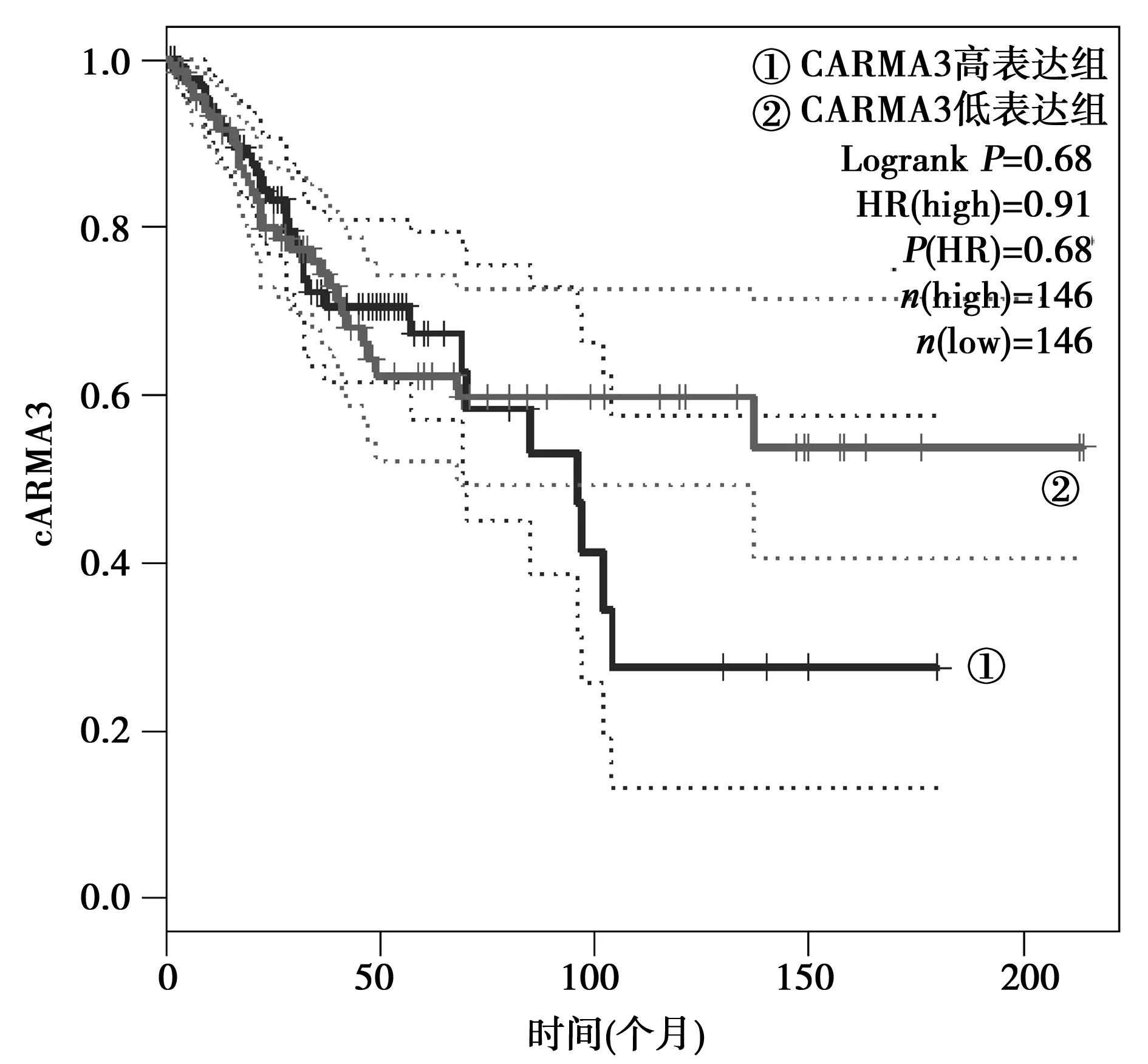
图1 TCGA中CARMA3在宫颈癌中的表达
3 讨 论
生物信息学是生命科学研究的重要工具〔5〕。由于TCGA数据来源于各文章中所提供的测序数据,因此样本间差异较大,很难在统计学上获得较为理想的结果。此外,因TCGA的数据多来源于欧美,研究对象病理特征与我国宫颈癌患者存在较大差异。
CARMA3作为细胞支架蛋白,可在表皮生长因子受体(EGFR)和GPCR的诱导下,与下游信号分子B细胞淋巴瘤因子(Bcl)10和黏膜相关淋巴组织因子(MALT)1组成复合体,并进一步活化I-κB激酶(IKK)〔6〕。而在IKK的诱导下,I-κB降解,从而活化NF-κB〔4,7〕。既往研究显示,宫颈癌进展过程中NF-κB信号通路持续性活化〔8〕。而NF-κB的表达水平与宫颈癌的分级亦呈正相关〔9〕,提示NF-κB在宫颈癌进展过程中扮演癌基因的角色。Nair等〔10〕研究发现,在宫颈组织从正常到癌前病变再到癌组织的过程中,NF-κB在细胞核中的表达呈现逐渐升高的趋势。研究显示,NF-κB与信号转导和转录激活因子(STAT)3、Sma和Mad相关蛋白(SMAD)3等转录因子之间存在复杂的调控机制〔11〕。NF-κB与STAT协同作用而调控大量的抗凋亡基因、细胞周期调控基因、编码细胞因子及趋化因子基因〔12〕。此外,NF-κB通过活化环氧化酶(COX)-2而促进宫颈癌淋巴结转移及放疗抵抗〔13〕。因此推测CARMA3可能通过NF-κB,并激活NF-κB下游信号通路,从而促进肿瘤细胞转移及进展。
综上,CARMA3在宫颈癌组织中表达上调,并与宫颈癌FIGO分级及淋巴结转移情况相关,是宫颈癌潜在的分子治疗靶点。

