响应面法优化牡丹花化学成分提取工艺的研究
崔莉 赵恒强 耿岩玲 王志伟 王晓 闫慧娇


摘要:为了确定牡丹花化学成分提取的最佳工艺条件,从化学成分的稳定性和操作的便捷性考慮,用超声法对牡丹花的提取工艺进行研究。以液相色谱图中14个共有峰的总峰面积为指标,分别考察超声提取时间、乙醇浓度、液料比对牡丹花多种化学成分共同提取效果的影响,用响应面法优化牡丹花的超声提取工艺。结果表明,乙醇浓度对牡丹花提取效果的影响最大,其次是液料比与超声时间,用响应面法优化得到牡丹花超声提取的最适工艺条件如下:乙醇浓度为 60.92%,液料比为86.21 mL ∶1 g,超声时间为24.34 min。通过验证试验发现,在此最佳提取条件下,色谱图中共有峰峰面积的总和与预测值相近,可见通过响应面优化得到的牡丹花化学成分提取工艺稳定、可行。
关键词:牡丹花;提取工艺;超声法;响应面法;Box-Behnken设计
中图分类号: R284.2文献标志码: A
文章编号:1002-1302(2019)08-0212-05
牡丹(Paeonia suffruticosa Andr.)为毛茛科芍药属灌木,有“富贵花”和“花中之王”的美称,是中华民族传统文化的重要组成部分,享有“国花”的盛誉[1]。牡丹花在我国有悠久的药用和食用历史,《四川中药志》中记载:牡丹花性平、苦、淡,具有调经活血的功能,主治月经不调、痛经[2]。明代的《遵生八菚》中曾记载:“牡丹新落花瓣亦可煎食”。清代的《养小录》中记载:“牡丹花瓣,汤淖可,蜜浸可,肉汁烩亦可”,2013年,丹凤牡丹花被中华人民共和国国家卫生和计划生育委员会(现为中华人民共和国国家卫生健康委员会)批准为新食品原料[3],是我国宝贵的天然植物资源。然而,在传统的牡丹产业中,牡丹花常被当作废弃物丢弃,造成巨大的浪费。
牡丹花中的活性成分种类较多,含量丰富,现代研究证明,这些成分具有活血、杀菌、抗氧化等多种活性[4-7]。在前期研究中,笔者对牡丹花的化学成分进行了系统分离,发现其次生代谢产物主要包括黄酮类、没食子酸类、鞣质类及其芍药苷类单萜苷类化合物[8-11]。而目前有关牡丹花化学成分提取的研究多针对黄酮类,且以总黄酮提取率作为方法优劣的判断标准[12-15],无法为全面表征牡丹花的生物活性物质基础,从而从整体上评价牡丹花的质量提供参考。响应面设计(response surface methodology,简称RSM)是一种有效的统计和优化方法,在试验条件优化的过程中可以连续地对试验因素的各个水平进行分析,并能给出直观的图形[16-21]。笔者在前期对牡丹花的化学成分研究的基础上,对其主要化学成分进行了辨认,并以液相色谱中的共有峰(包括黄酮类、没食子酸、鞣质类、芍药苷)的总峰面积为响应值,运用Design-Expert软件进行响应面Box-Behnken设计,对牡丹花提取工艺进行优化,拟为牡丹花资源的综合开发利用及质量控制提供理论依据。
1材料与方法
1.1仪器与材料
Agilent 1120型高效液相色谱仪[配有二极管阵列(DAD)检测器、自动进样器,美国Agilent公司];KQ3200超声波清洗器(昆山超声仪器有限公司);JJ1000型电子天平(常熟市双杰测试仪器厂)。
牡丹花采自山东菏泽,于2017年4月采收新鲜丹凤牡丹的花瓣,于50 ℃热风烘干,粉碎过40目筛,在山东省分析测试中心实验室的干燥器内避光保存。主要试剂如下:乙醇,分析纯,购自德州恒业化工有限公司;甲醇、乙腈,色谱纯,购自山东禹王试剂有限公司;甲酸,色谱纯,购自德国Riedel公司;其余试剂均为分析纯。试验用水为超纯水。对照品芍药苷、野漆树苷、紫云英苷,购自中国食品药品检定研究院;1-O-galloyl-β-D-glucopyranose(1-O-没食子酰基-β-D葡萄糖)、1,2,3,4,6-penta-O-galloyl-β-D-glucopyranose(1,2,3,4,6-O-五没食子酰基-β-D葡萄糖)、kaempferol-3,7-di-O-β-D-glucopyranoside(山柰酚-3,7-二-O-β-D-吡喃葡萄糖苷)、没食子酸、没食子酸甲酯、大波斯菊苷、二氢山柰酚-7-O-β-D-吡喃葡萄糖苷、氧化芍药苷由笔者所在实验室分离、纯化后,经核磁、质谱、红外、紫外鉴定,纯度均达99%(相对纯度)以上。
1.2试验方法
1.2.1对照品溶液的制备分别取适量1-O-没食子酰基-β-D葡萄糖、没食子酸、氧化芍药苷、没食子酸甲酯、二氢山柰酚-7-O-β-D-吡喃葡萄糖苷、山柰酚-3,7-二-O-β-D-吡喃葡萄糖苷、芍药苷、1,2,3,4,6-O-五没食子酰基-β-D葡萄糖、野漆树苷、紫云英苷、大波斯菊苷这11种对照品,加甲醇配制成质量浓度分别为45.5、45.2、60.0、25.3、25.4、60.0、720.0、61.0、101.0、60.0、81.2 mg/L的混合对照品溶液。
1.2.2液相色谱条件采用高效液相色谱法(high performance liquid chromatography,简称HPLC),色谱柱采用Micro C18柱(250 mm×4.6 mm,5 μm)。以0.1%甲酸 (A)- 乙腈(B)溶液为流动相进行梯度洗脱:0~5 min,5% B;5~8 min,5%~12% B;8~23 min,12% B;23~24 min,12%~15% B;24~30 min,15% B;30~31 min,15%~21% B;31~38 min,21% B;38~39 min,21%~22% B;39~48 min,22% B;48~53 min,22%~34% B;53~63 min,34% B;63~64 min,34%~90% B;64~69 min,90% B;流量为 1.0 mL/min;进样量为10 μL,检测波长为270 nm。
1.2.3牡丹花瓣提取方法的选择精确称取10份牡丹花瓣粉末,每份0.50 g,置于具塞錐形瓶中,各加入50 mL溶剂,称定质量,其中5份样品分别用50%乙醇于65 ℃浸提0.5、1.0、1.5、2.0、2.5 h,另外5份样品分别用50%乙醇超声提取5、10、30、50、70 min。提取后静置至室温,称量并补足至提取前的质量,用0.45 μm微孔滤膜过滤,取滤液,按照“1.2.2”节的方法进样检测。
1.2.4牡丹花瓣超声提取法的工艺流程精确称取10份牡丹花瓣粉末,每份0.50 g,置于具塞锥形瓶中,加入50 mL不同浓度的乙醇,称质量,超声提取(250 W,40 kHz),冷却至室温,称量并补足至提取前的质量,摇匀。用0.45 μm微孔滤膜过滤,作为供试品溶液。
1.2.5牡丹花瓣超声提取工艺参数的单因素试验分别考察不同超声提取时间(10、20、30、40、50 min)、乙醇浓度(20%、40%、60%、80%、100%)和液料比(20 mL ∶1 g、50 mL ∶1 g、100 mL ∶1 g、200 mL ∶1 g、500 mL ∶1 g)对牡丹花瓣提取效率的影响。
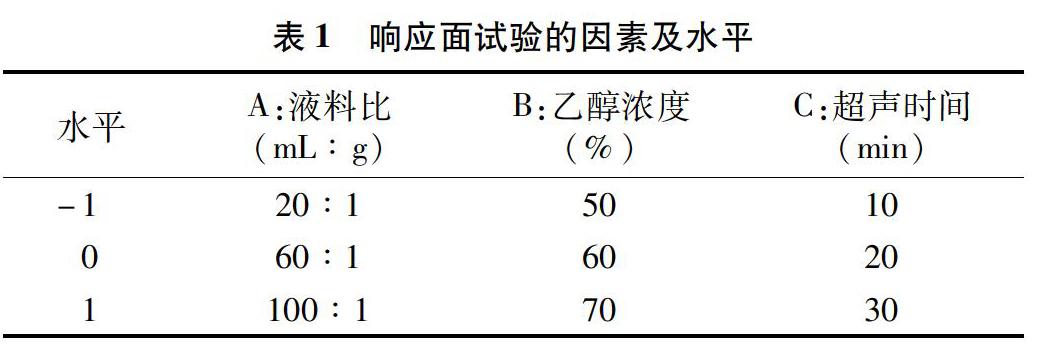
1.2.6响应面法优化牡丹花超声提取工艺试验在单因素试验的基础上,确定液料比、乙醇浓度和超声时间3个因素的水平,用Design-Expert 8.0.6软件进行Box-Behnken响应面设计和数据分析。具体试验因素与各水平设计见表1。
2结果与分析
2.1牡丹花化学成分的分析
在前期对牡丹花化学成分进行系统分离的基础上,通过与对照品进行高效液相色谱比对,对其化学成分进行了分析,共确定14个共有峰中的11个成分,图1中的1号峰为1-O-galloyl-β-D-glucopyranose,2号峰为没食子酸,3号峰为氧化芍药苷,4号峰为没食子酸甲酯,5号峰为二氢山柰酚-7-O-β-D-吡喃葡萄糖苷,6号峰为kaempferol-3,7-di-O-β-D-glucopyranoside,7号峰为芍药苷,9号峰为1,2,3,4,6-penta-O-galloyl-β-D-glucopyranose,11号峰为野漆树苷,12号峰为紫云英苷,13号峰为大波斯菊苷。
2.2牡丹花瓣化学成分提取方法的选择
选择色谱图中信噪比(S/N)>30的14个共有峰作为评价指标,以50%乙醇超声处理20 min的单位样品峰面积为1,计算不同处理方法下样品的共有峰峰面积提取率,并进行比较。从图2可以看出,不同提取方法对各共有峰的峰面积影响不明显,超声法提取率稍高于温浸法,9号峰的峰面积提取率在20 min、1 h最高,但是随着提取时间的延长,提取率反而下降,而1、2号峰则相反。通过与对照品图谱对应保留时间(图1-a)的对比可初步推测,1号峰为1-O-galloyl-β-D-glucopyranose,2号峰为没食子酸,9号峰为1,2,3,4,6-penta-O-galloyl-β-D-glucopyranose,可能由于提取时间的延长,部分没食子酰鞣质发生水解,生成没食子酸或没食子酰基葡萄糖。从总体上看,超声法用时较短,考虑到操作的便捷性,选择超声法作为牡丹花化学成分的提取方法。
2.3牡丹花瓣超声提取工艺参数的单因素试验
2.3.1液料比对提取效果的影响固定超声时间为20 min,乙醇浓度为60%,选择液料比20 mL ∶1 g、50 mL ∶1 g、100 mL ∶1 g、200 mL ∶1 g、500 mL ∶1 g进行试验。以色谱图中S/N>30的14个共有峰总峰面积为评价指标,由图3-a可以看出, 随着液料比的增加,共有峰的总峰面积逐渐增加,当液料比大于100 mL ∶1 g时,共有峰的总峰面积增势变缓,提取趋于完全,考虑到成本及后处理,选择100 mL ∶1 g作为较优的液料比。
考虑到在提取过程中会发生部分没食子酰鞣质水解生成没食子酸或没食子酰基葡萄糖的反应,这几种成分的含量变化可反映不同参数条件对牡丹花化学成分提取效果的综合影响,因此同时选择1,2,3,4,6-penta-O-galloyl-β-D-glucopyranose(9号峰)、没食子酸(2号峰)的峰面积比值(峰9/峰2)作为评价指标,进一步考察单因素试验的提取效果。图3-b结果显示,液料比对两峰比值有一定的影响,随着液料比的增加,两峰面积比值逐渐提高,当液料比大于 100 mL ∶1 g 时,两峰面积比值逐渐降低。
2.3.2乙醇浓度对提取效果的影响固定液料比为 100 mL ∶1 g,超声时间为20 min,选择20%、40%、6%、80%、100%的乙醇浓度对牡丹花进行提取试验。以色谱图中S/N>30的14个共有峰总峰面积为评价指标,由图4-a可以看出,当乙醇浓度为60%时,共有峰的总峰面积达到峰值;当乙醇浓度为80%时,提取效果又有所减弱。因此,选择60%为最优乙醇浓度。从9号峰、2号峰的峰面积比值来看,使用不同比例的溶剂提取时,对两者的提取效率不同,当乙醇浓度为80%时,化合物9、化合物2的峰面积比值最大(图4-b),推测是由于2种化合物的极性不同造成的。
2.3.3超声提取时间对提取效果的影响固定液料比为100 mL ∶1 g,乙醇浓度为60%,选择超声时间为10、20、30、40、50 min 进行试验。以色谱图中S/N>30的14个共有峰总峰面积为评价指标,由图5-a可以看出,超声20 min后,总峰面积趋于平稳,基本实现了提取完全,50 min时则略有下降,可能由于超声时间过长,导致提取温度升高,牡丹花内的部分化学成分发生了降解。由图5-b可以看出,9号峰、2号峰的峰面积比值呈现先提高后降低的趋势,超声提取20 min后,随着提取时间的延长,峰面积比值下降,部分没食子酰鞣质发生水解,生成没食子酸或没食子酰基葡萄糖。为更好地保持牡丹花化学成分的稳定,同时节约能源,选择20 min为最优超声时间。
2.4响应面法优化牡丹花化学成分的超声提取工艺试验
根据Box-Behnken的组合设计原理,用Design-Expert 8.0.6软件设计3因素3水平共15个试验,中心点重复3次试验,以色谱图中S/N>30的14个共有峰的总峰面积为响应值(R),具体试验设计方案与结果见表2。
用Design-Expert 8.0.6软件对表2中的综合评价数据进行二次多元回归拟合,得到回归方程:R=14 138.40+105.25[KG*3]×[KG*3]A+[KG*3]243.13[KG*9]×B+22.63×C-5.75×AB+13.75×AC+2.50×BC-84.45×A2-1 296.20×B2-36.20×C2。由表3的回歸模型方差分析结果可知,一次项A、B、C,二次项A2、B2、C2对提取效果有极显著影响。本试验模型的P<0.01,说明响应面的模型显著性较高,而失拟误差项的P>0.05,说明响应面模型对试验拟合的情况较好,试验误差较小,可以很好地对牡丹花超声提取效果进行分析和预测。
响应面曲面可较直观地反映各因素及两两因素的交互作用对响应值的影响。由图6可以看出,乙醇浓度对牡丹花提取效果的影响最大,其次是液料比,超声时间对牡丹花提取效果的影响最小。液料比与超声时间的交互作用对牡丹花提取效果的影响较大,其次为液料比与乙醇浓度的交互作用,乙醇浓度与超声时间的交互作用影响最不明显。
2.5验证试验
用Design-Expert 8.0.6软件优化得到牡丹花超声提取的最佳工艺如下:液料比为86.21 mL ∶1 g,乙醇浓度为 60.92%,超声时间为24.34 min,在此条件下总共有峰面积的预测值为14 189。为验证响应面法所得结果的可靠性,对模型[CM(25]优化的工艺条件进行验证。考虑到试验的可行性与便捷性,选择液料比86 mL ∶1 g、乙醇浓度61%、超声时间24 min进行3次试验。由表4的验证结果可以看出,方程与真实试验情况拟合得较好,优化的工艺可靠、可行。
3结论与讨论
由于响应面法是在单因素试验的基础上得到相应的点,并从这些点中获得1个完整、连续的面,再在此面中获得最优值。因此,在响应面整体设计中,单因素试验中变量参数的选择显得格外关键。本研究先通过单因素试验选取提取时间、乙醇浓度、液料比3个工艺变量合适的参数水平。由于牡丹花中含有的芍药苷等单萜苷类化合物及一些易水解的鞣质类化合物对温度较为敏感,在高温下稳定性较差,不宜使用高温浸提,与本试验中提取方法初筛的结果相一致,并且超声法具有提取效率高、操作简单、节能等优点,可作为较优的牡丹花提取方法。
本研究使用3因素3水平的响应面分析法对牡丹花超声提取工艺的提取时间、乙醇浓度、液料比进行考察,获得的最佳提取工艺条件为乙醇浓度60.92%、液料比86.21 mL ∶1 g、超声时间24.34 min,并通过验证试验证明了该条件参数的可行性,在该条件下,牡丹花化学成分的提取更为全面、充分,可用于牡丹花质量的综合评价,并可为牡丹的综合利用、开发提供依据。
参考文献:
[1]任崇勇,程德海. 菏泽牡丹资源开发利用现状及发展对策[J]. 现代农业科技,2013(22):316-322.
[2]江苏新医学院. 中药大辞典(上册)[M]. 上海:上海人民出版社,1977:1130.
[3]国家卫生计生委. 关于批准祼藻等8种新食品原料的公告 (2013年第10号)[Z]. (2013-11-26)[2017-10-11]. http://www.nhfpc.gov.cn/sps/s7890/201311/533ed8492dd04ff3a a63c7e7dd40c256.shtml.
[4]Huang W S,Mao S Q,Zhang L Q,et al. Phenolic compounds,antioxidant potential and antiproliferative potential of 10 common edible flowers from China assessed using a simulated in vitro digestion-dialysis process combined with cellular assays[J]. Journal of the Science of Food and Agriculture,2017,97(14):4760-4769.
[5]Zhang H F,Li X F,Wu K,et al. Antioxidant activities and chemical constituents of flavonoids from the flower of Paeonia ostii[J]. Molecules,2017,22(1):5-20.
[6]Li C H,Du H,Wang L S,et al. Flavonoid composition and antioxidant activity of tree peony (Paeonia section Moutan) yellow flowers[J]. Journal of Agricultural and Food Chemistry,2009,57(18):8496-8503.
[7]Ogawa K,Nakamura S,Sugimoto S,et al. Constituents of flowers of Paeoniaceae plants,Paeonia suffruticosa and Paeonia lactiflora[J]. Phytochemistry Letters,2015,12:98-104.
[8]史国安,郭香凤,包满珠. 不同类型牡丹花的营养成分及体外抗氧化活性分析[J]. 农业机械学报,2006,37(8):111-114.
[9]闫慧娇,赵伟,耿岩玲,等. 牡丹花化学成分研究[J]. 天然产物研究与开发,2015,27(12):2056-2059.
[10]赵伟,耿岩玲,崔莉,等. 牡丹花黄酮类化学成分研究[J]. 中国现代中药,2016,18(3):303-306.
[11]闫慧娇,王志伟,陈燕平,等. 凤丹牡丹花瓣化学成分研究[J]. 山东科学,2017,30(3):12-16.
[12]高燕,杨品珍,马银海. 超声波提取红牡丹色素的工艺研究[J]. 食品研究与开发,2014(5):41-43.
[13]王晓,江婷,程传格,等. 超声波强化提取牡丹花黄酮[J]. 山东科学,2004,17(3):13-16.
[14]王晓,耿岩玲,李福伟,等. 酶法提取牡丹花总黄酮[J]. 山东科学,2005,18(4):14-17.
[15]袁亚光,王成忠,饶鸿雁. 牡丹花中黄酮类化合物的研究进展[J]. 山东轻工业学院学报(自然科学版),2013,27(4):31-34,38.
[16]Khajeh M. Response surface modelling of lead pre-concentration from food samples by miniaturised homogenous liquid-liquid solvent extraction:Box-Behnken design[J]. Food Chemistry,2011,129(4):1832-1838.
[17]Maran J P,Manikandan S,Priya B,et al. Box-Behnken design based multi-response analysis and optimization of supercritical carbon dioxide extraction of bioactive flavonoid compounds from tea (Camellia sinensis L.) leaves[J]. Journal of Food Science and Technology - Mysore,2015,52(1):92-104.
[18]Zhang J J,Wei Y L,Li H Z,et al. Application of Box-Behnken design to optimize multi-sorbent solid phase extraction for trace neonicotinoids in water containing high level of matrix substances[J]. Talanta,2017,170:392-398.
[19]金林,赵万顺,郭巧生,等. 响应面法优化白芍提取工艺的研究[J]. 中国中药杂志,2015,40(15):2988-2993.
[20]王正宽,石晓朦,刘圆,等. Box-Behnken法中試规模下优化小青龙颗粒超声提取工艺[J]. 中国中药杂志,2016,41(4):683-688.
[21]侯学敏,李林霞,张直峰,等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学,2013,34(6):124-128.

