4种Cd超富集/富集植物修复性能的比较
龙玉梅 刘杰 傅校锋 孟德佳

摘要:以广西阳朔、广西河池、天津3个地区不同镉(Cd)污染程度的土壤为培养基质,通过温室盆栽试验,比较籽粒苋(Amaranthus hypochondriacus L.)、龙葵(Solanum nigrum L.)、商陆(Phytolacca acinosa Roxb.)、青葙(Celosia argentea L.)这4种植物对土壤的修复性能。结果表明,含Cd量为3.89 mg/kg的广西阳朔土壤,种植青葙可收获的Cd总量显著高于其他植物(P<0.05),分别是籽粒苋、龙葵、商陆的2.20、1.83、5.25倍;含Cd量为22.44 mg/kg的广西河池土壤,4种植物可收获的Cd总量高低依次为籽粒苋>青葙>商陆>龙葵,相互间间差异不显著(P>0.05);含Cd量为1.57 mg/kg的天津土壤,龙葵可收获的Cd总量显著高于商陆、籽粒苋可收获的Cd总量,分别是商陆、籽粒苋的5.00、2.50倍,与青葙的可收获Cd总量差异不显著。可见,青葙对3个地区的Cd污染土壤表现出较强的修复能力,可作为修复Cd污染土壤的优选植物。
关键词:镉;植物修复;籽粒苋;龙葵;商陆;青葙
中图分类号: X53文献标志码: A
文章編号:1002-1302(2019)08-0296-05
土壤镉(Cd)污染是我国突出的环境问题之一,《全国土壤污染状况调查公报》显示,在所有无机类污染物中,土壤Cd位点超标率是最高的,达到7%[1]。植物修复技术具有绿色、经济且能大面积原位实施的特点,被认为是修复农田Cd污染土壤最为理想的方式[2]。选用生物量大、能够忍耐Cd污染,并能大量富集Cd的植物是植物修复技术的关键[3]。目前,世界上已发现的Cd超富集植物约有17种[4],我国报道的Cd富集或超富集植物有宝山堇菜(Viola baoshanensis)、龙葵(Solanum nigrum L.)、东南景天(Sedum alfredii H.)、商陆(Phytolacca acinosa Roxb.)、圆锥南芥(Arabis paniculata L.)、籽粒苋(Amaranthus hypochondriacus L.)、忍冬(Lonicera japonica Thunb.)、青葙(Celosia argentea L.)等8种[5-12]。
龙葵、商陆、籽粒苋、青葙是生物量较大的超富集植物,在Cd污染土壤的修复中可能更具有较好的应用前景。但是,前人在研究这4种植物对Cd的富集效应时采用的试验方法和条件存在较大差异,导致相互间可比性较差。姚诗音等研究青葙对Cd的富集特征时,设置使用的Cd最低处理浓度为 1 mg/kg[12],而魏树和等研究龙葵对Cd的富集特征时,使用的Cd最低处理浓度为10 mg/kg[13],二者相差10倍;聂发辉研究商陆对Cd的富集效应时,盆栽土壤采用有机质含量为1.48 g/kg、pH值为5.1的强酸性土壤,并用Cd(NO3)2溶液污染土壤[14],而李凝玉等研究籽粒苋对Cd的耐性及积累特征时,供试的土壤pH值为7.2、有机质含量是前者的10倍,且以3CdSO4·8H2O溶液污染土壤[15]。由于土壤Cd的浓度、形态、试验周期、土壤理化性质等有所不同,导致难以直接有效比较龙葵等4种植物对Cd污染土壤的修复性能,进而难以从中筛选出最适合Cd污染土壤的修复植物。此外,试验多采用人工模拟Cd污染土壤,其土壤中Cd的生物有效性会较真实污染土壤高很多,植物对土壤的修复会与实际情况存在一定差异[16]。本试验以籽粒苋、龙葵、商陆、青葙这4种我国本土的Cd超富集/富集植物为研究对象,采用来自广西阳朔、广西河池、天津等3个地区理化性质、Cd污染来源和污染程度不同的农田土壤开展室内盆栽试验,比较4种植物对不同Cd污染土壤的修复性能,以期筛选出我国Cd污染土壤修复工程中更具应用价值的超富集植物。
1材料与方法
1.1试验材料
1.1.1供试土壤2017年3月,分别采集来自广西阳朔某铅锌尾砂库、广西河池某冶炼厂、天津某污灌区的周边污染农田[17-19]0~20 cm表层土作为试验土壤,阴凉处风干;压碎,过2 mm筛,保存备用;采用TRF-2B型土壤多功能分析仪分别测定土壤pH值及有机质、有效氮、有效磷、有效钾含量等基本理化性质,采用HNO3-HF-HClO4法消解、电感耦合等离子发射光谱法(ICP-OES)测定总Cd含量,结果见表1。
1.1.2供试植物籽粒苋种子,购买于牧草公司;龙葵、商陆、青葙种子,均采自桂林理工大学校园周边地区。
1.2试验处理
试验在桂林理工大学重金属污染植物修复试验基地进行。2017年4月8日,选取颗粒饱满的种子均匀播种于育苗盘中,每盘100粒左右,置于温室中培养,室温保持在25~30 ℃;4月25日, 待幼苗长出3~4张真叶时,选取长势一致的幼苗,分别移栽到装有1 kg(以干土计)来自3个不同地区土壤、大小为12.5 cm×17 cm、体积为2 L的盆钵中,每盆1株,每种土壤、每个植物重复3次,共计36盆;用经检不含Cd的自来水进行浇灌,使土壤含水量经常保持在田间持水量的80%左右;移栽后60 d收获,待测。
1.3测定内容与方法
将收获的4种植物样品分为根、茎、叶3个部分;根部用5 mmol/L Ca(NO3)2溶液浸泡15 min,以交换掉根表面吸附的Cd离子,超声波清洗仪清洗10 min,用去离子水冲洗3次[20],茎、叶直接用去离子水清洗3次;将洗净的样品105 ℃杀青30 min,60 ℃烘干至恒质量,测定干质量;植物干样磨碎,过5 mm筛,采用HNO3-HClO4消解,采用ICP-OES测定4种植物根、茎、叶的Cd含量,计算植物对土壤Cd的转运系数、富集系数及可收获的Cd总量、重金属去除率,公式分别为
转运系数=植物地上部分Cd含量/植物根部Cd含量;
富集系数=植物地上部分Cd含量/土壤中Cd含量;
可收获的Cd总量=植物地上部分Cd含量×地上部分生物量;
重金属去除率=(植物地上部分Cd含量×地上部分生物量)/(土壤中Cd含量×供试土壤质量)×100%。
植物样品分析过程中,采用国家标准参比物质GBW10015(GSB-6)和平行全空白样进行分析质量控制,同时,为保证结果准确,加标回收率控制在95%~105%,试验试剂均为优级纯。
1.4数据统计分析
采用SPSS 19.0软件对试验数据进行单因素方差分析(ANOVA),采用Origin软件进行作图;采用最小显著性差异法(LSD法)对数据进行差异显著性检验。
2结果与分析
2.1不同土壤条件下植物的生长情况
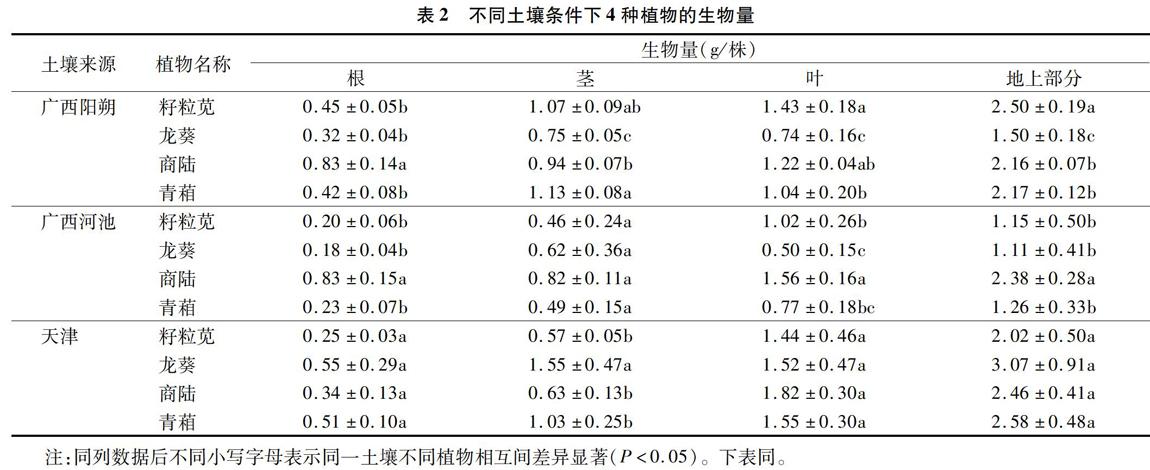
试验结果表明,籽粒苋、龙葵、商陆、青葙这4种植物在3个不同地区的土壤上均能正常生长,未出现肉眼可见的Cd中毒现象,这说明4种植物对Cd均有较强的耐受能力。由表2可见,对广西阳朔土壤而言,其种植出的籽粒苋地上部分生物量显著高于其他植物(P<0.05),是生物量最小植物龙葵的 1.67倍,商陆、青葙的地上部分生物量分别为2.16、2.17 g/株,相互间差异不显著(P>0.05);对天津土壤而言,4种植物的生长状况基本相似,其根、叶及地上部分的生物量相互間差异不显著;对广西河池土壤而言,商陆根部、地上部分生物量显著高于其他植物(P<0.05);广西河池土壤种植的4种植物地上部分生物量总和相对较低,为5.90 g/株,分别比广西阳朔、天津土壤种植的4种植物地上部分生物量总和低29.17%、41.76%。
2.2不同土壤条件下植物各部分Cd含量及转运系数
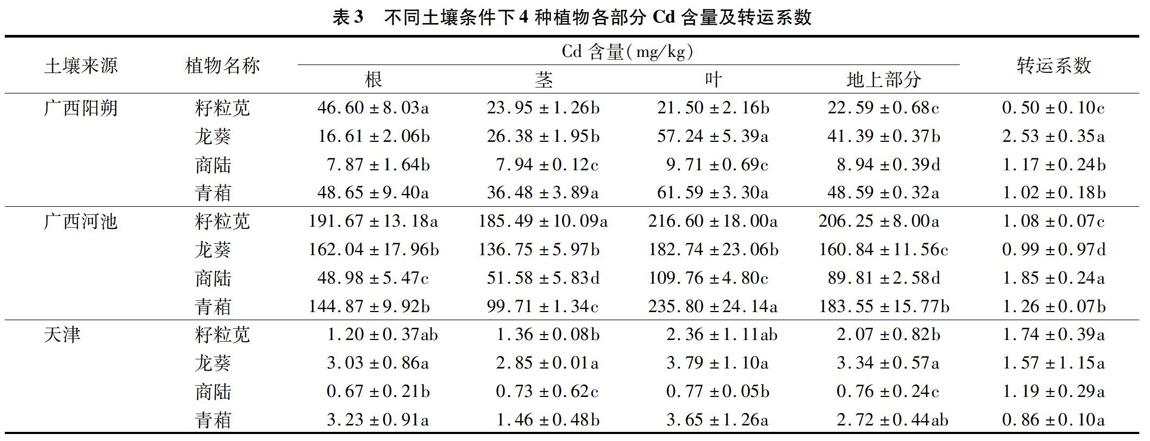
由表3可见,对广西阳朔土壤而言,其种植的籽粒苋、龙葵、商陆、青葙这4种植物的地上部分Cd含量相互间差异显著(P<0.05),其中,青葙的地上部分Cd含量相对最高,为48.59 mg/kg,显著高于其他3种植物,分别是籽粒苋、龙葵、商陆地上部分Cd含量的2.15、1.17、5.44倍;对广西河池土壤而言,植物地上部分的Cd含量高低表现为籽粒苋>青 葙> 龙葵>商陆,相互间差异显著,籽粒苋、青葙叶中的Cd含量差异不显著(P>0.05),但青葙茎中的Cd含量显著低于籽粒苋;对天津土壤而言,龙葵的地上部分Cd含量相对最高,为3.34 mg/kg,显著高于籽粒苋、商陆,分别是二者的 1.61、4.39倍,而与青葙地上部分Cd含量差异不显著;对不同地区而言,天津土壤种植的植物地上部分最高Cd含量仅为3.34 mg/kg,而广西阳朔、广西河池土壤种植的植物地上部分最高Cd含量分别为48.59、206.25 mg/kg,前者分别为后两者的6.87%、1.62%。
植物种类不同,植物对土壤中Cd的转运能力也会有所差别,主要通过转运系数这一指标来体现。由表3可见,对广西阳朔土壤而言,除籽粒苋外,龙葵、商陆、青葙对Cd的转运系数均大于1;对广西河池土壤而言,4种植物对Cd的转运系数大小表现为商陆>青葙>籽粒苋>龙葵,相互间差异显著(P<0.05);对天津土壤而言,4种植物对Cd的转运系数大小为籽粒苋>龙葵>商陆>青葙,相互间差异不显著(P>0.05)。
2.3不同土壤条件下植物对Cd的富集系数
富集系数是植物地上部分Cd含量与土壤中Cd含量的比值[21],可反映在土壤-植物系统中重金属Cd迁移的难易程度,是表征植物吸收Cd能力的评价指标[11]。由图1可知,除天津土壤上栽种的商陆外,3个地区各植物的富集系数均大于1.0,其中,在广西阳朔土壤上栽种的青葙对Cd的富集系数高达12.49,分别是龙葵、籽粒苋、商陆的1.17、2.15、5.43倍;广西河池土壤上栽种的植物富集系数大小为籽粒 苋> 青葙>龙葵>商陆;对天津土壤而言,其栽培的龙葵、青葙对Cd的富集系数分别为2.13、1.73,高于其他2种植物,与商陆差异显著(P<0.05)。
2.4不同土壤条件下4种植物可收获的Cd总量及对Cd的去除率
2.4.1可收获的Cd总量植物可收获的Cd总量是由植物地上部分Cd浓度和地上部分生物量决定的。由图2可见,广西阳朔土壤上栽种的青葙可收获Cd总量为0.11 mg/株,显著高于籽粒苋、龙葵、商陆(P<0.05),分别是其2.20、1.83、5.25倍;广西河池土壤上可收获Cd总量最高的植物是籽粒苋,其次是青葙,但4种植物可收获的Cd总量相互间差异不显著(P>0.05);天津土壤上龙葵、青葙可收获的Cd总量相对较高,两者之间差异不显著,高于其他2种植物,其中,龙葵可收获的Cd总量相对最高,分别是商陆、籽粒苋的 5.00、2.50倍。
2.4.2对Cd的去除率植物对Cd污染土壤修复效果的好坏可用植物对土壤中Cd的去除率来衡量。由表4可见,广西阳朔土壤上4种植物对Cd的去除率为0.50%~2.71%,其中,青葙对Cd的去除率最高,龙葵次之,两者之间差异显著(P<0.05);广西河池土壤上4种植物对Cd的去除率为 0.79%~1.37%,4种植物对Cd的去除率相互间差异不显著;天津土壤上4种植物对Cd的去除率为0.12%~0.67%,龙葵对Cd的去除率相对最高,青葙次之,两者之间差异不显著。
3结论与讨论
土壤中的镉(Cd)会对植物产生一定的毒害作用,引起一系列生理特征的改变[22]。本试验中,各土壤上栽种的籽粒苋、龙葵、商陆、青葙这4种植物均未出现叶片失绿、叶片卷曲等典型的Cd中毒症状[23],表明这4种植物对Cd均有较强的耐受能力。程国玲等研究表明,植物修复技术并不适用于高浓度重金属污染的土壤环境治理[24],但可用于治理中低浓度重[CM(25]金属污染的土壤[25]。 孙正国研究表明, 土壤中Cd浓度的增加会导致植物生物量的降低[26]。Salt等研究结果表明,植物主要通过地上部分吸收土壤中的重金属,植物地上部分生物量能反映植物对重金属的耐性情况[27]。本研究结果表明,重度Cd污染的广西河池土壤上种植的4种植物,其地上部分生物量总和较中度、轻度Cd污染的广西阳朔、天津土壤有一定程度降低,在Cd含量高达22.44 mg/kg的广西河池土壤上栽种的植物生长受到一定抑制,说明高浓度重金属土壤环境会影响植物的生长,从而削弱植物对重金属污染土壤修复治理的优势;在重度Cd污染的广西河池土壤上栽种的商陆,其地上部分生物量仍相对较高,显著高于籽粒苋、青葙、龙葵(P<0.05),这表明商陆对Cd的耐受程度相对较强,与聂发辉的研究结论[14]一致。
植物体内Cd含量及对Cd的富集系数可作为衡量植物对Cd污染土壤修复性能的指标。龙新宪等研究表明,一个地区土壤中的Cd含量越高,该地区植物中的Cd含量相对越高,植物对Cd的吸收量与土壤中的Cd总量呈正相关[28]。聂发辉等在土壤Cd浓度、pH值相似的情况下外源添加 20 mg/kg Cd(NO3)2,结果表明,添加Cd的商陆叶片Cd含量达到294.22 mg/kg,富集系数为7.49[29];Li等在pH值为 7.10 的土壤中外源添加5 mg/kg 3CdSO4·8H2O再栽种籽粒苋发现,籽粒苋叶片中的Cd含量高达146.50 mg/kg,富集系数高达22.30[30]。本研究结果表明,轻度Cd污染的天津土壤上栽种的植物,其地上部分最大Cd含量仅为3.34 mg/kg,仅为重度Cd污染的广西河池土壤上栽种植物地上部分最大Cd含量的1.62%,这进一步佐证了前人的观点;4种植物中,商陆的地上部分Cd含量及富集系数在3个地区土壤上栽培均是相对最低的,在广西河池含Cd为22.44 mg/kg的重度镉污染土壤上栽种,其叶片Cd含量也仅为109.76 mg/kg,富集系数为4.0,而籽粒苋在pH值为6.48、含Cd量为 3.89 mg/kg 的广西阳朔土壤上栽种,其叶片Cd含量仅为 21.50 mg/kg,富集系数为5.81,与聂发辉等的研究结论[29-30]存在较大差异,同样结果也出现在青葙[12]、龙葵[31]中,这可能是由于本研究中土壤分别取自污灌区、铅锌矿尾砂库及冶炼厂周边农田,Cd主要以铁锰氧化态、残渣态、还原态等非水溶性态Cd形态存在[32-34],而其他试验多以Cd(NO3)2、3CdSO4·8H2O、CdCl2等植物易吸收的水溶性态Cd模拟土壤Cd污染,非水溶性态Cd的生物有效性较水溶性态Cd要低得多[35]。因此,对真实的Cd污染土壤植物修复而言,植物修复人工模拟的Cd污染土壤试验评价结果缺乏外推效应。较其他3种植物来说,青葙在轻度、中度Cd污染的天津、广西阳朔土壤上栽种均能富集更多的Cd,其中,在中度Cd污染的阳朔土壤上其地上部分Cd含量显著高于其他植物,富集系数高达12.49,表明青葙对土壤中的Cd有很强的提取能力,可适用于不同形态Cd污染土壤的修复,这与姚诗音等的研究结论[12]相似,建议将青葙作为中国Cd污染土壤植物修复工程中推广应用的优选植物。
植物可收获的Cd总量及对Cd的去除率是衡量植物修复性能的2个关键指标。本研究结果表明,籽粒苋在重度Cd污染的广西河池土壤上栽种,其可收获的Cd总量及对Cd的去除率相对最高,与其他植物相比差异不显著(P>0.05);龙葵在轻度Cd污染的天津土壤上栽种,其可收获的Cd总量及对Cd的去除率显著高于籽粒苋、商陆,但清除其他2种污染土壤中Cd的优势不大,这说明龙葵可能较适用于低Cd污染土壤的修复;青葙在中轻度Cd污染的土壤上栽种其可收获的Cd总量及对Cd的去除率均相对较高,说明青葙在中轻度Cd污染的土壤上能表现出较好的修复性能,而目前我国90%以上的Cd污染土壤为中轻度污染[1],因此,青葙在土壤修复工程实践中具有更强的适用性。
须指出的是,以籽粒苋修复广西河池重度Cd污染的土壤使其达到GB 15618—1995《土壤环境质量标准》中的三级标准,按每茬籽粒苋对Cd的提取率1.37%计算,至少需要种植70茬才能达到修复效果,因此,对重度Cd污染的地区采用植物修复技术治理土壤污染效率相对较低,应考虑物理化学法治理修复[36-37]。另外,在污染土壤植物修复过程中,受外界环境及土壤内部环境影响,土壤中的重金属活性有可能会下降,进而导致植物吸收重金属的量下降,使修复效率降低[38],可通过添加柠檬酸、苹果酸或施加氮肥、真菌等措施[12,39-40],以提高作物叶片对Cd的吸收,提高植物修复性能。
参考文献:
[1]环境保护部,国土资源部. 全国土壤污染状况调查公报[R]. 北京:环境保护部,2014:1-5.
[2]Hao Q,Jiang C. Heavy metal concentrations in soils and plants in Rongxi Manganese Mine of Chongqing,Southwest of China[J]. Acta Ecologica Sinica,2015,35(1):46-51.
[3]徐剑锋,王雷,熊瑛,等. 土壤重金属污染强化植物修复技术研究进展[J]. 环境工程技术学报,2017,7(3):366-373.
[4]Cappa J J,Pilon-Smits E A. Evolutionary aspects of elemental hyperaccumulation[J]. Planta,2014,239(2):267-275.
[5]刘威,束文圣,蓝崇钰. 宝山堇菜(Viola baoshanensis)——一种新的镉超富集植物[J]. 科学通报,2003,48(19):2046-2049.
[6]魏树和,周启星,王新,等. 一種新发现的镉超积累植物龙葵(Solanum nigrum L.)[J]. 科学通报,2004,49(24):2568-2573.
[7]杨肖娥,龙新宪,倪吾钟,等. 古老铅锌矿山生态型东南景天对锌耐性及超积累特性的研究[J]. 植物生态学报,2001,25(6):665-672.
[8]Xue S G,Chen Y X,Reeves R D,et al. Manganese uptake and accumulation by the hyperaccumulator plant Phytolacca acinosa,Roxb.(Phytolaccaceae)[J]. Environmental Pollution,2004,131(3):393-399.
[9]汤叶涛,仇荣亮,曾晓雯,等. 一种新的多金属超富集植物——圆锥南芥(Arabis paniculata L.)[J]. 中山大学學报(自然科学版),2005,44(4):135-136.
[10]李凝玉,李志安,丁永祯,等. 不同作物与玉米间作对玉米吸收积累镉的影响[J]. 应用生态学报,2008,19(6):1369-1373.
[11]刘周莉,何兴元,陈玮. 忍冬——一种新发现的镉超富集植物[J]. 生态环境学报,2013,22(4):666-670.
[12]姚诗音,刘杰,王怡璇,等. 青葙对镉的超富集特征及累积动态研究[J]. 农业环境科学学报,2017,36(8):1470-1476.
[13]魏树和,周启星,王新. 超积累植物龙葵及其对镉的富集特征[J]. 环境科学,2005,26(3):167-171.
[14]聂发辉. 镉超富集植物商陆及其富集效应[J]. 生态环境,2006,15(2):303-306.
[15]李凝玉,卢焕萍,李志安,等. 籽粒苋对土壤中镉的耐性和积累特征[J]. 应用与环境生物学报,2010,16(1):28-32.
[16]周建利,郭晓方,吴启堂,等. 活化土壤重金属天然植物螯合剂的筛选[J]. 生态学报,2010,30(5):1390-1396.
[17]林炳营. 广西某铅锌矿区土壤-作物镉污染研究[J]. 土壤通报,1997,28(5):235-237.
[18]项萌,张国平,李玲,等. 广西铅锑矿冶炼区表层土壤重金属污染的分布规律[J]. 矿物学报,2011,31(2):250-255.
[19]王祖伟,张辉. 天津污灌区土壤重金属污染环境质量与环境效应[J]. 生态环境学报,2005,14(2):211-213.
[20]吴秉奇,刘淑杰,张淼,等. 接种耐镉细菌对青葙吸收积累土壤中镉的影响[J]. 生态学杂志,2014,33(12):3409-3415.
[21]Tanhan P,Kruatrachue M,Pokethitiyook P,et al. Uptake and accumulation of cadmium,lead and zinc by siam weed[Chromolaena odorata (L.) King & Robinson][J]. Chemosphere,2007,68(2):323-329.
[22]李广云,曹永富,赵书民,等. 土壤重金属危害及修复措施[J]. 山东林业科技,2011,41(6):96-101.
[23]徐正浩,沈国军,诸常青,等. 植物镉忍耐的分子机理[J]. 应用生态学报,2006,17(6):1112-1116.
[24]程国玲,胥家桢,马志飞,等. 螯合诱导植物修复技术在重金属污染土壤中的应用[J]. 土壤,2008,40(1):16-20.
[25]胡亚虎,魏树和,周启星,等. 螯合剂在重金属污染土壤植物修复中的应用研究进展[J]. 农业环境科学学报,2010,29(11):2055-2063.
[26]孙正国. 龙葵对镉污染土壤的响应及其修复效应研究[J]. 江苏农业科学,2015,43(10):397-401.
[27]Salt D E,Smith R D,Raskin I.Phytoremediation[J]. Annual Review of Plant Biology,1998,49:643-668.
[28]龙新宪,王艳红,刘洪彦. 不同生态型东南景天对土壤中Cd的生长反应及吸收积累的差异性[J]. 植物生态学报,2008,32(1):168-175.
[29]聂发辉,吴彩斌,吴双桃. 商陆对镉的富集特征[J]. 浙江林学院学报,2006,23(4):400-405.
[30]Li N Y,Fu Q L,Zhuang P,et al. Effect of fertilizers on Cd uptake of amaranthus hypochondriacus,a high biomass,fast growing and easily cultivated potential Cd hyperaccumulator[J]. International Journal of Phytoremediation,2012,14(2):162-173.
[31]Zhang X F,Xia H P,Li Z,et al. Identification of a new potential Cd-hyperaccumulator Solanum photeinocarpum by soil seed bank-metal concentration gradient method[J]. Journal of Hazardous Materials,2011,189(1/2):414-419.
[32]孙约兵,徐应明,史新,等. 污灌区镉污染土壤钝化修复及其生态效应研究[J]. 中国环境科学,2012,32(8):1467-1473.
[33]许超,夏北成,吴海宁. 尾矿库尾砂及周边农田土壤重金属形态分布及其生物有效性[J]. 农业环境科学学报,2009,28(11):2293-2296.
[34]李翔,刘永兵,程言君,等. 湖南某铅锌矿污染土壤稳定化修复研究[J]. 中国土壤与肥料,2016(2):137-144.
[35]张季惠,王黎虹,张建奎. 土壤中镉的形态转化、影响因素及生物有效性研究进展[J]. 广东农业科学,2013,40(6):169-171.
[36]王家乐. 土壤镉污染及治理技术综述[J]. 中国西部科技,2010,9(7):7-9.
[37]李婧,周艳文,陈森,等. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报,2015,21(24):104-107.
[38]孙鑫,娄燕宏,王会,等. 重金属污染土壤的植物强化修复研究进展[J]. 土壤通报,2017,48(4):1008-1013.
[39]王林,周启星,孙约兵. 氮肥和钾肥强化龙葵修复镉污染土壤[J]. 中国环境科学,2008,28(10):915-920.
[40]毛亮,靳治国,高扬,等. 微生物对龙葵的生理活性和吸收重金属的影响[J]. 农业环境科学学报,2011,30(1):29-36.

