农杆菌介导的番茄遗传转化体系优化
卜璐璐 赵凯 杨荣萍 罗兴会 李清云 杨正安


摘要:以番茄自交系AC++和番茄母本材料1448的子叶为外植体,采用农杆菌介导的方式接种于含有不同浓度玉米素(ZT)、吲哚-3-乙酸(IAA)和硝酸银(AgNO3)的MS培养基上,以筛选适合番茄自交系AC++和1448的最佳遗传转化体系。结果显示,诱导愈伤组织及不定芽分化的最适培养基为MS+2.0 mg/L ZT+0.5 mg/L IAA+3 mg/L AgNO3;诱导生根的最适培养基为1/2 MS+0.3 mg/L IAA。
关键词:番茄;农杆菌介导;再生体系;遗传转化
中图分类号: S641.201文献标志码: A
文章编号:1002-1302(2019)09-0096-04
番茄(Lycopersicon esculentum Mill.)作为具备良好加工特性的蔬菜,其普及性广,口感好,营养丰富,是植物口服疫苗的理想载体[1-2]。目前,利用转基因植物生产口服疫苗愈加受到重视[3-4]。番茄作为生物反应器来生产可食性疫苗具有较好的应用前景,因此选择较好的番茄遗传转化材料和优化番茄的遗传转化体系显得极为重要。
影响番茄遗传转化的因素有很多,大量研究表明,目前已开发出比较成熟的番茄遗传转化体系。但是不同基因型的番茄品种在相同的转化条件下,其转化率差异较大[5]。在番茄遗传转化研究中应用得比较多的番茄品种为中蔬4号。葛艳辉等的研究表明,使用中蔬4号作为番茄遗传转化研究的品种,其转化率可以高达51.40%,而在相同的体系下,T03的转化率仅为28.17%[6-8]。以上研究结果表明,对于不同基因型的番茄,其最适的遗传转化体系不同,因此需要对不同基因型的番茄筛选出其最适合的遗传转化体系。
本试验采用转化效率比较高的番茄自交系AC++和1448作为遗传转化材料,通过农杆菌介导的方式,采用正交试验设计,筛选出适合这2个品种的最佳遗传转化体系,并确定2种番茄材料中的最佳转化材料,为后续利用基因工程技术生产番茄口服疫苗提供试验材料并奠定试验基础。
1 材料与方法
1.1 试验材料
供试番茄材料为番茄自交系AC++和笔者所在实验室保存的母本材料1448,分别由西南大学园艺园林学院和云南农业大学园林园艺学院提供。
试验所用菌种(含有IGF-1基因的pCAMBIA2301-IGF-1载体)由笔者所在实验室保存。
1.2 试验时间和地点
本试验于2017年6月至2017年12月進行,整个试验过程均在云南农业大学园林园艺学院蔬菜分子生物学实验室完成。
1.3 试验方法
1.3.1 无菌苗的获取 挑选饱满的番茄种子,加入洗洁精进行搓洗(尽量去除其表面抑制种子发芽的物质和种子表面的小茸毛),将种子清洗干净。在超净工作台上完成以下操作。(1)种子的消毒处理。首先用75%乙醇消毒30 s,然后快速用无菌水清洗3次,之后加入饱和磷酸钠溶液消毒20 min,再用无菌水清洗种子3次,其间不断搅拌;加入有效浓度为2%的次氯酸钠消毒10 min,其间稍作摇晃,用无菌水清洗5~7次,每次洗2 min。(2)种子消毒后的处理。将消毒的种子用无菌吸水纸吸干水分,然后将种子接种在1/2MS培养基中,每瓶接5~6粒种子。将培养基置于光照培养箱中培养,光—暗周期为16 h—8 h,光—暗温度周期为26 ℃—18 ℃,光照度为1 500~2 000 lx,培养10~15 d左右获得无菌番茄植株。
1.3.2 农杆菌浸染番茄叶片 (1)选取培养7 d的番茄叶片,切成大小约为0.5 cm×0.5 cm的小块,将叶片块接种于如表1所示筛选好的固体培养基中,在黑暗条件下预培养 24~36 h。(2)将含有载体的农杆菌接种于含有500 μg/L链霉素(Sm)、50 μg/L利福平(Rif)、50 mg/L卡那霉素(Kan)的液态酵母甘露醇培养基(YEB)中,28 ℃黑暗培养2 d。(3)取500 μL复壮后的农杆菌加入液体YEB培养基(含有 500 μg/L Sm,50 μg/L Rif,50 mg/L Kan)中,过夜培养16 h,至D600 nm为0.5左右。(4)在室温条件下于6 000 r/min离心10 min,用等体积的YEB重悬菌体;在室温条件下于 4 000 r/min 离心10 min,弃上清,收集农杆菌,用50 μL MS液体培养基重悬,作为浸染液。(5)将预培养的外植体浸泡在重悬的浸染液中10 min,其间振荡,之后用滤纸吸去叶片上多余的菌液,放回原固体培养基内进行共培养。每个处理接种10瓶,每个处理重复3次,每瓶接种6个叶片块。(6)共培养2 d后转接到相应的抗性培养基上,于光—暗周期为16 h(26 ℃)—8 h(18 ℃)的光照培养箱中培养。2周更换1次培养基,直到愈伤组织生成。
1.3.3 诱导愈伤组织和不定芽的培养基筛选 本试验采用3因素3水平,对番茄外植体叶片诱导愈伤组织和不定芽的培养基进行L9(34)正交设计,以确定诱导愈伤组织和芽分化的最佳激素组合。具体试验设计组合见表1。
本试验以愈伤组织形成率(即出愈率,%)和不定芽分化率(%)来评价外植体的再生能力。接种21 d后统计愈伤组织数及形成率,42 d后统计出芽数及不定芽分化率,从而筛选出最适的诱导愈伤组织的培养基激素浓度。
愈伤组织形成率=形成愈伤组织的外植体数/接种的总外植体数×100%;
不定芽分化率=分化的不定芽数/接种的总外植体 数×100%。
1.3.4 不同培养基配方诱导番茄生根的试验 当不定芽长至3~4 cm左右时,切取生长健壮的不定芽,分别插入含有0.2、0.3、0.4 mg/L IAA的MS生根培养基中,每个处理接种15株,诱导生根。1周后统计不同处理的生根数及生根率,并筛选出最适培养基。
生根率=生根的不定芽数/接种的总不定芽数×100%。
2 结果与分析
2.1 番茄自交系AC++的遗传转化结果及分析
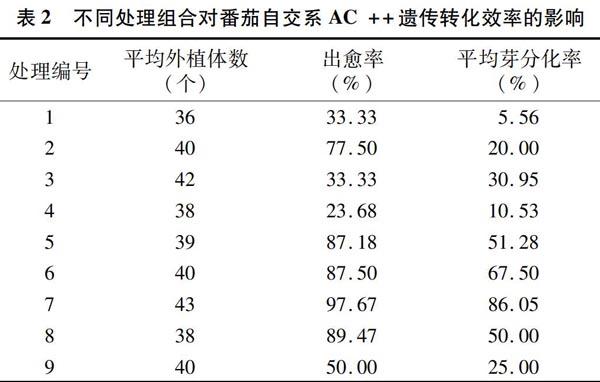
2.1.1 番茄自交系AC++的遗传转化结果 番茄叶片经过培养后,所有处理组合均有愈伤组织及再生芽生成,且不同处理组合形成愈伤组织和再生芽的情况不同。由表2可见,叶片的出愈率在23.68%~97.67%之間,以处理7组合的出愈率最高;芽的平均分化率在5.56%~86.05%之间,以处理1组合的芽平均分化率最低,而处理7组合的芽平均分化率最高。因此,以处理7组合作为诱导愈伤组织和芽分化的最佳处理组合,具体培养基配比为MS+3 mg/L AgNO3+0.5 mg/L IAA+2.00 mg/L ZT。
2.1.2 不同激素浓度对番茄自交系AC++生根的影响 挑选分化效果较好的番茄苗转入生根培养基中,用不同浓度的IAA对分化芽进行处理,随时观察其生根动态。试验结果表明,接种约4~5 d便可见根从小苗基部分化出来,10 d左右瓶中的小苗长出1~2 cm的白色须根。
通过实际的试验观察和表3的结果可以看出,番茄苗生根较为容易,一般1/2MS培养基都能获得很好的效果,但是根较细长,长出的植株较弱。对同一时期的生根情况进行比较可知,1/2MS+0.3 mg/L IAA诱导生根的生根率最高,达到100.00%,并且每个不定芽发生的不定根数量较多,根系粗壮,适于后期移栽工作。因此,选用1/2MS+0.3 mg/L IAA作为最佳生根培养基。
2.1.3 番茄自交系AC++的遗传转化结果分析 由表4可以看出,平均出愈外植体数以处理7最高,达到42个,经计算,其出愈率达到97.67%;进一步分析表明,处理7与处理5、6、8之间的出愈外植体数差异相对不明显。
由表5可以看出,AC++番茄外植体的芽分化结果表现为处理7的分化出芽外植体数最多,平均为37个, 经计算芽分化率为86.05%;处理7与其他处理间差异明显,处理6与处理7、5之间的芽分化结果差异明显。
2.2 番茄母本材料1448的遗传转化结果及分析
2.2.1 1448番茄的遗传转化结果 由表6可见,对番茄母本材料1448的外植体进行遗传转化后,所有处理组合均有愈伤组织产生,不同处理组合的出愈情况不同,其中以处理7的外植体出愈数最多,为32个,其出愈率为73.08%,出愈率最低的为处理1,仅为14.29%。1448番茄材料的芽分化率最高可达69.23%,其最适的芽分化与愈伤诱导培养基组合为MS+3 mg/L AgNO3+0.5 mg/L IAA+2.00 mg/L ZT。
2.2.2 不同激素浓度对番茄母本材料1448生根的影响 挑选分化效果较好的番茄苗,转入含有不同IAA浓度的生根培养基中,通过试验观察和表7的结果可以看出,番茄苗生根较为容易,不添加激素的1/2MS培养基也可生根,但是根较细。对同一时期进行比较可知,用1/2MS+0.3 mg/L IAA培养基诱导生根,其生根率最高,根系粗壮,生根率达到100.00%。因此,以1/2MS+0.3 mg/L IAA作为最佳生根培养基。
2.2.3 番茄母本材料1448的遗传转化结果分析 对番茄母本材料1448外植体在不同处理下的出愈结果进行分析,表8结果显示,出愈效果最好的为处理7,与其他处理之间的差异明显,处理3和处理4间的出愈外植体数差异明显。
如表9所示,出愈数最高的处理组合7,其分化出芽外植体数也最多。处理7与其他处理组合之间的芽分化数差异明显,此外,处理4、9和处理1、2、3之间差异明显。
2.3 不同基因型番茄材料遗传转化结果的对比
由图1、图2可以看出,2个基因型番茄材料的出愈率、芽分化率最高的均为处理7,对于AC++番茄材料,最优处理组合的出愈率为96.92%,芽分化率为86.15%。对于1448材料,最优处理组合的出愈率和芽分化率明显低于AC++材料。由图1、图2还可以看出,在使用处理组合4诱导愈伤组织以及诱导芽分化时,1448材料的出愈率和芽分化率要高于AC++,但是处理4不是2个材料中的最优处理组合。综合对2个基因型番茄材料的遗传转化结果的对比得出,番茄自交系AC++为最佳遗传转化材料。
3 讨论
3.1 不同基因型番茄材料对植株再生效率的影响
由本研究结果得出,植物的基因型不同,对培养条件的反应不同,植物的再生效率(即出愈数)具有显著差异。本试验得出的结论与前人的研究结果一致。孙靖棣等选用5种不同基因型的番茄材料进行再生体系调控研究,结果表明,不同基因型番茄的再生体系受不同激素配比的调控差异显著[9]。裴华丽等以特大瑞光、菜都982F1和菜都六号3种番茄为试验材料进行的研究结果表明,3种材料的分化率差异较大[10]。韦鹏霄等选用4种番茄材料进行诱导花药愈伤组织试验,结果得出,不同基因型番茄花药对激素的敏感性不同[11]。
本试验结果表明,番茄自交系AC++的平均分化率最高可达到86.15%,比他人研究得出的其他品种的分化效率高。比如常用的番茄遗传转化材料中蔬4号,陈珍等筛选得出该基因型的遗传体系转化效率仅为51.4%[7]。
3.2 不同激素处理组合对外植体愈伤组织和再生芽形成以及根生长的影响
番茄外植体分化愈伤组织和芽的能力取决于培养基中细胞分裂素和生长素的种类和浓度比例。番茄组培中常用的细胞分裂素为6-苄氨基腺嘌呤(6-BA)和ZT,而张艳芳等的研究则以6-BA和IAA 2种激素进行搭配组合,筛选毛粉802的最佳培养体系,结果显示,2种激素的作用相同,但不同基因型的番茄应该选择其最适合的激素[12-13]。本试验采用ZT结合IAA、AgNO3进行激素配比,筛选出适合诱导愈伤组织和再生芽的体系为MS+2.00 mg/L ZT+0.5 mg/L IAA+3 mg/L AgNO3,培养基中添加的IAA浓度要比前人所用的浓度高。例如,王傲雪等以宇番一号和0949-46为试验材料,筛选出诱导子叶出芽的最佳激素组合中的IAA浓度为 0.2 mg/L[14]。这种情况可能是由不同基因型的番茄的内源激素差异所造成的。
植物根系生长的强弱直接关系到植株的生长状况[15]。本研究中诱导生根的最适宜培养基为1/2 MS+0.3 mg/L IAA。研究表明,不添加激素的培养基也可以生根,但其根系生长较弱。陈火英等用不同浓度的α-萘乙酸(NAA)、IAA、吲哚丁酸(IBA)、二氯苯氧乙酸(2,4-D)进行生根培养试验,结果发现,番茄的内源生长素浓度较高,添加生长素对不定芽发根有一定的作用,若不添加生长素也极易发根[16]。
本试验对2个番茄品种的最佳遗传转化体系进行了筛选,分别得到最佳的遗传转化体系,并对2个材料的遗传转化结果进行了对比,得出番茄自交系AC++材料的转化效率要比1448材料的高。研究结果为后续研究口服疫苗提供了试验材料,并奠定了试验基础。
参考文献:
[1]郑 卿,郭书巧,葛才林,等. 转基因番茄口服疫苗的研究进展[J]. 中国医药生物技术,2010,5(1):57-60.
[2]余云舟,王 罡,金寧一,等. 农杆菌介导gag基因和gp120基因转化番茄的初步研究[J]. 吉林农业大学学报,2003,25(4):374-377.
[3]Koprowski H,Yusibov V. The green revolution:plants as heterologous expression vectors[J]. Vaccine,2001,19(17/18/19):2735-2741.
[4]Daniell H,Streatfield S J,Wycoff K. Medical molecular farming:production of antibodies,biopharmaceuticals and edible vaccines in plants[J]. Trends in Plant Science,2001,6(5):219-226.
[5]Sharma M K,Solanke A U,Jani D,et al. A simple and efficient Agrobacterium-mediated procedure for transformation of tomato[J]. Journal of Biosciences,2009,34(3):423-433.
[6]葛艳辉,赵俊英,崔继哲. 番茄遗传转化体系的建立[J]. 吉林工程技术师范学院学报(自然科学版),2007,23(6):56-58.
[7]陈 珍,朱 诚. 农杆菌介导的番茄遗传转化体系优化研究[J]. 浙江大学学报(农业与生命科学版),2008,34(6):615-620.
[8]姜娜娜,赵传志,赵光敬,等. 番茄果实特异性启动子的克隆与遗传转化研究[J]. 生物技术通报,2012(1):74-78.
[9]孙靖棣,未晓巍,蔡 蕊,等. 激素配比对不同基因型番茄再生体系的调控[J]. 北方园艺,2012(5):115-118.
[10]裴华丽,李美芹,刘永光,等. 不同基因型番茄高效组培再生体系的建立[J]. 北方园艺,2013(3):119-121.
[11]韦鹏霄,张 例,王茂昌,等. 不同激素组合对番茄温敏核不育系及其杂交组合花药愈伤组织诱导效应[J]. 南方农业学报,2011,42(7):700-704.
[12]张艳芳,霍秀文,苏彩霞,等. 番茄遗传转化体系的建立[J]. 中国农学通报,2008,24(3):58-61.
[13]赵明珠,张美萍. 不同番茄品种再生体系的比较[J]. 北方园艺,2011(9):127-129.
[14]王傲雪,赵 越,陈秀玲,等. 不同激素组合对番茄芽分化率的影响[J]. 东北农业大学学报,2013,44(7):85-90.
[15]姜丽娜,齐冰玉,徐光武,等. 水氮对根箱种植冬小麦根系生长及产量的影响[J]. 江苏农业科学,2017,45(14):42-45.
[16]陈火英,张建华,钟建江,等. 番茄下胚轴离体培养植株再生及其组织学观察[J]. 西北植物学报,2000,20(5):759-765,图版 Ⅰ-Ⅱ.

