组蛋白乙酰化酶抑制剂(DCH36_06)对小鼠急性肝损伤的保护作用及机制研究
彭金金 黄鹤鸣 刘彦君 石翠翠 范建高 张元元 罗成 李光明
急性肝损伤(acute liver injury, ALI)临床十分常见,目前尚无有效防治方法。尽管引发ALI的病因各异,但均有炎性反应参与其损伤修复过程,且炎性反应可能是决定ALI临床结局的关键[1, 2]。ALI病情进展除与损伤强度及持续时间(环境因素)有关外,也与宿主的易感体质(遗传因素)密切相关,因此表观遗传在ALI病情演进中可能起关键作用。组蛋白的乙酰化修饰是一种重要的表观调控方式[3]。P300/CBP组蛋白乙酰化酶(histone acetyltransferase,HAT)与促炎因子表达上调及炎症信号通路活化密切相关[3]。DCH36_06是新近发现的一种P300/CBP组蛋白乙酰化酶抑制剂,其可能具有抗炎活性[4]。基于炎性反应在ALI病情进展中的关键作用,DCH36_06可能对ALI具有保护作用。本研究探讨DCH36_06对脂多糖/D-氨基半乳糖胺(Lipopolysaccharide/D-galactosamine,LPS/D-Gal)诱导的ALI小鼠的保护作用,并初步阐明其机制。
材料与方法
一、 动物、试剂与药物
C57BL/6雌性小鼠75只,8~10周龄,SPF级,体质量20~22 g,购自中国科学院上海药物研究所,在清洁级动物实验中心喂养(标准动物饲料及饮水,12 h明暗交替光照时间)。所有动物实验均遵守中国科学院上海药物研究所动物伦理委员会的相关规定。LPS(E.Coli,菌株O111:B4)和D-Gal均购自美国Sigma公司。DCH36_06试剂由中国科学院上海药物研究所提供。苏木素-伊红(HE)和末端转移酶介导的缺口末端标记法(terminal-deoxynucleotidyl transferase media-ted nick end labeling,TUNEL)染色试剂盒购自武汉谷歌生物科技有限公司。RNA提取试剂盒、反转录试剂盒和RT-qPCR荧光染料试剂盒购自南京诺唯赞生物科技有限公司。ELISA试剂盒购自美国Sigma公司。
二、 动物分组及小鼠ALI模型的建立
将75只小鼠随机分成4组,正常对照组20只、ALI模型组20只、药物干预组20只和药物对照组15只。正常对照组:0.9%氯化钠溶液0.5 mL腹腔注射,1 h后注射0.1 mL 0.9%氯化钠溶液;模型组:0.9%氯化钠溶液0.5 mL腹腔注射,1 h后注射溶解有LPS(2 mg/kg)/D-Gal(250 mg/kg)的0.9%氯化钠溶液0.1 mL;药物干预组:DCH36_06(100 mg/kg)0.5 mL腹腔注射,1 h后注射溶解有LPS/D-Gal(剂量同模型组)的0.9%氯化钠溶液0.1 mL;药物对照组:DCH36_06 (剂量同干预组) 0.5 mL腹腔注射,1 h后注射0.1 mL 0.9%氯化钠溶液。前3组于LPS/D-Gal诱导4 h后每组各处死5只取材,余小鼠继续饲养至24 h,用以观察各组小鼠24 h存活情况。
三、血生化水平检测
使用日立7020全自动血生化分析仪,检测血清AST、ALT、TBil水平。
四、 肝组织染色
(一)HE染色 肝组织浸泡于4%的多聚甲醛,室温固定48 h后,脱水、浸蜡、包埋,切成约为5 μm厚度的切片。依次将切片放入二甲苯孵育140 min、无水乙醇孵育20 min、75%乙醇孵育5 min,三蒸水洗涤。苏木精染色5 min后,于盐酸水溶液中浸泡数分钟,氨水水溶液中反蓝,三蒸水洗涤。再将切片依次置于85%、95%的梯度乙醇中脱水后,苏木精染液中染色5 min,三蒸水洗涤,而后脱水封片。
(二)TUNEL染色 将固定于4%多聚甲醛中的肝组织脱水、浸蜡、包埋,切成约为5 μm厚度的切片。按照试剂盒使用说明,制备反应液并进行染色孵育,依次经converter-POD试剂37 ℃暗湿盒中孵育30 min, DAB底物室温孵育10 min后,漂洗干燥、酒精脱水、二甲苯透明、中性树胶封片。
五、肝组织细胞因子蛋白含量检测
组织裂解液提取肝组织总蛋白后, ELISA法检测肝组织细胞因子IL-1β、TNF-α和IL-6的蛋白含量。经过包被、封闭、洗涤、加样、温育、抗体孵育、洗涤、酶结合、显色、终止反应后,于酶标仪450 nm处,以空白对照孔调零后测各孔A值,并根据标准品的浓度和A值做标准曲线,然后根据标准曲线方程计算出各样本浓度。
六、肝组织细胞因子mRNA水平检测
七、统计学分析

结 果
一、各组小鼠24 h存活情况
在LPS/D-Gal刺激后,模型组小鼠早期即出现死亡,15只小鼠24 h存活6只;而DCH36_06干预组小鼠死亡时间明显推迟,且24 h存活13只;空白对照组和药物对照组的15只小鼠24 h均存活。实验表明,DCH36_06对LPS/D-Gal诱导的ALI小鼠具有显著保护作用,且无明显肝毒性。
二、各组小鼠肝组织炎性损伤和肝细胞凋亡情况
正常对照组小鼠肝小叶结构完整,肝细胞呈放射状有序排列成肝索结构;LPS/D-Gal诱导4 h后模型组小鼠肝细胞大片坏死,肝小叶结构破坏,正常肝索结构消失,大量炎性细胞浸润;药物干预组小鼠肝细胞变性、坏死明显减少,肝索结构基本正常,炎性细胞浸润明显减轻,见图1。TUNEL染色显示,ALI模型组小鼠肝组织见大量肝细胞凋亡,与模型组相比,药物干预组小鼠肝组织内肝细胞凋亡显著减少,见图2。染色结果从组织学水平证实DCH36_06对LPS/D-Gal诱导的ALI具有显著保护作用。

图1各组小鼠肝组织光学显微镜下表现(HE,低倍放大)A.正常对照组 B.ALT模型组 C.DCH36-06给药组
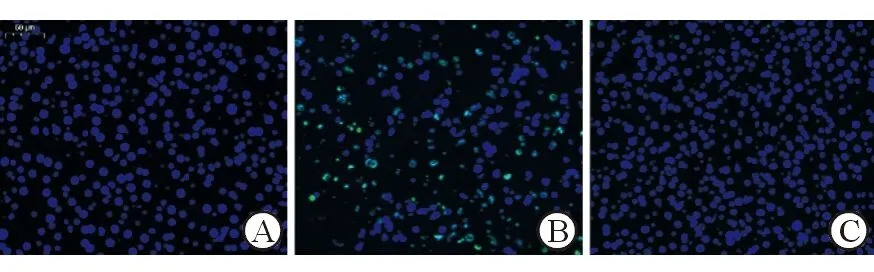
图2各组小鼠肝组织光学显微镜下表现(TUNEL,低倍放大)A.正常对照组 B.ALT模型组 C.DCH36-06给药组
三、各组小鼠血清AST、ALT、TBil水平
LPS/D-Gal刺激诱导模型组小鼠血清AST、ALT、TBil水平较正常对照组显著升高(P<0.05);而DCH36_06干预后小鼠血清AST、ALT、TBil水平较ALI模型组显著降低(P<0.05),见表1。
表1 各组小鼠肝功能指标比较(±s)
四、各组小鼠肝组织炎性细胞因子mRNA水平和蛋白含量
与正常对照组相比,ALI模型组小鼠肝组织内促炎性细胞因子TNFα、IL-1β、IL-6 mRNA水平显著升高(P<0.05);DCH36_06干预组肝组织TNF-α、IL-1β、IL-6 mRNA水平亦有轻微增高,但与模型组相比,炎性细胞因子mRNA水平显著下降(P<0.05),见表2。促炎性细胞因子 TNF-α、IL-1β和IL-6蛋白含量的ELISA分析也显示类似的结果,见表3。以上数据表明DCH36_06干预可有效抑制LPS/D-Gal诱导的肝组织炎性细胞因子mRNA表达和炎性细胞因子的蛋白分泌,从分子水平证实DCH36_06对LPS/D-Gal诱导的肝组织炎性损伤具有显著保护作用。
表2 各组小鼠肝组织内促炎性细胞因子mRNA含量比较(±s)
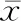
表3 各组小鼠肝组织内促炎性细胞因子蛋白含量比较(pg/mL,±s)
讨 论
ALI本质上是一种炎性损伤,适度的炎性反应有助于损伤修复,过弱不利于病灶清除,过强易诱发损伤扩大,导致疾病快速进展。因此,精准调控炎性反应是防治ALI的关键。表观遗传可整合环境因素与宿主基因组遗传信息,从源头调控基因表达及炎性反应[5],提示干预表观调节可能具有潜在肝脏保护作用。研究发现,组蛋白乙酰化修饰与肝损伤的发生发展密切相关,P300/CBP组蛋白乙酰化酶作为一种重要的组蛋白修饰酶,在炎症性疾病的进展中起重要调控作用[6- 8]。
DCH36_06作为新发现的一种P300/CBP组蛋白乙酰化酶抑制剂[4],可能对ALI具有保护作用。本研究结果显示,DCH36_06干预可显著提高LPS/D-Gal诱导ALI小鼠24 h的存活率。为了探究DCH36_06对小鼠ALI的保护机制,进一步从组织病理学及血清生化学方面证实了DCH36_06可显著减轻LPS/D-Gal诱导的小鼠ALI,表现为肝组织炎症性坏死、炎性细胞浸润及肝细胞凋亡显著减少,血清ALT、AST及TBil明显降低。从分子生物学角度发现,DCH36_06干预可显著下调小鼠肝组织促炎细胞因子TNFα、IL-1β、IL-6 mRNA表达和蛋白分泌。
本研究证实P300/CBP组蛋白乙酰化酶抑制剂DCH36_06对小鼠ALI具有显著保护作用,其机制可能与抑制促炎细胞因子表达、减轻肝内炎性反应相关。研究结果显示,表观抑制剂可从源头调控炎性反应强度,由此减轻肝组织炎症损伤,提示表观抑制剂DCH36_06在防治ALI中可能具有潜在应用价值,表观调控可能是ALI防治的一个新靶点。

