TLR4和IRF7在宫颈病变组织中的表达及临床病理学意义
凡尔克·艾合买提江,夏衣达·吐尔逊,郭文涛,塔来古丽·西仁白克,阿仙姑·哈斯木
(新疆医科大学1基础医学院病理教研室,2附属肿瘤医院药学部,乌鲁木齐 830011;3喀什第一人民医院肿瘤科,喀什 844000)
目前,全球子宫颈鳞状细胞癌 (cervical squamous cell carcinoma,CSCC)是仅次于乳腺癌居第 2 位的妇科常见的恶性肿瘤之一。2018年,全球范围内开展了一项大规模的子宫颈鳞状细胞癌调查,发现子宫颈鳞状细胞癌新发病例有570 000例,其中85%来自发展中国家,同年子宫颈鳞状细胞癌造成311 000名患者死亡,其中87%发生在落后国家[1]。我国子宫颈鳞状细胞癌的发病率约为21/10万,死亡率为14.95/10万。尤其西部地区子宫颈鳞状细胞癌发的病率达大约为117.51/10万[2-3]。Toll 样受体4(Toll-like receptors,TLR4)属于病原相关分子模式识别受体,不仅识别外源的病原体,还能识别内源性物质及其降解产物,在天然免疫及其继发的获得性免疫中起重要作用。近期研究显示,TLR4 在多种肿瘤细胞表达,并具有配体特异性,通过配体的激活释放肿瘤生长因子、趋化因子以及免疫抑制因子形成肿瘤生长微环境,促进肿瘤发生、发展、逃避肿瘤免疫反应。在前期子宫颈鳞状细胞癌转录组测序研究中筛选出与Toll 样受体表达相关的12种差异表达基因[4]。本研究应用qRT-PCR和免疫组织化学方法对TLR4和IRF7mRNA和蛋白表达进行检测和分析,探讨其在CSCC演变过程中的作用。
1 材料与方法
1.1 研究对象选取在新疆医科大学第一附属医院及自治区人民医院妇科收治的宫颈疾病患者标本,包括36例宫颈上皮内瘤变Ⅱ-Ⅲ级(cervical intraepithelial neoplasia Ⅱ-Ⅲ,CINⅡ-Ⅲ),44例宫颈鳞状细胞癌(cervical squamous cell carcinoma,CSCC),19例因子宫肌瘤手术切除的轻度慢性宫颈炎组织,合计99例。所有组织标本均有病理医师确诊,同时收集石蜡包埋和新鲜组织标本。本研究已通过新疆医科大学第一附属医院医学伦理委员会的批准,样本的获取均通过患者知情同意。

1.3 方法
1.3.1 qRT-PCR方法检测TLR4和IRF7mRNA在宫颈病变组织中的转录水平 新鲜组织采用Trizol法提取总RNA,用紫外分光光度计定量,OD值均在1.8~2.0之间。利用反转录试剂盒将总RNA逆转录合成cDNA。根据TLR4和IRF7的mRNA GenBank数据库序列,设计合成其特异性引物;TLR4(NM_138554.3)上游引物序列(5′-3′)为GAGGCAGCTCTTGGTGGAAGTTG,下游引物序列(5′-3′)为CAAGCACACAGGACCGACAC-3;IRF7(NM_001572.5)上游引物序列(5′-3′)为AGAAGAGCCTGGTCCTGGTGAAG,下游引物序列(5′-3)为AGGCTGAGGCTGCTGCTATCC,扩增片段分别为138 bp和276 bp。利用Maxima SYBR Green qRT-PCR Master Mix试剂盒检测目的基因的表达情况,并将GADPH作为内参照。GADPH(NM_002046.6)上游引物序列(5′-3′)为TGCACCACCAACTGCTTAGC,下游引物序列(5′- 3)为GGCATGGACTGTGGTCATGAG,扩增片段大小为87 bp。总反应体积为25 μL,反应条件为50℃,2 min,95℃预变性10 min,95℃变性15 s,60℃变性延长60 s,共进行 40 个循环扩增。采用相对定量公式2-△△Ct计算TLR4和IRF7蛋白的相对表达量。
1.3.2 免疫组织化学法检测TLR4和IRF7蛋白在宫颈病变组织中的表达水平 鼠抗人TLR4和IRF7单克隆抗体,克隆号分别为:ab22048和ab62505,石蜡组织用常规二甲苯将石蜡组织切片脱蜡,梯度醇水合后修复微波抗原,加入适量的H2O2阻断内源性过氧化物酶,之后滴加一抗(TLR4和IRF7,1∶30稀释)置于4℃冰箱过夜。滴加通用二抗(PV9000 Immuno-Bridge,GBI公司)各步间隔磷酸缓冲盐溶液(PBS缓冲液)冲洗10 min。DAB显色,苏木素复染,常规脱水,透明封片。以磷酸缓冲盐溶液代替一抗作为阴性对照。结果判断:在显微镜下观察每一张切片且随机选取5个视野,每个视野计数30个细胞,以着色细胞数和染色程度综合判断[5],最终结果采用双盲法由两位病理科医师分别观察所获得的一致意见。TLR4和IRF7表达主要以细胞浆,出现棕黄色颗粒为阳性。细胞染色百分率判定以记录各切片的染色细胞百分比例为准,染色细胞数少于5%被视为-,5%~25%为+,26%~75%为++;大于75%者为+++。染色强度判定:没有显色或显色不清视为-,浅黄色为+分,棕黄色为++,深棕色为+++。综合积分计算公式为综合积分=(染色细胞分数+染色强度分数)/2。

2 结果
2.1 TLR4及IRF7mRNA在宫颈病变组织中表达qRT-PCR结果显示,慢性宫颈炎和CSCC组中TLR4 mRNA的相对表达不同,其表达量分别为(2.251±1.491)、(21.48±17.01)。IRF7 mRNA的相对表达量分别为(1.403±0.908)、(13.830±8.345)。TLR4及IRF7 mRNA在CSCC的表达水平均显著增高,且差异具有统计学意义(P<0.05),见图1。


注:TLR4 mRNA在CSCC与慢性宫颈炎组织中比较,*P<0.05;IRF7 mRNA在CSCC与慢性宫颈炎组织中比较,*P<0.05。图1 TLR4和IRF7 mRNA相对表达水平
2.2 免疫组化检测TLR4、IRF7蛋白在宫颈病变组织中的表达免疫组化结果显示,TLR4阳性表达部位主要定位于细胞质,染色呈黄色或棕黄色。而IRF7在CINⅡ-Ⅲ和CSCC中出现细胞质及细胞核表达,见图2。TLR4蛋白在慢性宫颈炎上皮组织中以阴性为主,在CINⅡ-Ⅲ组织中以(+和++)为主,在CSCC组织中以(++和+++)为主,随着宫颈病变的加重其蛋白表达显著增加且各组间的表达差异有统计学意义(P<0.05)。与CSCC的临床病理特征进行比较,发现TLR4蛋白表达量与肿瘤的分化程度呈正相关(χ2=3.106、P<0.05),但与临床分期、是否有淋巴结转移及肿瘤大小无相关性(χ2=0.420、0.947、0.268,P>0.05,)。IRF7蛋白在慢性宫颈炎上皮组织中以阴性为主,在CINⅡ-Ⅲ组织中以(++和+++)为主,在CSCC组织中以(+和++)为主,在CINⅡ-Ⅲ组织中表达为最高,其次在CSCC组织中高表达。与子CSCC的临床病理特征进行比较,发现IRF7蛋白表达量与肿瘤的分化程度呈正相关(χ2=3.512,P<0.05),但与临床分期、是否有淋巴结转移及肿瘤大小无相关性(χ2=1.052、0.449、1.159,P>0.05),见表1。TLR4和IRF7蛋白在CINⅡ-Ⅲ及CSCC组织中的表达水平呈正相关见表(r=0.860,r=0.962,P<0.05),见表2、3。

图2 TLR4及IRF7蛋白在不同宫颈病变组织中的表达(×200)

表1 TLR4及IRF7在不同宫颈病变组织中的表达及与CSCC临床病理参数的关系/例

表2 CSCC组织中TLR4及IRF7蛋白表达水平的相关性分析/例
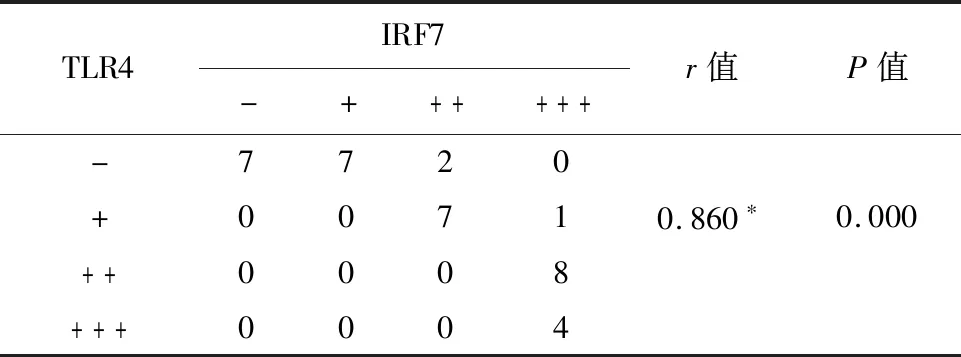
表3 CINⅡ-Ⅲ组织中 TLR4及IRF7蛋白表达水平的相关性分析/例
3 讨论
TLR4是 Toll样受体家族中成员之一,属于I型跨膜蛋白,主要识别细菌成分和病毒成分。其细胞外结构区域能够识别病原体相关的分子模式和损伤相关的分子模型,而细胞内结构区域能够通过髓样分化因子(MyD88)激活下游信号通路。相关研究发现,TLR4不仅分布于各类免疫细胞,介导免疫及炎症反应。而且也表达于肿瘤细胞中,参与肿瘤微环境,与多种恶性肿瘤的发生有关[6]。子宫颈鳞状细胞癌的发生和发展与HPV的感染有着密切的关系。宫颈上皮细胞被HPV病毒感染后,TLR4可以以病原体相关分子模式的形式识别它。此外,宫颈上皮细胞的增殖是由肿瘤微环境中致瘤分子表达的变化引起的。干扰素调节因子7(IRF7)是IRF家族中对IFN基因的表达起重要作用的调节因子并且具有抗肿瘤活性。本研究就宫颈病变中TLR4和IRF7的表达情况以及相关性进行了分析。
实验结果显示,TLR4 mRNA和蛋白的表达水平均随着宫颈病变的进展而不同程度的增加,在慢性宫颈炎、CINⅡ-Ⅲ和CSCC组织中表达呈现递增趋势。IRF7 mRNA和蛋白的表达水平在CINⅡ-Ⅲ和CSCC组织中与慢性宫颈炎组织比较显著增加,尤其在CINⅡ-Ⅲ组织中表达增加更为显著。与CSCC临床病理参数进行比较分析发现,TLR4及IRF7蛋白均随着分化程度的降低其表达率增加,但与其他临床病理参数无相关性。相关研究结果表明,TLR4 在CSCC组织中高表达且活性增高,其表达与宫颈组织病变的病理分级一致,尤其在浸润癌中表达高于CIN组织,并促进了子宫颈鳞状细胞癌Hela细胞系的增殖和其抗凋亡能力[7]。TLR4激活下游的NF-kb 途径,促进了子宫颈鳞状细胞癌免疫抑制细胞因子IL-6 和 TGF-βl的产生。也有相关研究报道显示,在CSCC组织中TLR4 表达下调,这种表达下调与HPV 病毒整合于宿主宫颈上皮细胞后产生的一种重要的标记物P16INK4A的表达相关[5]。这一研究结果与本研究结果正好相反。这提示,TLR4在CSCC发生发展中的作用可能受多方面的影响,有些因素可能协同TLR4 促进子宫颈鳞状细胞癌的进展,则有些因素可能抑制宫颈病变组织中的TLR4表达。
有研究者以尖锐湿疣体患者为研究对象分别采用实时荧光定量PCR和免疫组织化学方法在mRNA和蛋白表达水平上对组织标本中的IRF7进行检测,发现 IRF7 能调节干扰素的表达,参与机体抗HPV的局部免疫反应[8]。也有研究报道,肝细胞感染病毒时IRF7具有抵御病毒作用,有效的保护肝细胞[9]。由于CSCC的发生、发展与HPV感染密切相关,推测IRF7在子宫颈鳞状细胞癌的发展过程中也起着重要作用。有研究报道,病毒感染和特异的配体对Toll样受体的激活,通过TBK1/IKK诱发IRF7 羧基端磷酸化,磷酸化的 IRF7进入细胞核诱导干扰素的分泌,从而诱导宿主的天然免疫抗病毒反应[10]。根据本研究相关分析结果显示,在CINⅡ-Ⅲ和CSCC组织中,TLR4和IRF7蛋白表达呈正相关,而且IRF7在CINⅡ-Ⅲ组织中表达显著高于CSCC,其表达部位由细胞浆转向细胞核表达,提示HPV病毒感染对Toll样受体的激活,可能通过诱发IRF7磷酸化进入细胞核从而发挥宿主天然免疫抗病毒反应,但具体机制需要进一步深入研究。
- 新疆医科大学学报的其它文章
- α突触核蛋白病研究进展

