他克莫司对特发性膜性肾病患者血清M型磷脂酶A2受体、1型血小板反应蛋白7A域表达的影响Δ
王桃霞,柴丽军,李桂英,刘晓丽
(1.河北工程大学附属医院肾内科,河北 邯郸 056002; 2.邯郸市永年区第一医院妇科,河北 邯郸 056700)
膜性肾病是一个病理形态学名词,按病因分为特发性膜性肾病(idiopathic membranous nephropathy,IMN)、继发性膜性肾病及家族性膜性肾病[1]。IMN的病理表现为肾小球毛细血管襻上皮侧有大量免疫复合物沉积,该沉积局限于肾小管基底膜的上皮侧,通常不伴肾小管固有细胞增殖和局部炎症,依据基底膜的病变严重程度分为5期[2-5]。IMN临床表现为大量蛋白尿,可表现为肾病综合征,也可见无症状、非肾病范围的蛋白尿[6]。对于存在大量蛋白尿的IMN患者,目前建议采用积极的免疫抑制治疗。IMN临床预后不一,可表现为自发缓解、持续蛋白尿伴肾功能稳定及持续蛋白尿伴肾功能进行性减退[7]。IMN免疫治疗方案的选择是当前研究的热点,他克莫司是一种新型免疫抑制剂,目前逐渐应用于IMN患者。本研究探讨了他克莫司对IMN患者血清M型磷脂酶A2受体(PLA2R)和1型血小板反应蛋白7A域(THSD7A)表达的影响,现报告如下。
1 资料与方法
1.1 资料来源
选取2016年3月至2018年3月河北工程大学附属医院(以下简称“我院”)收治的IMN患者120例。IMN诊断参照中华医学会肾脏病学分会的相关诊断标准。纳入标准:经肾脏病理活检诊断为Ⅱ期IMN;依从性好,年龄>18岁;大量蛋白尿(>6.5 g/24 h)。排除标准:合并内分泌或其他疾病可能影响本研究相关因子水平检测者;自身免疫系统疾病者;继发性膜性肾病者;妊娠、哺乳、精神疾病或合并认知障碍不能配合研究者;近3个月内接受激素或免疫抑制剂治疗,影响PLA2R和THSD7A水平检测者。本研究经伦理委员会批准,所有患者均知情同意。根据患者选择的治疗方案分为观察组和对照组,每组60例。观察组患者中,男性34例,女性26例;平均年龄(47.2±10.5)岁。对照组患者中,男性33例,女性27例;平均年龄(52.6±12.7)岁。两组患者一般资料相似,具有可比性。
1.2 方法
参照中华医学会《原发性肾病综合征的免疫抑制剂治疗》[6]进行治疗。(1)观察组患者给予他克莫司胶囊(规格:1 mg/0.5 mg),起始剂量为0.03~0.05 mg/(kg·d),早餐、晚餐前1 h服用,每次用药间隔12 h。服药2周后,复查血药浓度,初始6个月血药浓度需要维持在5~10 ng/ml,待病情缓解后逐步减量,最终维持治疗量,使血药浓度维持在3~5 ng/ml。(2)对照组患者给予注射用环磷酰胺(规格:0.2 g)750 mg/m2加入0.9%氯化钠注射液100 ml中,静脉滴注2 h,再给予0.9%氯化钠注射液250 ml+维生素B60.3 g,静脉滴注,1个月1次,连续治疗6个月,若6个月后无效即停用,完全缓解或部分缓解的患者需延长3个月治疗,累积治疗剂量≤9 g。(3)两组患者均给予醋酸泼尼松片(规格:5 mg)0.5 mg/(kg·d),获得临床缓解2周后开始逐步减量,每2周减少5 mg,直至维持剂量10 mg/d后长期维持治疗。
1.3 观察指标
(1)临床疗效。(2)治疗前后各临床指标水平。(3)血清PLA2R和THSD7A表达情况的检测[8]:试剂盒分别购自德国殴蒙和上海易利,依据说明书进行各步骤。殴蒙试剂盒说明书示PLA2R-AB检测范围为2~1 500 IU/ml,≥20 IU/ml为阳性;抗THSD7A试剂盒检测浓度为12~400 g/L,<12 g/L均为阴性。(4)不良反应发生情况。
1.4 疗效评定标准
完全缓解:24 g尿蛋白定量<0.2 g,且血清白蛋白>35 g/L;部分缓解:水肿减轻,24 h尿蛋白定量降至0.2~3.4 g,且尿蛋白相对基线降低≥50%,血浆白蛋白为3.0~3.5 g/L;无效:未达到上述指标[8]。总缓解率=(完全缓解病例数+部分缓解病例数)/总病例数×100%。
1.5 统计学方法
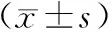
2 结果
2.1 两组患者临床疗效比较
观察组患者的总缓解率明显高于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组患者临床疗效比较[例(%)]Tab 1 Comparison of clinical efficacy between two groups [cases(%)]
注:与对照组比较,aP<0.05
Note: vs. the control group,aP<0.05
2.2 两组患者治疗前后临床指标水平比较
治疗前,两组患者各临床指标水平的差异均无统计学意义(P>0.05);治疗后,两组患者24 h尿蛋白量、三酰甘油及总胆固醇水平较治疗前明显降低,血清白蛋白水平较治疗前明显升高,且观察组患者上述指标水平明显优于对照组,差异均有统计学意义(P<0.05),见表2。
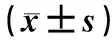
表2 两组患者治疗前后临床指标水平比较Tab 2 Comparison of clinical indicators between two groups before and after treatment
注:与治疗前比较,aP<0.05;与对照组比较,bP<0.05
Note: vs. before treatment,aP<0.05; vs. the control group,aP<0.05
2.3 两组患者治疗前后血清PLA2R和THSD7A阳性情况比较
治疗前,两组患者PLA2R、THSD7A阳性率的差异均无统计学意义(P>0.05);治疗后,观察组患者PLA2R、THSD7A阳性率明显低于对照组,差异均有统计学意义(P<0.05),见表3。
2.4 两组患者不良反应发生情况比较
观察组患者出现血肌酐轻度升高1例,手部颤抖1例,未出现肝损伤,不良反应发生率为3.3%(2/60)。对照组患者出现恶心、呕吐3例,白细胞计数降低3例,脱发2例,轻度肝损伤2例,不良反应发生率为16.7%(10/60)。观察组患者不良反应发生率低于对照组,差异有统计学意义(P<0.05)。

表3 两组患者治疗前后血清PLA2R和THSD7A阳性情况比较[例(%)]Tab 3 Comparison of positive rate of serum PLA2R and THSD7A between two groups before and after treatment [cases(%)]
注:与治疗前比较,aP<0.05;与对照组比较,bP<0.05
Note: vs. before treatment,aP<0.05; vs. the control group,aP<0.05
3 讨论
病因未明的膜性肾病统称IMN。IMN诊断较为困难,需要排除所有继发性膜性肾病。近年来,相关研究结果发现,导致IMN发生的2个主要足细胞自身抗原分别是2009年Beck等发现的PLA2R和2014年Tomas等发现的THSD7A,由于其在肾脏组织中具有较高的特异性,目前已经被广泛应用于临床IMN的诊断[9-11]。既往多采用环磷酰胺联合糖皮质激素治疗IMN,但是缓解率不高,而且副作用大。他克莫司是新型强效免疫抑制剂,作用与环孢素相同,但效果为环孢素的100倍;他克莫司与神经钙调蛋白酶结合后使后者活性受到抑制,诱导早期淋巴细胞活化,影响白细胞介素2、白细胞介素4等细胞因子生存,抑制T细胞活化,目前被广泛应用于IMN的治疗过程[12-13]。
本研究结果显示,观察组患者的总缓解率明显高于对照组,差异有统计学意义(P<0.05),提示以他克莫司为主要方案的免疫抑制治疗具有较高的临床缓解率[14]。进一步对比两组患者不良反应的发生情况,结果显示,观察组患者不良反应发生率低于对照组,差异有统计学意义(P<0.05)。可见他克莫司具有较高的缓解率,且不良反应较少。
人PLA2R为存在于人肾小球足细胞膜上的一种跨膜糖蛋白,目前研究结果提示75%的IMN患者可检测出抗PLA2R抗体。PLA2R在IMN进展过程中具有重要的临床意义,血清中PLA2R抗体与IMN患者肾脏组织中PLA2R结合后诱导PLA2R构象变化,导致原位免疫复合物形成,激活补体系统从而诱发级联反应,进而导致足细胞损伤,进一步诱发肾小球结构和功能的紊乱,导致IMN的临床症状出现[15-16]。2017年Kronbichler等[10]对154例抗PLA2R抗体阴性的IMN患者的血清进行检测,发现15例(约9.7%)的患者体内存在抗THSD7A抗体,免疫荧光染色提示THSD7A表达于足细胞,而在血清抗PLA2R抗体阳性患者的血清中未检测到THSD7A抗体,从而发现THSD7A是IMN的另一靶抗原。THSD7A同PLA2R一样主要表达于足细胞膜,而在内皮细胞及系膜细胞少有表达;与抗PLA2R抗体类似,抗原抗体结合形成抗原抗体复合物,激活补体系统,进而形成膜攻击复合物C5b-9,损伤足细胞,破坏肾小球的滤过屏障,从而导致机体产生蛋白尿。THSD7A在IMN患者中的表达率较低,但对诊断IMN具有较强的特异性,研究结果提示仅约5%的IMN患者THSD7A阳性[17]。对比我院120例IMN患者的临床资料发现,仅5%的患者THSD7A阳性。本研究结果显示,治疗后,观察组患者PLA2R、THSD7A阳性率明显低于对照组,差异均有统计学意义(P<0.05),提示他克莫司可以改善免疫机能,纠正患者自身免疫损伤。
综上所述,他克莫司有助于提高IMN的缓解率,降低PLA2R和THSD7A的表达,且不良反应少。

