乙醇雾化对金黄色葡萄球菌肺炎大鼠炎症反应的调控作用Δ
尚莉莉,刘 凯,全爱君,蔡国锋,梅花·尼合买提,胡才宝
(1.黑龙江中医药大学附属第二医院重症医学科,黑龙江 哈尔滨 150001; 2.新疆维吾尔自治区阿勒泰地区哈萨克医院内科,新疆 阿勒泰 836500; 3.浙江医院重症医学科,浙江 杭州 310013)
金黄色葡萄球菌肺炎是由金黄色葡萄球菌引起的急性化脓性肺炎,临床上一般采用甲氧西林、万古霉素等抗菌药物进行治疗[1-3]。抗菌药物一般以致病菌的某种必需物质为靶向,对致病菌的代谢进行干扰,从而达到杀死致病菌的目的[4-5]。但随着抗菌药物使用时间的增加,金黄色葡萄球菌的耐药性也不断增强,其对抗菌药物的敏感性不断降低,故抗菌药物治疗金黄色葡萄球菌肺炎的效果逐渐降低[6-7]。有研究结果表明,金黄色葡萄球菌对醇类物质依然保持较高的敏感度,浓度为70%的乙醇可以在1 min内杀死几乎全部的耐甲氧西林金黄色葡萄球菌[8],为使用乙醇治疗金黄色葡萄球菌肺炎提供了可能性。但是,乙醇治疗细菌性肺炎也会受到诸多条件的限制,比如使用浓度、给药方式等都会影响治疗效果[9]。也有研究结果指出,将肺组织暴露在乙醇环境中,会增加肺部发生炎症的风险[10]。因此,本研究采用10%、40%和70%的乙醇对感染金黄色葡萄球菌肺炎的大鼠进行雾化吸入治疗,对其支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)细胞分类计数、肺组织中炎性因子的含量和肺组织中炎症细胞通路相关基因表达的影响,明晰乙醇是否对金黄色葡萄球菌肺炎有治疗效果,是否会对肺组织造成损伤,以期为乙醇治疗肺炎提供参考。
1 材料
1.1 动物
无菌雄性实验大鼠110只,体质量(240±5) g,8~9周龄,由黑龙江中医药大学提供。将大鼠按照窝别、体质量随机分组,其中对照组20只;剩余90只在造模后,取10只大鼠判断造模是否成功,其余80只分为模型组、低浓度组、中浓度组和高浓度组,每组20只。
1.2 药品与试剂
无水乙醇(美国Merck公司,货号:200-578-6),戊巴比妥钠(美国Sigma公司,货号:P3761),PBS缓冲液(索莱宝公司,货号:P1020),蒸馏水(屈臣氏公司,批号:SC10644011600120)。
2 方法
2.1 金黄色葡萄球菌肺炎大鼠模型的建立
用4%戊巴比妥钠腹腔注射麻醉大鼠,将其仰卧位固定于实验台上,显露声门,用钝头针插入气管,将金黄色葡萄球菌悬液0.2 ml缓慢注入气管,保持头高脚低位20 min,并左右旋转体位,使菌液均匀分布于大鼠的两肺。接种细菌6 h后随机从模型组中取10只大鼠处死并分离出肺组织,用血平板做肺组织匀浆的菌落计数,以证实肺炎模型是否成功建立。
2.2 给药方法
从造模第1日即进行雾化治疗,共7 d,具体处理方法如下。(1)对照组:用雾化管对准其鼻面部固定,雾化蒸馏水,1次2 min,1日1次,共7 d。(2)模型组:模型大鼠给予雾化蒸馏水,1次2 min,1日1次,共7 d;雾化方法同上。(3)低浓度组:模型大鼠给予雾化10%乙醇,1次2 min,1日1次,共7 d;雾化方法同上。(4)中浓度组:模型大鼠给予雾化40%乙醇,1次2 min,1日1次,共7 d;雾化方法同上。(5)高浓度组:模型大鼠给予雾化75%乙醇,1次2 min,1日1次,共7 d;雾化方法同上。
2.3 检测指标
2.3.1 BALF细胞分类计数:在第7日给药后,取大鼠BALF,在4 ℃、1 500 r/min下离心10 min,弃上清液,用PBS缓冲液溶解沉淀,取100 μl用Z2细胞计数仪计算出每毫升灌洗液中所含细胞总数;另取10 μl制作细胞涂片染色,显微镜下进行细胞分类计数。在无菌条件下,准确吸取BALF样本5 ml,并接种于10%胰酪胨大豆肉汤培养基50 ml内,(36±1)℃条件下培养24 h。用10 μl取菌环取培养物分别划线接种到血平板,放置于培养箱中(36±1)℃培养24 h。然后观察金黄色葡萄球菌的菌落情况,并进行菌落计数。
2.3.2 肺组织中炎性因子的含量:大鼠肺组织匀浆中白细胞介素(IL)1、IL-6、IL-8、IL-10、干扰素γ(INF-γ)及肿瘤坏死因子α(TNF-α)的含量采用酶联免疫吸附法测定,试剂盒购自R&D公司,操作及方法按试剂盒说明书进行;各检测指标用组织总蛋白进行相对定量的校正,采用考马斯亮蓝法检测组织匀浆中的总蛋白,总蛋白检测试剂盒购自南京建成生物有限公司。
2.3.3 肺组织相关基因的表达:将大鼠肺组织于液氮中冷冻后在-70 ℃条件下保存,采用逆转录-聚合酶链反应法检测大鼠肺组织Toll样受体4(Toll-like receptor 4,TLR4)、髓样分化因子88(myeloid differentiation factor 88,MyD88)、肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)、TANK结合激酶1(TANK-binding kinase 1,TBK1)和核因子κB(nuclear factor kappa B,NF-κB)基因的相对表达量(双标准曲线法),RNA提取试剂盒、反转录试剂盒及Realtime PCR试剂盒均购自大连宝生物公司,操作及方法按试剂盒说明书进行。
2.4 统计学方法
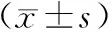
3 结果
3.1 五组大鼠BALF细菌计数比较
给药第7日,对照组大鼠未检出金黄色葡萄球菌,模型组大鼠的细菌计数明显高于其他组,差异均有统计学意义(P<0.05);随着乙醇浓度的升高,细菌计数呈降低趋势,其中低浓度组大鼠的细菌计数明显高于中浓度组、高浓度组,差异均有统计学意义(P<0.05),见表1。
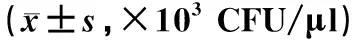
表1 五组大鼠BALF细菌计数比较Tab 1 Comparison of counting of BALF among five
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低浓度组比较,cP<0.05
Note:vs. the control group,aP<0.05;vs.the model group,bP<0.05;vs. the low concentration group,cP<0.05
3.2 乙醇对大鼠BALF细胞分类计数的影响
BALF细胞分类计数情况见表2。各组间淋巴细胞数的差异无统计学意义(P>0.05)。模型组大鼠BALF中细胞总数、巨噬细胞数及中性粒细胞数明显高于其他各组,差异均有统计学意义(P<0.05);白细胞数明显低于对照组(P<0.05),但与低浓度组和高浓度组的差异无统计学意义(P>0.05)。随着乙醇浓度的升高,细胞总数、巨噬细胞数及中性粒细胞数呈降低趋势,其中低浓度组大鼠的细胞总数明显高于中浓度组、高浓度组和对照组(P<0.05),巨噬细胞数和中性粒细胞数显著高于对照组、中浓度组和高浓度组(P<0.05);高浓度组大鼠的巨噬细胞数明显低于低浓度组和中浓度组(P<0.05);中浓度组、对照组大鼠的白细胞数明显高于低浓度组、高浓度组,差异均有统计学意义(P<0.05)。
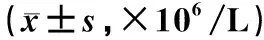
表2 五组大鼠BALF细胞分类计数比较Tab 2 Comparison of classification of BALF among five
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低浓度组比较,cP<0.05;与中浓度组比较,dP<0.05
Note:vs. the control group,aP<0.05;vs. the model group,bP<0.05;vs. the low concentration group,cP<0.05;vs. the medium concentration group,dP<0.05
3.3 对大鼠肺组织中炎性因子含量的影响
模型组大鼠肺组织中各炎性因子含量明显高于其他各组,差异均有统计学意义(P<0.05)。随着乙醇浓度的升高,炎性因子含量呈现先降低后升高的趋势,其中低浓度组大鼠肺组织中的IL-1、IL-8、IL-10、INF-γ和TNF-α含量明显高于对照组、中浓度组和高浓度组,高浓度组大鼠上述指标含量明显高于对照组和中浓度组,差异均有统计学意义(P<0.05);而中浓度组大鼠肺组织中各炎性因子含量与对照组的差异无统计学意义(P>0.05),见表3。

表3 五组大鼠肺组织炎性因子含量比较Tab 3 Comparison of inflammatory factors in lung tissues among five group of rats
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低浓度组比较,cP<0.05;与中浓度组比较,dP<0.05
Note:vs. the control group,aP<0.05;vs. the model group,bP<0.05;vs. the low concentration group,cP<0.05;vs. the medium concentration group,dP<0.05
3.4 对大鼠肺组织相关基因表达的影响
模型组大鼠各目的基因的相对表达量明显高于对照组,差异有统计学意义(P<0.05)。随着乙醇浓度的升高,各目的基因的相对表达量也呈现先降低后升高的趋势,其中低浓度组、高浓度组大鼠各目的基因的相对表达量的差异均无统计学意义(P>0.05);而中浓度组大鼠除TBK1外,其他目的基因的相对表达量均明显低于低浓度组、高浓度组,差异均有统计学意义(P<0.05),见表4。
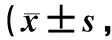
表4 五组大鼠肺组织相关基因的相对表达量比较目的基因/内参基因)Tab 4 Comparison of relative expression of related genes in lung tissues among five group of rats gene/reference gene)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低浓度组比较,cP<0.05;与中浓度组比较,dP<0.05
Note:vs. the control group,aP<0.05;vs. the model group,bP<0.05;vs. the low concentration group,cP<0.05;vs. the medium concentration group,dP<0.05
4 讨论
金黄色葡萄球菌是广泛分布于自然环境中的革兰阳性菌,也是具有高致病性又难以彻底消除的微生物,上呼吸道感染患者的带菌率可达80%[11]。在本研究感染模型的建立过程中,大鼠在注入菌液第2日就出现了食欲减退、弓背蜷缩、呼吸困难、反应迟钝和精神状态萎靡等现象,这与已报道的动物肺炎感染模型的症状比较相似[12]。大鼠金黄色葡萄球菌肺炎感染模型建立与评估结果表明,肺组织匀浆中金黄色葡萄球菌浓度>1 000 CFU/μl,即可说明模型建立成功[13]。在本研究中,对大鼠肺组织匀浆进行菌落计数,金黄色葡萄球菌浓度达1.78×103CFU/μl,说明实验模型可用于后续研究。
支气管肺泡灌洗(bronchoalveolar lavage,BAL)技术是将0.9%氯化钠溶液灌注到支气管的肺泡中,并立即收集肺泡表面的液体,检测其中成分和具有诊断价值的物质的方法,是一种用来探讨肺组织局部免疫病理过程的相对安全有效的检测方法[14]。BALF能直接反映出感染肺炎的肺泡结构中细胞的类型和数量[15]。本研究中,在乙醇雾化治疗的第7日对BALF中金黄色葡萄球菌的计数结果表明,不同浓度的乙醇雾化治疗均具有杀死感染金黄色葡萄球菌肺炎大鼠致病菌的作用,尤其是中浓度组和高浓度组大鼠的致病菌已经接近于全部消失,表明乙醇雾化确实有治疗大鼠金黄色葡萄球菌肺炎的作用。白细胞、巨噬细胞、淋巴细胞和中性粒细胞都是动物体内重要的免疫细胞,淋巴细胞主要对病毒性肺炎发生反应,而对细菌性肺炎不敏感,故本研究中,模型组和对照组大鼠BALF淋巴细胞的差异无统计学意义(P>0.05)。而巨噬细胞和中性粒细胞则会对细菌性肺炎产生免疫反应,因此,上述2类细胞数量会因大鼠感染金黄色葡萄球菌肺炎而出现增加,本研究结果也证明了该说法,但经过低浓度和高浓度的乙醇雾化治疗后,巨噬细胞数和中性粒细胞数出现了不同程度的降低。研究结果表明,金黄色葡萄球菌在感染肺组织后,会产生次级毒素,对白细胞造成杀伤,从而使肺组织中的白细胞数降低[16],这与本研究结果相似;大鼠在感染金黄色葡萄球菌肺炎后,BALF中的白细胞数显著降低,经过乙醇雾化治疗后,白细胞数有不同程度的升高。巨噬细胞、中性粒细胞和白细胞在治疗前后的变化也间接证明了乙醇雾化确实有杀死金黄色葡萄球菌的作用。但这种治疗效果并没有随雾化乙醇浓度的增加而有所提高,反而是中浓度的乙醇雾化治疗后,BALF中的巨噬细胞、中性粒细胞和白细胞水平与对照组比较接近。这可能是因为在乙醇浓度较低时,乙醇雾化的治疗效果与浓度呈正相关;但乙醇浓度过高时,乙醇反而会对动物体本身的细胞造成杀伤,从而使机体的细胞数降低。
在细菌或病毒感染人体组织后,体内的免疫系统会对病原产生免疫反应,产生IL-1、IL-6、IL-8、IL-10、INF-γ和TNF-α等炎性因子抵御细菌或病毒的入侵,这些炎性因子保持一定含量时可以发挥保护机体的作用,但其含量过高反而会对机体产生危害,加重机体组织的损伤。本研究中,模型组大鼠的各炎性因子含量均明显高于对照组,差异均有统计学意义(P<0.05),说明大鼠在感染金黄色葡萄球菌后,其免疫系统确实产生了大量的炎性因子,以抵抗病菌的侵袭,但过高含量的炎性因子会对正常的肺泡细胞起到杀伤作用,从而加重肺炎的症状。本研究结果显示,较低浓度乙醇雾化有降低肺组织炎性因子含量的作用;而高浓度的乙醇雾化后,大鼠炎性因子含量反而高于中浓度组,这可能是因为高浓度的乙醇对肺泡细胞造成了损伤,刺激了肺组织的受损细胞产生更多的炎性因子。
TLR4是Toll受体家族的成员,可以对病菌的脂多糖产生反应,从而诱导细胞中与免疫相关的通路蛋白,如TRAF6、TBK1、MyD88及NF-κB的表达,进而产生炎性因子。有研究结果表明,高浓度的乙醇会通过TLR4诱导的细胞信号通路,增加TRAF6、TBK1、MyD88及NF-κB等基因的表达,从而过度地刺激免疫细胞产生炎性因子,对机体组织造成损伤[17]。本研究中,模型组大鼠的TLR4基因及其所调控的下游TRAF6、TBK1、MyD88及NF-κB基因的表达均明显高于对照组,差异均有统计学意义(P<0.05),说明金黄色葡萄球菌可刺激由TLR4调控的细胞免疫通路,使机体发生免疫反应,这与本研究中炎性因子的研究结果一致。而乙醇雾化治疗后,相关基因的表达与炎性因子含量的检测结果相似,呈现出先升高后降低的趋势。说明中浓度的乙醇可在不过分刺激机体免疫反应的同时,杀死致病菌,从而抑制机体过度的免疫反应,而高浓度的乙醇有可能对机体组织造成损伤。
5 结论
抗菌药物主要通过抑制致病菌生存所必需的蛋白来达到杀死病菌的目的,而随着抗菌药物的长期大量使用,生存压力使致病菌逐渐变异,对抗菌药物产生了耐药性,甚至抗菌药物换代的速度已经无法跟上致病菌的变异速度。中、高浓度的乙醇则主要通过使致病菌细胞内的蛋白变性来杀死致病菌,致病菌对乙醇的敏感度始终较高,而雾化的方式又使得乙醇直接进入肺内杀死致病菌成为了可能。本研究结果证明,乙醇雾化确实可以杀伤感染大鼠的金黄色葡萄球菌,但低浓度乙醇的治疗效果并不显著,而高浓度乙醇在杀伤致病菌的同时还会对正常机体细胞造成损伤,因此,在临床使用时还需进一步探讨其最佳使用浓度。

