一例猪伪狂犬病毒实验室诊断报告
毕志学 胡标猛 林 淼
(湖北省麻城市张家畈畜牧兽医技术服务中心,湖北麻城 438300)
猪伪狂犬病(porcine pseudorabies,PR)是由伪狂犬病病毒(PRV,猪疱疹病毒Ⅳ型)引起的多种家畜、野生动物的一种以发热、奇痒(猪除外)、脑脊髓炎为主要临床症状的急性传染病。猪是该病的自然宿主和主要传染源[1]。我国自 1948年刘永纯报道该病以来,在多个省(市)流行。虽然我国大多数规模化猪场采取了猪伪狂犬的净化措施,但是由于我国养殖环境较为复杂,2012年以来猪伪狂犬病的发生在我国呈由北向南逐渐蔓延的趋势,说明伪狂犬病已依然是严重危害我国养猪业的主要疫病之一。
2019年4月份XX地区规模化猪场疑似出现猪伪狂犬病的疫情,母猪主要表现为流产、产死胎、弱仔,7日龄以内仔猪多表现为口吐白沫,四肢呈划水样,头向后仰等临诊症状,剖检病猪多可见扁桃体发生溃疡,肝脏表面出现大小不等的灰白色坏死灶,肾脏表面有大小不等的点状出血。本实验通过对该猪场进行血清学和病原学的检测,确定此次疫情是由猪伪狂犬病毒变异株引起,并通过紧急免疫等手段成功的控制了疫情的蔓延,同时为养殖户挽救巨大的经济损失。
1 材料与方法
1.1 材料
1.1.1 样品采集与处理
随机抽取30份发病与正常母猪待检血清,置于4℃保存备用。
采集自XX地区某规模化猪场流产胎儿、死胎及发病仔猪的脑、扁桃体、肺脏等组织,加适量灭菌的PBS液,研磨制成1:10的混悬液,反复冻融3次后在4℃条件下5000 r/min离心10 min,收集上清。置于-80℃保存备用。
1.1.2 试剂
病毒 DNA/RNA 提取试剂盒、2 × EX Taq PCR 购自、DNA Marker DL2000 等购自 TaKaRa 公司;猪伪狂犬野毒抗体检测试剂盒为IDEXX公司产品。
1.2 方法
1.2.1 引物的合成
参考王宇等人发表的猪伪狂犬病毒gE基因合成2对猪伪狂犬病毒gE基因的特异性引物F1:5′-GACCATGCGGCCCTTTCTGC-3′,R1:5 ′ -GGTCCACCGGGCGCAGGCACTGC-3 ′;F2:5 ′ -GCCCCCGCGGTGCCTGCTGTA-3 ′,R2:5′-GTATTTAAGCGGGGCGGGACATCA-3′,其扩增目的片段大小分别为为890bp、850bp。引物送上海捷瑞生物工程有限公司合成。
1.2.2 血清学诊断
对发病猪群随机采集30份血清,其中编号1~10号为流产母猪血清,11-25号为正常母猪血清,26~30号为发病仔猪血清。按照IDEXX公司猪为狂犬野毒抗体检测试剂盒说明书对待检血清进行检测。
1.2.3 基因组DNA的提取
采集自XX地区某规模化猪场流产胎儿、死胎及发病仔猪的脑、扁桃体、肺脏等组织无菌条件下充分研磨,反复冻溶3次后,在4 ℃条件下12000 r/min离心10 min,取200 μl上清液于灭菌的1.5 ml离心管中,用X公司的动物血液/组织/分泌物/培养细胞基因组DNA/RNA提取试剂盒按步骤提取病毒DNA,并以提取的病毒基因组DNA作为PCR扩增的模板。
1.2.4 PCR扩增及程序
反应体系为50μl:2×EX Taq酶25 μl,上、下游引物各2 μl,DNA 模板 4 μl,灭菌双蒸水 17 μl。
反应程序:95 ℃ 预变性10 min,95 ℃变性50 s,63℃ 退火50 s,72 ℃延伸100 s,35个循环;72 ℃延伸10 min。取5 μlCR扩增产物经12 g/L的琼脂糖凝胶电泳进行鉴定,观察目的条带大小。
1.2.5 序列测定及生物信息学分析
PCR产物用DNA凝胶回收试剂盒纯化回收目的片段,样品送进行序列测定,并利用DNAStar中的MegAlign等分子生物学软件进行核苷酸序列及氨基酸序列遗传变异分析。
2 结果与分析
2.1 血清学检测结果
血清猪伪狂犬病毒检测结果显示,流产母猪猪为狂犬野毒抗体阳性率为100%,其感染后S/N值抗体水平处于感染中后期的抗体水平,仔猪阳性率为80%,其感染后S/N值相对处于一个感染初期的抗体水平,无异常母猪群阳性率47%。

(备注:S/N≤0.6判为阳性;S/N>0.7判为阴性;0.7≥S/N>0.6判为可疑。)
2.2 PCR扩增结果
利用设计的2对特异性引物,通过PCR方法从采集的发病猪组织样品中分别扩增出F1/R1、F2/R2基因,其扩增片段大小分别为890bp、850bp,与预期大小相符(见图1)。
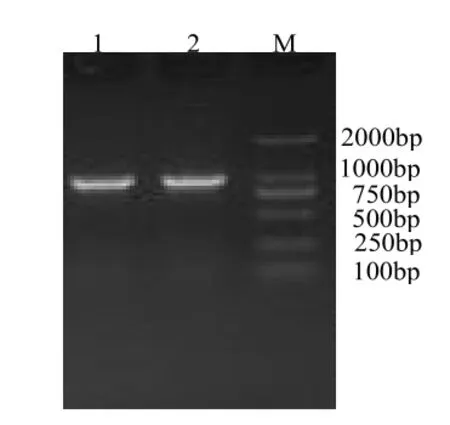
图1 PRV gE基因PCR扩增结果
2.3 序列分析
利用ContigExpress软件对1株猪伪狂犬病毒毒株F1/R1、F2/R2分段扩增的gE基因进行全基因序列的拼接,并与GenBank中已发表的猪伪狂犬病毒不同地区的代表株进行比对分析,结果表明分离的毒株全基因序列全长为1740bp,编码个氨基酸。利用生物学软件DNAStar对所获得的1株PRV gE全基因序列之间及其国内外分离毒株进行核苷酸遗传进化树分析及同源性比较。结果表明与国内分离的JS-2012株、ZM株、HB1株、Xiang A株,及国外分离的Rac1株共同在一个分支上,说明本次检测到的猪伪狂犬病毒与2011年后分离的变异毒株亲缘关系较近。同时与国内分离的经典毒株LA、PRV-SH、Ea、GDSH、Min-A、P-PrV、Fa、SXJC2011毒株位于一个大的分支,说明本次检测到的毒株与这些毒株存在一定的亲缘关系,另外这些经典毒株有部分已经作为疫苗株在我国广泛使用,说明以Ea株为代表的疫苗免疫产生的抗体能够对目前国内存在的猪伪狂犬病毒起到保护作用。而与国外代表毒株Becker、Nia-1、Kaplan等毒株不在一个分支上,说明与这些毒株的亲缘关系较远,其以这些毒株为基础生产的疫苗在一定程度上的免疫效果相对稍差。同源性分析显示本次检测到的猪伪狂犬病毒与近年分离的变异毒株JS-2012株、ZM株同源性为100%、与HB1、Xiang A、Rac1、LA、PRV-SH、Ea、GDSH、Min-A、P-PrV、Fa、SXJC2011等毒株同源性均在99%以上,而与国外国外代表毒株Becker、Nia-1、Kaplan等毒株同源性为96%以上,这些结果表明本次检测到的猪伪狂犬病毒与近年分离的变异毒株同源性最高,与国外分离毒株同源性相对较低,说明本次检测到的猪伪狂犬病毒为变异毒株。
3 讨论
2011年以来,我国多个省份陆续报道了猪伪狂犬基因缺失疫苗免疫猪场发生猪伪狂犬病的疫情,新发猪伪狂犬病的发病率和死亡率明显上升,且出现了新的发病特征[2]。据了解该猪场一直使用某进口厂家Barth-K 61毒株疫苗,种猪群每年免疫4次,从2017年6月份种猪群猪伪狂犬野毒抗体出现大约5%阳性率,后调整免疫剂量和免疫程序,生产处于相对较为稳定状态,直到今年3月份,母猪群突然出现大面积的流产现象,仔猪出现典型的伪狂犬感染症状,检测结果显示猪伪狂犬野毒抗体阳性率已从5%上升为70%,猪伪狂犬病毒为阳性。序列分析表明猪群存在的猪伪狂犬病毒与国内近年分离的变异毒株JS-2012株、ZM株同源性为100%、与其他国内分离毒株同源性均达到99%以上,与JS-2012株的亲缘关系最近,说明此次感染的猪伪狂犬病毒为变异毒株。针对此次疫情的发生,全群选用国产某厂家的猪伪狂犬病毒3基因缺失弱毒疫苗和灭活疫苗进行紧急免疫,疫情逐渐得到有效控制。据相关文献报道,现有不同毒株的国产和进口疫苗免疫后产生的中和抗体对新分离的猪伪狂犬病毒毒株中和能力较差,不足以提供完全保护,表明变异毒株可能存在一定的抗原变异[3]。猪伪狂犬病疫情在近年来的发生可能跟我国的养殖环境有关系,主要是中小规模养殖场缺乏有效的生物安全防范意识,疫苗接种不到位,免疫程序不合理,生长商品猪长期处于免疫抗体空白期等因素导致疫情的发生率居高不下。因此笔者建议中小规模养殖场一定要加强生物安全防范意识,做好后备猪引种的监测,定期对整个猪群进行抗体水平的监测工作,制定合理的免疫程序,选择免疫效果好、抗原含量高的疫苗进行免疫,采取综合性的、系统性的防控手段才能有效控制猪伪狂犬病的发生,最终做到猪伪狂犬病的净化。
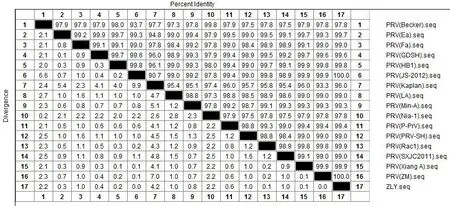
图2 PRV gE 基因核苷酸同源性分析

