携带抗FAP×抗CD3双特异性抗体重组溶瘤痘病毒的构建及其抗癌活性观察
施晋升,李峰,吴思慧,俞力超,刘黎琼,于峰
(1.江苏大学附属医院心胸外科,江苏镇江212001;2.江苏大学医学院,江苏镇江212013;3.深圳市南山区人民医院血液科,广东深圳5180052;4.江苏大学生命科学研究院,江苏镇江212013;5.上海市肿瘤研究所癌基因及相关基因国家重点实验室,上海200032)
肺癌的常规放化疗方案毒副反应明显且敏感度不高,靶向免疫治疗逐渐成为肺癌治疗策略之一。肿瘤微环境对肿瘤发生、进展以及治疗具有重要作用[1]。成纤维细胞是肿瘤微环境中重要的基质细胞,成纤维细胞活化蛋白(fibroblast activation protein,FAP)表达于 90%以上的基质成纤维细胞[2]。单纯靶向肿瘤细胞治疗的效果不甚理想,而靶向FAP阳性的肿瘤基质细胞能增强抗肿瘤效果[3]。
溶瘤病毒是一类经过基因改造后能选择性在肿瘤细胞内复制增殖,裂解肿瘤细胞后子代又能扩散到临近肿瘤细胞的病毒。该类病毒因特异性强、副反应小而成为肿瘤靶向治疗的新型工具[4]。目前已经有10余种溶瘤病毒用于临床试验,例如腺病毒、疱疹病毒和牛痘病毒(vaccinia virus,VV)等。牛痘病毒因其良好的安全性而被广泛应用于临床,例如作为疫苗消灭天花。此外,由于牛痘病毒具有溶瘤速度快、外源基因承载能力大(约25 kb)、溶瘤同时激发机体抗肿瘤免疫应答等优点成为溶瘤病毒的典型代表[5]。虽然临床研究显示,溶瘤痘病毒及其激活的免疫反应能在肿瘤组织被检测到,但其抗肿瘤效果仍不理想[6]。为了增强抗肿瘤效果,我们构建了携带抗FAP和抗小鼠CD3分子双特异性分子(BiTE.FAP)的重组溶瘤痘病毒(recombinant oncolytic double deleted vaccinia virus-Bispecific T cell Engager-FAP,rVVDD-BiTE.FAP),并在体外检测其对过表达FAP蛋白小鼠肺癌细胞的抑制效果。
1 材料与方法
1.1 材料
痘苗生长因子(vaccinia growth factor,VGF)基因缺失的亲本病毒vSC20、rVVDD-GFP病毒、pCDHFAP-GFP慢病毒质粒、pSEL2N1质粒、非洲绿猴肾CV-1细胞株、人骨肉瘤HuTK-143B细胞株由本实验室保存;小鼠肺癌LLC细胞株和小鼠肺癌LL/2细胞株购于南京凯基生物公司;LLC-GFP和LLCFAP细胞株是本课题组采用慢病毒转导构建而成的稳定细胞株;8~12周SPF级C57BL/6小鼠,雌雄不限,体重20~22 g,由江苏大学实验动物中心提供(合格证号:201607173);胎牛血清(美国 Gibco公司);RPMI1640、DMEM培养基(上海 HyClone公司);转染试剂Lipofectamine 2000(美国Invitrogen公司);BudR(美国Sigma公司);限制性内切酶NotI和EcoR V(美国NEB公司);PCR扩增引物由生工生物工程(上海)股份有限公司合成;MTS试剂盒(北京Promega有限公司);基因组抽提试剂盒及LDH试剂盒购自TaKaRa宝生物工程(大连)有限公司;IL-2和IFN-γ浓度检测用ELISA试剂盒(美国BD公司)。
1.2 pSEL2N1-BiTE-FAP重组质粒的构建
以pSEL2N1空载质粒为模板扩增PSEL-DsRed基因。所用的引物序列:PSEL-DsRed,上游5′-AATTCAAAAATTGAAATTTTATTTTTTTTTTTTGGAATATAAATAAATGGCCTCCTCCGAGAAC-3′,下游5′-GGTATCTTGCGGGATATCCTACAGGAACAGGTGGTG-3′。以pCDH-FAP-GFP质粒为模板扩增PFl7R-BiTE-FAP基因。所用引物序列:PFl7R-FAP,上游5′-TTCAATTTTTGAATTTCATTTTGTTTTTTTCTATGCTATAAATGAACTCAGGACTCCAATTGGTTTTC-3′,下游:5′-ATGATCTAGAGTCGCGGCCGCTCACGCCCGTTTTATTTCCAGCT-3′。PCR扩增程序:98℃20 s;98℃ 15 s,60℃15 s,72℃ 30 s;72℃ 5 min;30个循环。将痘病毒早晚期启动子 PSEL、EcoR V位点分别引入DsRed基因的上下游引物,而NotⅠ位点和痘病毒特异性启动子F17R分别引入BiTE-FAP基因的上下游引物。pSEL2N1质粒原来的DsRed和GPT基因阅读框用NotⅠ和EcoR V双酶切切去。PCR产物、pSEL2N1骨架质粒 DNA片段切胶回收。将DsRed和BiTE-FAP基因用 Infusion克隆法插入pSEL2N1质粒,构建表达红色荧光的重组质粒pSEL2N1-BiTE-FAP。
1.3 重组病毒rVVDD-BiTE.FAP的构建
消化CV-1细胞,以3.0×105/孔密度接种于6孔板,当细胞汇合度达80%时,将原培养液更换为2 mL含2%胎牛血清的培养基,用MOI值为0.05的vSC20感染,37℃,5%CO2培养箱培养2 h后,将感染液更换为完全培养基,利用Lipofectamine 2000将重组质粒 pSEL2N1-BiTE-FAP转染 CV-1细胞。37℃,5%CO2培养箱培养48 h后,荧光显微镜下观察DsRed的表达,以确定质粒转染和病毒转导效果。细胞完全病变时收集细胞及培养液,反复冻融3次,1 000×g离心10 min,收集病毒上清液,保存于-80℃冰箱。
1.4 重组病毒的筛选和纯化
消化HuTK-143B细胞,以3.0×105/孔密度接种于6孔板;当汇合度达90%时,将原培养液更换为2 mL含2%胎牛血清的培养基,然后分别加入1、10、50μL病毒上清液,置细胞培养箱培养2 h后弃感染液;将含50μg/mL BudR的完全培养基和1%低熔点琼脂糖加入6孔板中覆盖细胞,继续培养48 h。荧光显微镜下观察红色荧光,并将DsRed阳性的病毒斑挑于1 mL PBS中;-80℃冰冻及37℃恒温水浴融解3次后4℃1 000×g离心30 min,收集上清液进行下一轮空斑纯化。经过5轮筛选及纯化后,在荧光显微镜下验证其纯度。
1.5 重组病毒滴度的检测
消化CV-1细胞,以1.5×105/孔密度接种于24孔板培养,分为6组,每组设3个复孔;当汇合度达90%时,取6份1μL病毒液,按比例(10-3,10-4,10-5,10-6,10-7,10-8)稀释后加入24孔板中;37℃5%CO2培养48 h后弃上清液,加入适量结晶紫染液染色5 min,PBS洗2次后风干,以空斑数计算重组病毒的滴度。
1.6 重组病毒体外复制能力检测
LLC、LL/2细胞经0.25%胰酶消化后,分别以1×105/孔细胞密度接种于48孔板,每种细胞分2组,每组设3个复孔,共种4块板。细胞培养过夜,当达90%汇合度时,用MOI=0.1的rVVDD-BiTE.FAP和亲本病毒vSC20分别感染LLC、LL/2细胞,并在0,24,48,72 h收获,反复冻融3次后通过CV-1细胞空斑计算病毒滴度。
1.7 MTS法检测两株重组病毒的体外溶瘤能力
LLC细胞经0.25%胰酶消化后,将细胞分为5组,均以细胞密度1×104/孔接种于96孔板中,每组设3个复孔,培养过夜。当细胞达90%汇合度时,将rVVDD-GFP和rVVDD-BiTE.FAP按 MOI值(0,0.01,0.1,1和10)稀释后加入96孔板,37℃,5%CO2培养箱培养48 h后,弃培养基,加入100μL新培养基,另设3孔空白对照组(不含细胞及病毒)作为调零孔。将MTS试剂按MTS∶PMS=20∶1的比例混合,并计算所需总体积。每孔加入配置好的混合液20μL,避光置于37℃,5%CO2培养箱培养,1~2 h后用酶标仪检测490 nm处的D值。细胞存活率=(病毒感染孔D值-凋零孔D值)/(对照孔D值-凋零孔D值)×100%。
1.8 结晶紫染色观察活细胞数量
将“1.7”中培养板细胞弃上清液,用PBS轻洗1~2次,吸去PBS,加入适量结晶紫染液,室温放置固定5 min后,再用PBS洗2次,每次静置2 min,完全吸去PBS后于生物安全柜内风干,拍照记录结晶紫染色结果,其颜色深浅代表活细胞数量。
1.9 痘病毒基因组制备及PCR鉴定
吸取20μL的病毒液,按照TaKaRa公司病毒基因组纯化试剂盒的操作步骤抽提基因组DNA,并采用酶标仪定量。确认浓度后取出2 ng作为模板插入基因组片段 PCR,上游引物:5′-CGGCGGACATATTCAGTTGATAATCGG-3′,下游引物:5′-CGGTGGCACCATCTAATATACCGTGTCGCTGT-3′。反应条件:94℃预变性5 min,94℃变性30 s,58℃退火30 s,72℃延伸4 min,反应30个循环后72℃再延伸5 min,然后4℃保存。PCR产物用1%琼脂糖凝胶电泳验证。
1.10 小鼠脾脏T细胞的制备
取6周龄C57雄性小鼠1只,断颈法处死,解剖取出脾脏,置于灭菌筛子上,加少量PBS,用10 mL注射器的推进器橡胶头小心研磨,再用PBS冲洗筛子,收集T细胞,置于15 mL离心管中。在管中按1∶1的比例加入红细胞裂解液,置冰上5 min,然后以500×g离心5min,去上清液后用PBS重悬,再离心、重悬1次。T细胞第3次离心后用含10%FBS的RPMI 1640培养基重悬,以2.5×106/mL细胞密度接种于培养皿,最后将刀豆蛋白A(Con A)以2.5 μL/mL加入培养皿用于活化T细胞。
1.11 重组病毒对过表达FAP的小鼠LLC细胞杀伤作用测定
先采用Con A活化小鼠脾脏T细胞。然后将MOI=5的rVVDD-BiTE.FAP感染LLC细胞,24 h后收集上清液,离心后用0.1μm滤膜过滤。将病毒过滤液在有或无活化T细胞的情况下分别与LLC-GFP或LLC-FAP细胞共培养。以无病毒过滤液的空培养液作为对照。具体步骤:LLC-GFP和LLC-FAP细胞经0.25%胰酶消化后,分别以2×104/孔细胞密度接种于96孔板中,每种细胞分为与T细胞、无T细胞共培养两大组,每大组分3个小组,每小组设3个复孔,效应细胞∶靶细胞=3∶1,病毒过滤液∶培养基=40μL∶60μL,37℃,5%CO2培养箱培养24 h后在显微镜下观察杀伤效果,然后用MTS和LDH实验测定杀伤效果。LDH实验参照说明书进行,设立未处理细胞组作为LDH本底释放对照组(低对照),在细胞中加Triton X-100作为LDH完全释放对照组(高对照)。LDH测定方法:将经病毒和T细胞处理的LLC细胞培养板以250×g离心10 min后,小心地从每个孔中取出100μL上清液并转移到光学透明96孔板的相应孔中,向每个孔中加入100μL反应混合物,在室温避光孵育30 min内,用酶标仪测定490 nm处D值。细胞毒性(抑制率)=(实验孔D值-低对照D值)/(高对照D值-低对照D值)×100%。重复上述杀伤实验并吸取上清液,按ELISA试剂盒说明检测上清液中的细胞因子IL-2和IFN-γ的浓度。
1.12 统计学分析
应用SPSS 22.0统计软件分析数据。实验结果用均数±标准差(x-±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒构建及重组溶瘤痘病毒基因组PCR验证
PCR扩增胶回收的DsRed-PCR产物、FAP-PCR产物和pSEL2N1质粒双酶切产物经电泳检测,结果与理论值相符。见图1。将构建好的质粒经酶切筛选后送上海生工生物工程公司测序验证,获得阳性重组质粒pSEL2N1-BiTE-FAP。
取出2 ng纯化好的重组病毒基因组作为模板,插入基因组片段进行PCR。PCR程序结束后进行琼脂糖凝胶电泳验证,结果与理论值相符,且未在电泳图上看到亲本病毒vSC20 PCR条带位置处有明显条带扩增,说明已获得高纯度重组病毒。见图2。
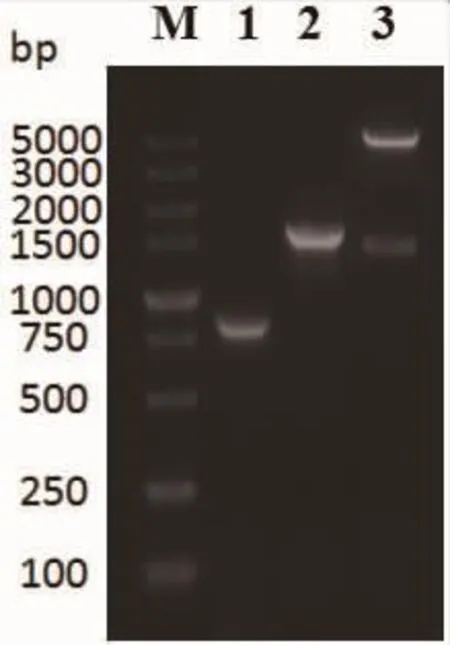
图1 pSEL2N1-BiTE-FAP重组质粒构建电泳图
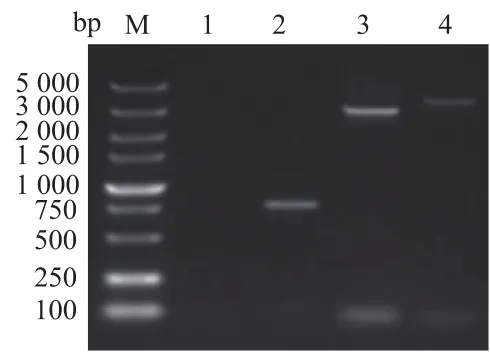
图2 重组病毒rVVDD-BiTE.FAP的PCR鉴定
2.2 BiTE-FAP表达不影响病毒复制和溶瘤能力
空斑法测定结果显示,rVVDD-BiTE.FAP、vSC20感染LLC、LL/2细胞后,各时点的病毒滴度无明显差异,表明重组痘病毒的复制能力未受到影响。见图3。
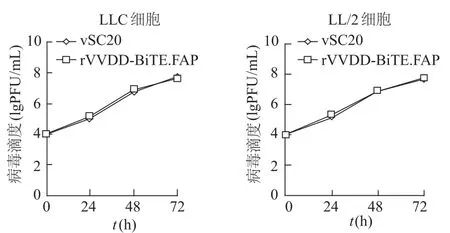
图3 vSC20、rVVDD-BiTE.FAP感染两类小鼠肺癌细胞株不同时间后滴度
MTS实验结果显示,随着MOI值增加,两类病毒感染后的LLC细胞存活率均逐渐降低,且各滴度的两者溶瘤能力均无显著差异(P均>0.05,图4)。结晶紫染色也显示上述趋势(图5)。

图4 MTS实验检测不同MOI值重组病毒对LLC细胞存活率的影响
2.3 rVVDD-BiTE.FAP联合小鼠T细胞具有高效抗癌作用
MTS实验结果显示,在与小鼠T细胞共培养的LLC-FAP体系中,rVVDD-BiTE.FAP具有明显抗肿瘤效果,溶瘤效果明显强于其他组(图6)。结果说明BiTE-FAP介导T细胞杀伤FAP阳性肿瘤细胞。

图5 两类重组病毒不同MOI值下的溶瘤能力(结晶紫染色)

图6 MTS检测各组LLC细胞的存活率
LDH结果也显示,rVVDD-BiTE.FAP联合小鼠T细胞,对LLC-FAP细胞具有更强的毒性作用(图7)。对共培养体系的上清液进行ELISA检测,结果显示rVVDD-BiTE.FAP能介导T细胞杀伤肿瘤细胞并释放大量细胞因子IL-2和IFN-γ(图8),T细胞杀伤靶细胞后细胞因子IL2和IFN-γ表达量明显升高(P<0.05)。

图7 rVVDD-BiTE.FAP和rVVDD-GFP病毒对LLC-GFP和LLC-FAP细胞的抑制作用
3 讨论
肿瘤微环境是具有异质成分的复杂环境,在肿瘤发生、发展以及介导治疗抗性中起重要作用[7-10],因此,除了靶向癌细胞之外,靶向肿瘤微环境中的辅助细胞可以增加靶向治疗的有效性[11]。FAP阳性癌相关成纤维细胞是肿瘤基质的中心细胞组分,并且对免疫抑制、基质发生、血管形成和细胞外基质重塑具有重要的促进作用[12]。Ostermann等[13]的临床前研究显示,靶向FAP的单克隆抗体能够破坏肿瘤组织的成纤维细胞和血管结构,抑制肿瘤生长,而实验小鼠无明显毒副反应。然而,在临床试验中输注FAP特异性单克隆抗体,患者未能从中获益[14]。Tran等[15]报道,靶向 FAP的嵌合抗原受体T细胞(CAR-T)在小鼠实验中却出现致死性骨毒性和恶病质的毒副反应,主要原因在于小鼠PDGFR-α和Sca-1阳性的多能骨髓基质细胞也大量表达FAP,导致CAR-T细胞出现脱靶作用。因此,在肿瘤微环境局部表达FAP抗体可避免T细胞出现这种脱靶副反应。VGF和TK双缺失的溶瘤痘病毒不但具有肿瘤组织趋向性,而且能够高水平表达外源插入基因。该研究旨在通过rVVDD-BiTE.FAP将FAP双特异性抗体表达于肿瘤局部,避免T细胞的脱靶副反应。
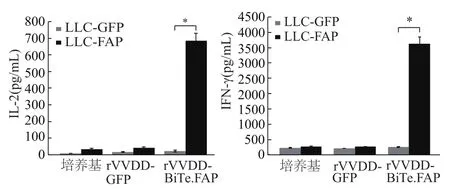
图8 ELISA法检测共培养体系中IL-2和IFN-γ浓度
本研究将构建成功的重组溶瘤痘病毒rVVDDBiTE.FAP进行纯化后,与Con A活化的T细胞共培养,检测其对FAP过表达的LLC细胞的体外杀伤效果。结果显示,重组病毒不仅保留了原本病毒体外复制及溶瘤能力,而且对FAP过表达细胞具有更强的杀伤作用。由于传统疗法治疗实体瘤效果欠佳,携带靶向FAP双功能抗体的溶瘤痘病毒不仅能够裂解肿瘤细胞,而且能够介导T细胞靶向杀伤肿瘤基质细胞,这种双靶向治疗机制为肿瘤治疗提供了新思路。本研究证实了表达双功能抗体的重组溶瘤病毒的体外杀伤能力,后期我们将在小鼠体内进一步证实该研究的可行性。

