四逆散对慢性萎缩性胃炎癌前病变大鼠的作用及机制研究*
钱元霞,汤玲珺,钱 祯,黄晓凡,高 静,徐卫东△
1. 江苏省镇江市中西医结合医院药剂科(镇江 212000);2.江苏大学药学院(镇江 212013)
目前,胃癌的发病率和死亡率在全球居恶性肿瘤的第二位,严重威胁着人类的健康,我国每年新发病例约40万例,占世界总发病例数的42%[1]。一般认为,胃癌的发生发展过程为:慢性浅表性胃炎-慢性萎缩性胃炎-肠上皮化生-不典型增生-胃癌,胃癌前病变(Precancerous lesions of gastric cancer,PLGC)指在慢性萎缩性胃炎(Chronic atrophic gastritis,CAG)基础上伴发肠上皮化生和异型增生的病理状态[2]。现代医学对胃癌前病变尚缺乏疗效肯定的治疗药物及理想的治疗方法,中医药从“未病先治”角度出发,抑制或阻断PLGC的发生发展显示独特优越性。四逆散为汉代张仲景所创,由柴胡、白芍、枳实、甘草组成,四药合用,既有调理肝脾之功,又具调和气血之能。四逆散及加味治疗慢性萎缩性胃炎及癌前病变在临床上有一定的疗效[3-5],但其作用及机制并不十分清楚,本实验运用现代药理学和分子生物学等技术,探讨四逆散抑制或逆转慢性萎缩性胃炎癌前病变的作用及机制,为中药复方的研究及更好的应用于临床提供依据。
材料与方法
1 实验动物 SPF级SD大鼠,雄性,60只,4周,体重100~120g,由江苏大学实验动物中心提供,许可证号:SCXH(苏)2013-0011,饲养条件、每笼10只,温度保持在(22±2)℃,相对湿度(55±5)%。经医院医学实验动物管理委员会批准。
2 药物与试剂 柴胡、白芍、枳实(炙)、甘草(炙)购自苏州市天灵中药饮片有限公司,上述药材均由江苏大学药学院欧阳臻教授鉴定;N-甲基-N'-硝基-N'-亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine,MNNG)、核黄素:梯希爱(上海)化成工业发展有限公司;胃蛋白酶原I (Pepsinogen I,PG I)、胃蛋白酶原Ⅱ(Pepsinogen Ⅱ,PGⅡ)及胃泌素-17(Gastrin-17,G -17)购自sinobestbio公司;兔抗鼠的β-actin多克隆抗体,兔抗鼠的PCNA多克隆抗体、兔抗鼠的Bax多克隆抗体、鼠抗鼠的Bcl-2多克隆抗体(美国Cell Signaling Technology),山羊抗兔的二抗、山羊抗鼠的二抗(美国Proteintech公司)。
3 主要仪器 Spectra Max Gemini荧光酶标仪(美国Molecular Device公司),荧光正置显微镜(Olympus Corporation)。
4 造模与分组 正常组、模型组、四逆散低剂量组、中剂量组、高剂量组、核黄素组,每组10只,正常组大鼠每天喂基础饲料,饮用水自由饮用,其余各组具体的造模方法为:200 μg/L 的MNNG液,自由饮用,配以饥饱失常处理,即2 d饱食,1d禁食,共 8 周。于实验第8周末,从模型组中随机取2只大鼠,取胃组织,常规HE染色,光镜下2只大鼠均有胃黏膜萎缩性病变,确认模型是否复制成功。第9周开始给药,四逆散各组每天按10 ml/kg给药,核黄素组每天1 g/kg。14周后,腹腔注射戊巴比妥钠处死全部大鼠,留取标本观察指标。
5 实验给药 参照《中华人民共和国药典》中药制剂通则:按四逆散处方等比例取炙甘草、枳实、柴胡、白芍药材,加水10倍浸泡3 h,煎煮2次(第1次8倍量,第2次6倍量),每次1 h,分离药渣,保留药液。将所有药液混匀浓缩,分别浓缩至0.25 g/ml、0.5 g/ml、1 g/ml,各组合并滤液,4 ℃冰箱储存备用。
6 观察指标
6.1 一般状况观察:每天观察大鼠的精神状态、饮食、大便性状、毛发光泽度等,每周记录体重变化。
6.2 脏器指数检测:给药结束后,计算各组大鼠脏器系数。大鼠器官肾脏、肝脏、脾脏、胸腺称重后计算:①肾脏指数(Kidney index,KI) = 肾脏重量(g) /体重(100g);②肝脏指数(Liver index,LI) = 肝脏重量(g) /体重(100g);③脾脏指数(Spleen index,SI) = 脾脏重量(g) /体重(100g);④胸腺指数(Thymus index,TI) = 胸腺重量(g) /体重(100g)。
6.3 HE染色法观察胃黏膜组织病理变化:将大鼠禁食24 h后,用10%水合氯醛腹腔注射(0.8~1.0 ml/只)后,无菌条件下剖腹,取出整个胃体,并沿胃大弯剪开,无菌生理盐水冲洗,除去胃内容物,取胃窦部组织置于10%多聚甲醛溶液固定24 h,石蜡包埋处理后,HE染色作病理组织学检查。
6.4 ELISA方法检测血清 PG I、PGⅡ及 G -17的含量:采血前禁食不禁水12 h以上,麻醉后通过颈静脉取血,静置30 min,离心(2000 转/min)10 min分离血清。血清用0.2 μm微孔滤膜除菌。应用 ELISA 法测定血清 PG I、PGⅡ及 G -17的含量,计算PGR(PGⅠ/ PGⅡ),所有操作均严格按试剂盒说明书进行。
6.5 Western blot检测蛋白的水平:各组大鼠随机选取6只,剖腹取胃,漂洗干净后,于胃窦部取米粒大小组织,剪碎成 1 mm ×1 mm ×1 mm 大小,加入蛋白质抽提试剂,用匀浆器每次30 s低速匀浆,14000 g离心15 min,上清液立刻转移入新的离心管中保存待用。提取组织总蛋白,SDS-PAGE 凝胶电泳,转膜,封闭液封闭1 h,一抗孵育4 h,TBST清洗3次,二抗孵育,室温1 h,TBST清洗3次,ECL发光液发光,Minichemi 发光成像仪检测。
7 统计学方法 采用Graph Pad Prism 5.0 统计软件,Anova方差分析,组间比较采用q检验,数据以平均数±标准差表示,P<0.05表示差异具有统计学意义。
结 果
1 大鼠一般状况观察 正常组大鼠活泼,毛发有光泽,身体强壮,饮食正常,体重自然增加,大便颗粒状,余亦无殊。模型组大鼠竖毛,精神较萎靡,体重增长减缓,食欲下降,大便时溏,余亦无殊。各四逆散治疗组与核黄素组症状较模型组有所改善。
2 四逆散对大鼠体重及免疫器官系数的影响 正常组大鼠体重平均从192.9 g增加至258.1 g,平均增加65.2 g,模型组平均增加48.2 g,低剂量组平均增加46.0 g,中剂量组平均增加48.3 g,高剂量组平均增加 14.5 g,核黄素组平均增加53.0 g,其中四逆散高剂量组体重增长趋势最缓,给药6周后与各组相比有显著性差异(P<0.05)(图1)。

图1 各组大鼠的体重变化
表1显示药物对大鼠免疫器官和代谢器官的影响,与正常组、模型组相比,药物处理组肝脏、脾脏系数无明显差异。四逆散高剂量组的大鼠肾脏系数与正常组相比有显著性差异(P<0.05);高剂量组胸腺系数与模型组相比较低,有显著性差异(P<0.05),剂量浓度较大可能对大鼠体重有影响,而脏器系数的下降可能由高剂量组体重明显下降所致。
3 胃黏膜形态及病理观察 肉眼观察,正常组大鼠胃黏膜正常,色泽淡红光滑,皱壁完整,无充血、水肿。模型组大鼠皱壁平,胃壁弹性差,黏膜充血、水肿。四逆散治疗组及核黄素各组胃黏膜色淡红,胃壁弹性较模型组好,水肿症状减轻。光镜下正常组胃黏膜上皮完整,腺体排列规则。模型组有的粘膜不完整,表面可见脱落的变性、坏死的上皮细胞,核增大,染色质密集深染,有不同程度的异型性,部分伴肠上皮化生。四逆散治疗组胃黏膜肠上皮化生程度较模型组轻,尤其是中高剂量组和核黄素组(图2)。

表1 各组大鼠脏器系数的比较(g/100g)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
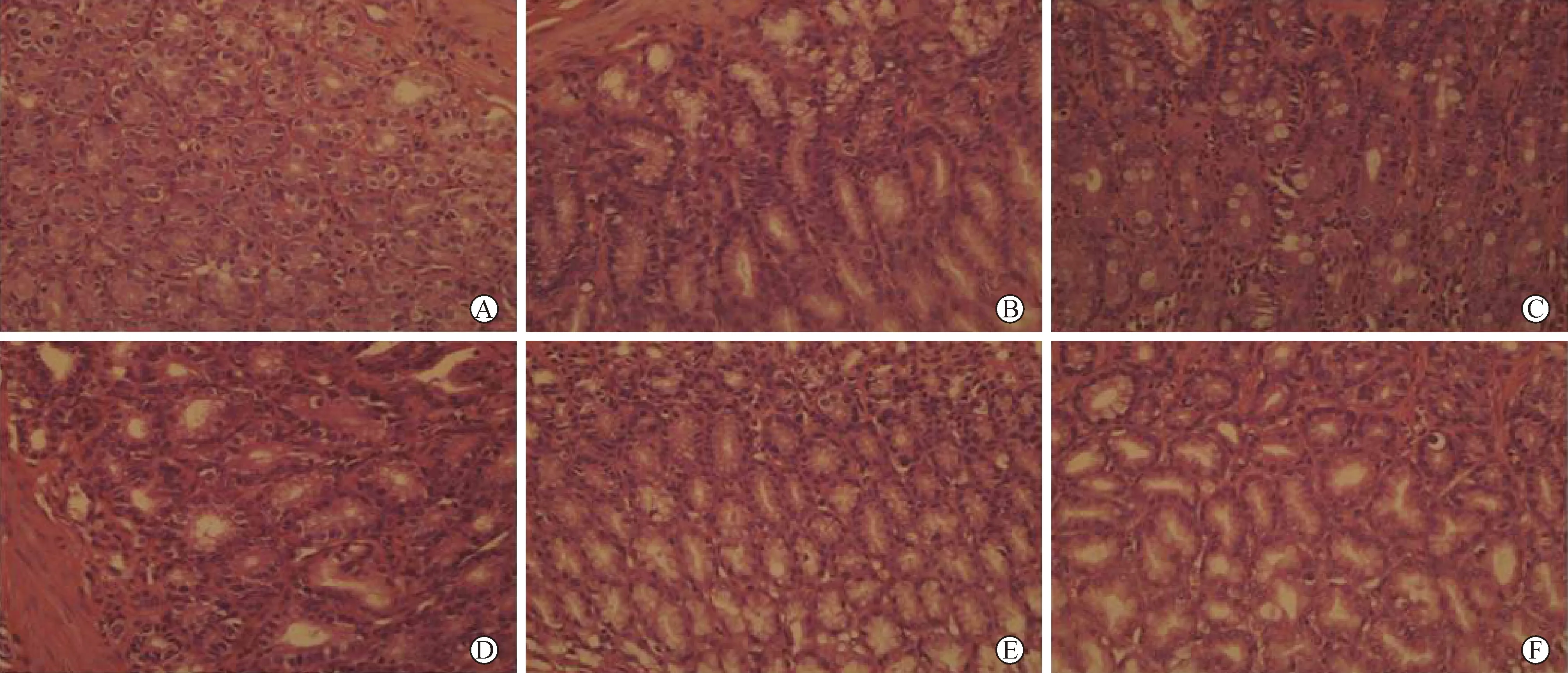
A:正常组;B:模型组;C:低剂量组;D:中剂量组;E:高剂量组;F:核黄素组图2 各组大鼠胃黏膜组织形态的光镜观察(HE染色,×400)
4 四逆散对血清 PGⅠ、PGⅡ、PGR及 G-17含量的影响 由表2可看出,模型组PGⅠ浓度与正常组相比均值较低,但无显著性差异,核黄素组PGⅠ浓度较模型组显著升高(P<0.05);PGⅡ浓度模型组与正常组相比明显升高,四逆散中剂量、高剂量组与模型组相比明显降低(P<0.05);模型组PGR值与正常组相比明显降低,四逆散中、高剂量组、核黄素组与模型组相比明显升高(P<0.05);模型组G -17浓度较对照组低,高剂量组、核黄素组G -17浓度较模型组显著升高(P<0.05)。
表2 各组血清 PGⅠ、PGⅡ、PGR及 G -17含量比较
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
5 PCNA、Bcl-2、Bax蛋白表达量 由图3及表3可看出,与正常组比较模型组Bax蛋白表达有所降低,差异有统计学意义(P<0.05);四逆散处理组能够升高Bax蛋白的表达。模型组PCNA、Bcl-2蛋白量与正常组相比较高,差异有统计学意义(P<0.05),四逆散治疗后,中、高剂量组与模型组相比Bcl-2表达量降低(P<0.05);高剂量组PCNA与模型组相比表达量明显降低(P<0.05)。

图3 四逆散对PCNA、Bcl-2、Bax蛋白表达量的影响

组 别nBaxBcl-2PCNA正常组100.21±0.04 0.32±0.07 0.14±0.04 模型组80.07±0.01*0.50±0.12*0.55±0.19*低剂量组90.17±0.06#0.52±0.09*0.49±0.11*中剂量组100.20±0.02#0.30±0.03#0.54±0.03*高剂量组80.18±0.07#0.35±0.05#0.31±0.09#核黄素组90.25±0.08#0.36±0.07#0.40±0.04*
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
讨 论
参照《中药新药临床研究指导原则》诊断标准拟定证候诊断,将慢性萎缩性胃炎分为脾胃虚弱型、肝胃不和型、脾胃湿热型、胃络瘀血型、胃阴不足型5型[6]。胃癌前病变多由慢性疾病发展而来,久病失调,导致脾胃之气损伤,脾胃虚弱,中气不足,运化失司,则胃受纳腐熟乏力,出现纳呆痞闷、口淡无味、胃脘隐痛、呕吐清涎、神疲乏力等表现[7]。如《景岳全书》谓:“胃强则寒不能侮,而寒能胜之,总由脾气之弱耳”。“脾胃虚弱”为慢性萎缩性胃炎及其癌前病变的发病之本,“邪踞胃脘、久酿成毒”是CAG及其癌前病变发展、演变的病理基础和关键因素,“脾胃肝同病”是其癌前病变常见的病机变化,“脾虚及肾”是其癌前病变病机演变的转归,“脾虚络阻、虚实夹杂”是贯穿CAG癌前病变始终的基本病机[8]。故脾胃虚弱是胃癌前病变的病机演变的必然结果及关键所在,脾胃虚弱,气机升降失调,运化不力,治宜健脾益气,温中和胃。四逆散中柴胡为君药,能透达郁阳,疏肝解郁;芍药为臣药,柔肝平肝,养血敛阴,与柴胡相伍,疏肝而不伤阴,一散一敛,有相反相成之效;枳实为佐药,理气消积,以利脾胃,与柴胡相配,一升一降,可增强疏肝理气之功;炙甘草为使药,不仅可补益脾胃,还可调和诸药,与芍药合用能柔肝缓急,酸甘化阴,四药合用,既有调理肝脾之功,又具调和气血之能。
本研究采用MNNG方法复制慢性萎缩性胃炎癌前病变模型,MNNG是一种在环境中广泛存在的化学诱变剂和致癌剂,可诱导胃癌前病变大鼠模型的建立[9]。以不同剂量的四逆散给药,核黄素作阳性对照,发现四逆散高剂量组可能对大鼠的体重、肾脏、胸腺有一定的影响,还需扩大样本研究。四逆散能改善病变大鼠胃粘膜形态和肠上皮化生程度,升高PGⅠ、PGR 、G-17,降低PGⅡ水平。PGⅠ和 PGⅡ,主要由胃底腺的主细胞和黏液颈细胞分泌,血清 PG 的水平反映了胃蛋白酶的分泌及不同部位胃黏膜的形态和功能情况,当胃黏膜病变累及分泌胃蛋白酶原的细胞时,血清中的 PG 含量也随之改变[10]。研究发现,在胃癌前及胃癌病变患者的血清中,PGR较正常组明显降低,其可作为异型增生、胃癌,尤其是肠型胃癌的诊断标记,G-17反应胃粘膜的状态,与胃粘膜萎缩程度及癌变程度有关[11-13]。
肿瘤的发生发展与细胞增殖与凋亡平衡密切相关,PCNA是细胞增殖的指标,与肿瘤等细胞增殖性疾病的发生和发展存在相关性,PCNA在胃癌的发生发展过程中是一个逐渐变化的过程[14-15]。Bcl-2是线粒体上的一种跨膜抗凋亡蛋白,Bax是一种促凋亡蛋白,Bax可以在线粒体外膜上形成孔道,Bcl-2则可通过与 Bax结合阻碍线粒体转运孔道的开放。线粒体外膜通透性增大时,Cty C等凋亡相关蛋白从线粒体释放入胞浆,可导致凋亡小体形成,激活半胱氨酸蛋白酶家族成员Caspase-3的活性,最终导致凋亡[16]。研究发现细胞的Bcl-2和Bax 基因异常表达与引起胃粘膜细胞凋亡和增殖异常,胃癌及癌前病变的形成发挥一定作用[17-18]。本研究表明四逆散在一定程度上影响PCNA及Bcl-2、Bax蛋白的表达,调控细胞的增殖凋亡过程。
综上所述,四逆散在治疗慢性萎缩性胃炎癌前病变中有一定的治疗作用,能够在一定程度上改善胃粘膜异型增生程度,可能与调控细胞增殖与凋亡平衡有关,有待进一步研究。

