马铃薯高世代选系疮痂病抗性评价及SSR辅助筛选
宋志军 白雅梅 张静华 张 抒 李 辉 吕文河* 魏 琪*
(1 东北农业大学农学院,黑龙江哈尔滨 150030;2 东北农业大学资源与环境学院,黑龙江哈尔滨 150030;3 黑龙江省农业科学院马铃薯研究所,黑龙江哈尔滨 150086)
马铃薯疮痂病是由多种致病链霉菌(Streptomyces ssp.)引起的土传性病害。致病菌侵染部位变形,形成形状不规则、深浅不一的栓质化病斑,严重影响商品品质和加工品质。在中国,马铃薯疮痂病作为次生病害起初未受到重视(魏延安,2005),随着马铃薯种植面积扩大,耕地面积受限,致使连作严重,进而导致马铃薯疮痂病逐年加重(何虎翼 等,2017)。
目前,国内外关于马铃薯疮痂病的研究主要集中在病原菌的鉴定和防治上。全世界范围内,马铃薯疮痂病致病菌大约有50 种(聂峰杰 等,2018),在中国主要有S. scabies、S. turgidiscabies和S. acidiscabies 3 种(张萌 等,2009)。在疮痂病防治方面,有轮作(Waterer,2002)、土壤熏蒸和种植绿肥(Mishra & Srivastava,2004)及施用微生物菌肥(靳海波 等,2015)等方法,成本高且不能完全防治。筛选抗疮痂病种质资源,培育抗病新品种,可以有效解决马铃薯疮痂病问题,且节约成本,实现绿色生产,保护环境。目前,高抗疮痂病的马铃薯品种资源较少。Pasco 等(2005)利用人工接种的方式筛选得到Nicola、BF15、Sirtema和Charlotte 4 个高抗疮痂病品种(系)。何虎翼等(2017)利用田间病圃和人工接种相结合的方式筛选得到D825 和D731 两个高抗疮痂病品系。
SSR 分子标记技术是研究作物遗传多样性的一种常用方法,在马铃薯育种中有广泛的应用,比如构建遗传图谱、分析马铃薯资源的遗传多样性等(单友蛟 等,2010;石景,2011)。本试验拟采用田间自然病圃和人工接种两种方法对20 份马铃薯高世代选系进行抗性鉴定,结合疮痂病指数和相对抗病指数对马铃薯材料的疮痂病抗性进行评价,利用SSR 分子标记分析马铃薯品系间的亲缘关系,以探究马铃薯疮痂病抗性与亲缘关系之间的联系,为抗疮痂病育种工作奠定基础。
1 材料与方法
1.1 试验地概况
自然病圃抗性鉴定试验于2017 年5~9 月在黑龙江省农业科学院现代化农业示范区马铃薯病害研究试验地进行,该地块由于马铃薯7 a 连作,疮痂病发病率高。
1.2 试验材料
供试材料为东北农业大学马铃薯研究所提供的20 份高世代选系。在常规育种选择过程中,一般是早代对薯形、芽眼深浅、匍匐茎长短等性状进行选择,而高世代则主要对产量和品质性状进行选择。除N08-21-1(中薯3 号×Norland)外,其他品系中至少一个亲本是荷兰品种或利用荷兰种质资源选育的品种或无性系(表1)。
1.3 试验方法
1.3.1 试验地块致病菌鉴定 2017 年9 月,采集试验地收获的马铃薯疮痂病的感病块茎,品种为克新18 号、荷兰15 号、尤金、兴佳2 号、闵薯1 号、延薯4 号、麦肯1 号和克新13 号。每个品种采集1 个块茎,共8 个。使用无菌毛刷采集每个块茎表皮上的土壤,8 份土壤样品混匀为1 份。
将块茎洗净,使用75%酒精进行表面消毒,再用无菌水冲洗2 次,晾干。切取疮痂病病斑下病健交界处薯肉置于少量无菌蒸馏水中,用镊子碾碎,室温孵育30 min。将上述液体稀释1 000 倍后涂布于1%的水琼脂培养基上,28 ℃条件下暗培养,7~10 d 后挑取全部具有放线菌特征的菌落于酵母麦芽精琼脂培养基(YME)上画线纯化,连续纯化2~3 次。

表1 供试马铃薯品系系谱信息
称取土壤样品1 g 加入适量无菌水,室温孵育30 min,6 000 r · min-1离心10 min 后吸取上清液。后续步骤同上。
用称量勺刮取菌株的菌丝置于无菌离心管中,采用北京庄盟G+细菌基因组DNA 提取试剂盒提取菌株DNA。以txtAB 基因特异性引物检测菌株致病性,采用常规PCR扩增法对菌株进行种类鉴定(邢莹莹,2015),引物信息见表2。

表2 病原菌鉴定引物信息
1.3.2 自然病圃抗性鉴定 试验采用随机区组设计,单行区,行长5 m,垄距0.8 m,株距0.2 m,即每个小区25 株,4 次重复,采用当地田间管理方式管理试验区。根据邢莹莹(2015)的盆栽接种试验结果,采用尤金为感病对照,克新18 号为抗病对照。种植120 d 收获,收获时调查每个小区所有质量大于50 g 的马铃薯块茎疮痂病发病情况,调查病斑面积和病斑深度等级。疮痂病病斑面积等级划分:0 级,病斑面积为0;1 级,病斑面 积≤5.0%;2 级,5.0%<病斑面积≤12.5%;3级,12.5%<病斑面积≤25.0%;4 级,25.0%< 病斑面积≤50.0%;5 级,病斑面积>50.0%。疮痂病病斑深度等级划分:1 级,0 mm ≤病斑深 度≤1 mm;2 级,1 mm <病斑深度≤2 mm;3级,2 mm <病斑深度≤3 mm;4 级,病斑深度>3 mm。计算每个品种(系)每次重复的疮痂病指数(scab index,SI)(Singhai et al.,2011;邢莹莹,2015)。
参考王跃栋等(2011)的方法,计算相对抗 病 指 数(relative resistance index,RRI),将 供试品种(系)划分为4 个类型。高抗(HR),0.80 ≤RRI ≤1.00;中抗(MR),0.60 ≤RRI <0.80;中 感(MS),0.40 ≤RRI <0.60; 高 感(HS),RRI <0.40。
病斑面积等级(A)=Σ(各病斑面积等级块茎数×该级数代表值)/调查块茎总数
病斑深度等级(D)=Σ(各病斑深度等级块茎数×该级数代表值)/调查块茎总数
疮痂病指数(SI)=100×(A×D)/20
相对抗病指数(RRI)=1-所测品种(系)疮痂病指数平均值/发病最重品种(系)疮痂病指数平均值
1.3.3 人工接种鉴定 2018 年,根据自然病圃抗性鉴定结果,从高感、中感、高抗类型中各挑选2 个品系,以尤金为感病对照,克新18 号为抗病对照,参照邢莹莹(2015)的盆栽接种方法进行人工接种试验。试验土壤采用灭菌后的草炭土,设4 次重复,接种S. scabies 菌种标准菌株。菌株购于中国微生物菌种保藏管理委员会普通微生物中心,菌株编号CGMCC 4.1765(=ATCC49173)。使用YME 液体培养基28 ℃、200 r · min-1暗培养9 d,用YME 液体培养基调节菌液浓度至5.0 mg · mL-1(FW)。将菌液与土壤均匀混合,菌液和土壤体积比为1∶4,以无菌水为阴性对照。后期管理参考吴立萍(2017)的方法,种植90 d 后收获调查,调查方法同自然病圃抗性鉴定。
1.3.4 SSR 亲缘关系分析 采用北京康为世纪生物科技有限公司的植物基因组DNA 提取试剂盒分别提取20 个供试品系块茎的基因组DNA。使用ND-1000 分光光度计检测DNA 浓度,并稀释至100 ng · μL-1,用1%琼脂糖凝胶电泳检测DNA 质量。
引物采用黑龙江省农业科学院马铃薯研究所病虫害课题组前期试验筛选得到的9 对高多态性SSR引物(表3),PCR 反应体系参考吴立萍(2017)的方法。扩增产物使用8%、10%、12%浓度的聚丙烯酰胺凝胶电泳检测,采用银染法染色,不同引物使用聚丙烯酰胺凝胶的浓度见表3。
参考刘思泱(2010)的方法,统计胶片条带,记录生成“0,1”矩阵,计算多态性信息量。利用NTSYS-pc 软件生成遗传相似性系数矩阵,按UPGMA 法进行聚类 。

表3 SSR 引物名称及序列
1.4 数据分析
使用Excel 2010 和DPS 7.05 软件分析试验数据,使用NTSYS-pc 软件分析品系间亲缘关系。
2 结果与分析
2.1 试验地块致病菌鉴定
从土壤和块茎中共分离纯化具有链霉菌特征的菌株278 份,其中240 份来自于块茎,38 份来自于土壤。具有致病力的菌株127 株(表4、图1),txtAB 基因阳性菌株经种类鉴定(图2)全部属于Streptomyces scabies 菌种。

表4 试验地块分离菌株致病力检测结果

图1 txtAB 基因特异性引物扩增产物电泳图谱

图2 S. scabies 特异性引物ScabF/ScabR 扩增产物 电泳图谱
2.2 自然病圃抗性鉴定
对马铃薯品种(系)的疮痂病指数数据进行方差分析,不同品种(系)间的疮痂病抗性存在显著性差异。根据相对抗病指数,可将供试品种(系)划分为4 个抗病类型(表5)。N11-22-6、N12-39-19、尤金、H04-3-18、N11-40-11、N10-4018、N10-24-2 为高感类型;H09-34012、N12-45-4、N12-39-15、N12-42-18、N12-39-5 为中感类型;N11-46-12、N12-38-1、H04-7-10、克 新18 号、N11-50-29、N08-21-1、H04-7-23、N08-11-9 为中抗类型;N12-38-7、N08-14-1 为高抗类型。在高抗类型中,N08-14-1 的疮痂病指数显著低于克新18 号,N12-38-7 的疮痂病指数与克新18 号没有显著差异。中抗品系的疮痂病指数与克新18 号无显著差异。中感品系的疮痂病指数均显著低于尤金,但是和克新18 号没有显著差异。在高感类型中,N11-22-6 的疮痂病指数最高,显著高于尤金,其余高感品种(系)的疮痂病指数与尤金无显著 差异。
2.3 人工接种抗性鉴定
从表6 可以看出,人工接种的参试品种(系)的疮痂病指数比自然病圃高,原因可能是人工接种的土壤中致病菌含量高。对人工接种与自然病圃抗性鉴定结果进行相关性分析(图3),R2为0.946 7,存在极显著相关,表明人工接种与自然病圃抗性鉴定结果一致。

表5 马铃薯品种(系)疮痂病自然病圃抗性鉴定结果

表6 马铃薯品种(系)疮痂病人工接种抗性鉴定结果

图3 人工接种与自然病圃抗性鉴定疮痂病指数相关性 分析结果
2.4 SSR 亲缘关系分析
2.4.1 SSR 分子标记多态性 20 份马铃薯品系的基因组DNA 经1%琼脂糖电泳检验,条带清晰,无明显拖尾。说明DNA 质量较好,可用于下一步SSR-PCR 扩增。本试验扩增出115 条条带,其中103 条为多态性条带,平均多态性比例为89.6%,整体多态性比例较高(表7、图4)。

表7 SSR 分子标记多态性信息
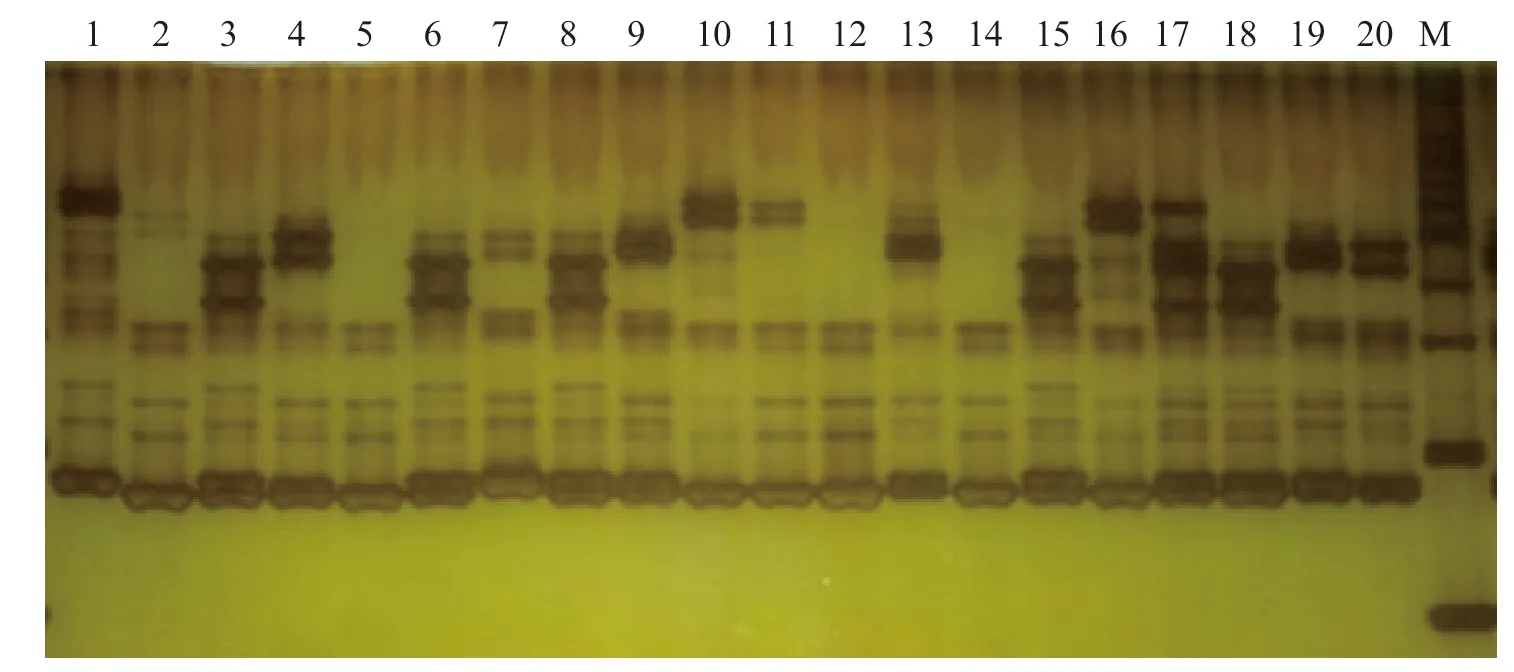
图4 引物STM1104 扩增结果

图5 20 份马铃薯品系基于SSR 的亲缘关系聚类分析图
2.4.2 SSR 分子标记亲缘分析 由表8可知,20 份马铃薯品系的遗传相似性系数变化范围为0.487 0~0.860 9。整体看来亲缘关系较近。其中N12-45-4与H04-3-18 的遗传相似性系数最大; N12-38-1 和N12-39-19 的遗传相似性系数最小。
如图5 所示,可将20 份马铃薯品系分成5 大类。第Ⅰ类包括7 个品系,第Ⅱ类包括6 个品系,第Ⅲ类包括4 个品系,第Ⅳ类包括2 个品系,第Ⅴ类只有1个品系。
对比图5 和表1 的系谱,SSR 遗传相似性系数聚类结果与系谱基本一致。第Ⅰ类中,品系H04-7-23、H04-7-10是全同胞姊妹系,遗传相似性系数为0.808 7;第Ⅱ类中,品系H04-3-18 是N12-45-4 的母本,遗传相似性系数为0.860 9;第Ⅲ类中,品系N12-39-15、N12-39-19、N12-39-5 是全同胞姊妹系,遗传相似性系数为0.773 9~0.782 6。但也有亲缘关系接近,遗传相似性系数较小的现象,N12-38-7 与N12-38-1 属于全同胞姊妹系,但遗传相似性系数仅为0.626 1,此结果区别于其他几个全同胞姊妹系,原因可能是同一杂交组合后代发生了较大的遗传重组和变异。
对比SSR 遗传相似性系数聚类结果和品系抗病性分类结果(图5、表5),发现相同抗病类型的品系通过SSR 遗传相似性系数聚类大致上可聚到一起,如高抗和中抗类型的品系绝大部分聚类到第Ⅰ、Ⅳ类中;高感和中感类型的品系大部分聚类到第Ⅱ、Ⅲ类中。
3 结论与讨论
本试验使用疮痂病指数评价病情,该方法考虑了病斑面积和病斑深度(类型)两方面,区别于病情指数仅仅调查病斑面积(张建平 等,2013;孙静 等,2015)。但是,在抗病性分类方面,仅依据疮痂病指数还是不能准确评价马铃薯品种(系)的疮痂病抗性。比如,在本试验中,疮痂病病斑类型大多数是平状病斑,导致计算得到的供试品种(系)疮痂病指数整体较低。有研究表明,疮痂病发病易受环境影响(何虎翼 等,2017),本试验通过对比几个供试品种(系)在自然病圃和人工接种抗性鉴定试验的结果也发现,不同发病环境下的疮痂病指数会有整体性地浮动。因此,本试验采用疮痂病指数调查病情,使用相对抗病指数衡量供试品种(系)的相对抗病性,在抗病性上进行分类。

表8 20 份马铃薯品系的SSR 遗传相似性系数矩阵表
依据本试验的抗病性分类方法,在自然病圃与人工接种抗性鉴定试验中,尤金均表现为高感类型,克新18 号分别表现为中抗和中感类型,这与何虎翼等(2017)和邢莹莹(2015)的试验结果基本一致。本试验筛选得到N11-46-12、N12-38-1、H04-7-10、N11-50-29、N08-21-1、H04-7-23、N08-11-9、N12-38-7和N08-14-1共9个抗病品系,其中品系N08-14-1 抗性最高,明显高于抗病对照。
从供试的高世代无性系系谱来看,它们的亲本既有中国育成品种,如中薯3 号,又有国外引进品种,如荷兰的Triplo,美国的Salem,从俄罗斯引进的莫斯科列思基的芽变品种延薯4 号。另外,还包括利用荷兰种质资源育成的无性系,如H04-7-16。但从遗传相似性系数变化范围来看,它们的亲缘关系仍然较近。就本试验而言,可以考虑用第Ⅰ类中的抗病品系H04-7-10、H04-7-23、N11-50-29、N08-11-9 与第Ⅳ类中的抗病品系N12-38-7 和N08-14-1 作为亲本杂交进行抗疮痂病品种选育。今后还应加大对国外,特别是发达国家和国际马铃薯中心材料的收集、保存和利用,进一步拓宽育种材料的遗传基础。
目前,马铃薯疮痂病抗性机制尚不明确,还未发现相关的抗性基因(徐建飞和金黎平,2017)。马铃薯抗疮痂病育种的主要工作还是利用自然病圃和人工接种鉴定筛选抗病品种(系),耗时长,成本高。本试验在前人研究的基础上,探究亲缘关系与抗病性的联系,发现品系间的SSR 遗传相似性系数聚类结果与疮痂病抗性分类结果较相符。在今后的抗疮痂病育种工作中,可以开发更多的SSR引物,根据SSR 遗传相似性系数聚类结果并结合已知的品种(系)抗性初步筛选,再利用常规鉴定手段进一步筛选,可大大减少工作量。

