早中期结直肠癌手术前后外周血循环肿瘤细胞的监测及预后分析
曹 霞,吴 伟,赵小玉,李 曾,韩亚兵,李 翔,田 姗,张 丹
(1.西安交通大学医学部附属三二〇一医院肿瘤内科,
2.胃肠外科,陕西汉中723000;
3.复旦大学生命科学学院遗传工程国家重点试验室,上海200433;
4.上海宝藤生物医药科技股份有限公司,上海201204)
结直肠癌是常见的恶性肿瘤之一,其发病率居全球第3、死亡率居全球第4位[1]。早中期结直肠癌以根治性手术治疗为主,然而术后局部复发和转移仍是早中期结直肠癌的主要死亡原因。文献报道CEA、CA199可作为结直肠癌疗效预测的生物标志物,但敏感性及特异性均较低[2-3]。因此,发现早中期结直肠癌治疗后复发转移相关危险因素并早期筛选出这部分高危复发转移病人是目前国内外学者研究的重点。循环肿瘤细胞(circulating tumor cell,CTC)从肿瘤组织脱离进入外周血液,部分肿瘤细胞的表型发生改变,出现上皮-间质转化,使肿瘤细胞具有较强的转移性和侵袭性,在一定条件下发展成为转移灶[4]。CTC可以从乳腺癌、肺癌、结直肠癌及前列腺癌等多种上皮性恶性肿瘤患者的外周血中分离出来。CellSearch系统是美国食品药品监督管理局(FDA)唯一批准用于临床的CTC检测平台,主要通过带有抗上皮细胞粘附分子(EpCAM)抗体的磁珠阳性捕获CTC,然后结合抗细胞角蛋白(CK)抗体识别CTC。但CTC形成及发展过程中会发生上皮-间质转化或自身上皮特异性抗原表达缺失,引起肿瘤细胞表面EpCAM和CK的表达下调甚至缺失[5]。因此,基于EpCAM和CK表达的CellSearch系统在应用上存在局限性。近年来新发展的SE-iFISH技术,利用抗白细胞标记的抗体去除白细胞,采用检测染色体倍数结合细胞表面肿瘤标记物的方法判定CTC,富集和识别的过程中不受EpCAM和CK表达的影响,提高了检出率[6-7]。本文通过一个前瞻性队列研究,采用SE-iFISH检测技术动态检测早中期结直肠癌患者手术前后的CTC,分析CTC与临床特征的关系,评价CTC作为生物标记物在早中期结直肠癌治疗后的预测价值。
1 材料与方法
1.1 研究对象
收集自2014年7月至2016年7月期间陕西省汉中市3201医院肿瘤科收治的结直肠癌患者作为研究对象,符合纳入标准的患者共67人,其中男性44例,女性23例,平均年龄(56.9±12.1)岁。收集同期20例健康志愿者,作为空白对照组,其中男性14例,女性6例,平均年龄(57.3±6.6)岁。本研究获患者知情同意和医院伦理委员会批准实施。
研究组纳入标准为:①经病理新确诊的结直肠癌,不伴有肠梗阻、穿孔或出血等需要急诊处理的患者;②根据2017版AJCC/UICC结直肠癌分期系统,分期为Ⅰ~Ⅲ期;③未接受过任何术前抗癌治疗;④无其他恶性肿瘤史;⑤结直肠癌患者手术方式均按照标准进行根治性切除术;⑥自愿参加研究并签署知情同意书的患者。
研究组排除标准为:①不能按照标准接受结直肠癌标准根治术的患者,如病理提示切缘阳性的患者;②有结直肠癌,行手术治疗后复发,再次手术的患者;③既往或现在患有其他肿瘤性疾病的患者;④合并感染的患者;⑤依从性差,不能按期随访的患者。
1.2 样本收集方法
67例患者分别在结直肠癌根治性手术前24 h和术后3个月,同时抽取外周血7.5 mL行CTC检测,以及外周血4 mL行CEA、CA199检测。同期抽取20例健康志愿者外周血7.5 mL行CTC检测,以及外周血4 mL行CEA、CA199检测。
1.3 循环肿瘤细胞检测方法
1.3.1 CTC试剂盒及仪器 人外周血循环稀有细胞差相富集试剂盒(货号SHE-003B),CK-iFISH人肿瘤细胞检测试剂盒(货号FSH-002B);TDL-5M型台式冷冻离心机(湘仪,最大离心力4390×g),S500-24型原位杂交仪(ThermoBrite),尼康Ni-U型荧光显微镜等。
1.3.2 CTC阴性分离富集 7.5 mL外周静脉血采集到ACD抗凝血管中。去除血清:常温800×g离心8 min,去除上层血清,保留下层血细胞。去除红细胞:50 mL离心管中加入3 mL样本密度分离液,在样本密度分离液上层叠加血细胞,450×g离心8 min后,将含有白细胞和CTC的白膜层吸到新的50 mL离心管中。去除白细胞:在放有白细胞混液的离心管中加入处理好的200 μL磁珠,将离心管倾斜(约30℃)置于摇床上,130 r/min,摇动20 min,450×g离心8 min,然后去除白细胞和磁珠混合物,吸取上清至新的15 mL离心管中,加入清洗液清洗后弃上清至50 μL。液染抗体:加入2 μL抗原修复液修复10 min后加入anti-CD45抗体、anti-PanCK抗体和抗体稀释液的混合液室温避光孵育20 min,650×g离心5 min,弃上清至100 μL。固定和涂片:混匀细胞沉淀后加入100 μL固定液混匀、涂片,过夜烘干玻片。
1.3.3 CTC免疫荧光原位杂交(iFISH)和分析烘干的玻片 经过晾置、杂交洗液清洗和无水乙醇洗涤、脱水后,进行CEP8(8号染色体着丝粒探针)杂交。杂交条件为76℃变性10 min,37℃杂交4 h。杂交结束清洗液清洗后滴加5 μL DAPI染液封片并于荧光显微镜下观察。
1.3.4 CTC判断标准 采用细胞角蛋白(CK)、白细胞分化抗原(CD45)、DNA强力结合荧光染料4′,6-二脒基-2-苯基吲哚(DAPI)及8号染色体着丝粒探针(CEP-8)共同识别结直肠癌患者血液中的CTC。因此CTC具体定义为:CK+/CD45-/DAPI+/CEP=2;CK+/CD45-/DAPI+/CEP8>2;CK-/CD45-/DAPI+/CEP8>2[8]。白细胞具体定义:CK-/CD45+/DAPI-/CEP8=2[9](图 1A)。
1.4 治疗及随访
患者均采用开腹结直肠癌根治术,根据中国临床学会(CSCO)结直肠癌诊疗指南进行术后辅助放化疗。治疗结束后患者每3个月行体格检查、肝脏超声、肿瘤标志物等检查;每6个月至1年行胸腹壁CT、结肠镜和骨扫描检查。通过电话询问和随诊的方式对所有患者进行规律随访,并收集患者术后复查结果。患者死亡或者失访作为随访终点。
1.5 统计学方法
采用SPSS 22.0软件包进行数据统计分析,统计图采用GraphPad Prism 7.0软件绘制。患者平均年龄采用X±S表示,CTC阳性率的比较采用卡方检验。使用受试者工作特征(ROC)曲线判定CTC诊断结直肠癌的临界值并计算该方法的灵敏度、特异度。CTC的数值采用中位数/四分位数进行统计描述,并采用非参数检验进行统计分析。本研究的主要观察终点为无病生存时间(disease free survival,DFS)和总生存时间(overall survival,OS)。DFS自根治性手术日期开始至疾病复发或由于疾病进展导致患者死亡等任一个首次出现的时间或最后随访日期。OS自根治性手术开始计算至患者出现死亡或最后随访日期。采用Kaplan-Meier法计算生存率,并用Log-rank法比较各组的生存差异。通过单因素Cox比例风险回归分析临床病理参数及各组CTC数与DFS和OS的预测价值;对于单因素分析有意义的参数(P<0.05)进一步纳入多因素Cox回归分析。双侧P<0.05为差异有统计学意义。
2 结果
2.1 术前患者CTC及健康组CTC的鉴定
手术前67例结直肠癌患者中有61例患者检出CTC,共253个单个CTC。其中232个CTC的特点是CK-/CD45-/DAPI+/CEP8>2(图1B ~ D);21个CTC的特点CK+/CD45-/DAPI+/CEP8>2(图1E),分布在15个患者中。全组未发现CK+/CD45-/DAPI+/CEP8=2或者CK-/CD45-/DAPI+/CEP8=2的二倍体细胞。在253个CTC中,三倍体(CEP8=3)123个,分布在48例患者中(图1B);四倍体(CEP8=4)39个,分布在24例患者中(图1C);多倍体(CEP8≥5)占91个,分布在18例患者中(图1D)。在20例健康对照组中只发现了1个CTC,其细胞特点:CK-/CD45-/DAPI+/CEP8=3。
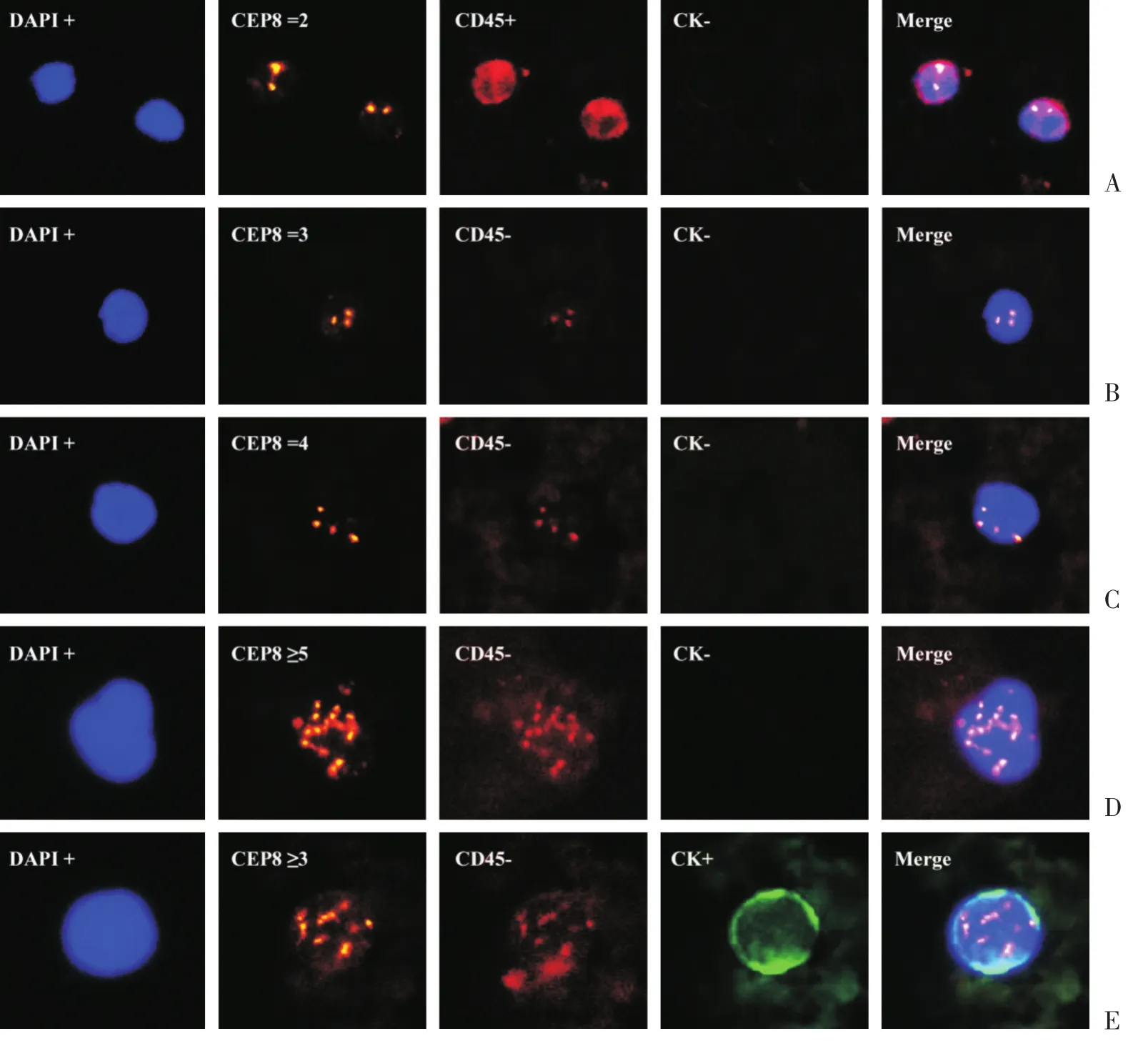
图1 SE-iFISH对术前患者CTC及健康组CTC的鉴定Fig.1 Identification of CTC in colorectal cancer using the SE-iFISH platform
2.2 结直肠癌术前CTC、CEA及CA199在结直肠癌诊断中的作用
术前患者CTC阳性率(CTC≥1个/7.5 mL)为91.0%,健康组CTC阳性率5.0%,两组有显著性差异(P<0.01)。使用受试者工作特征(ROC)曲线判断区分结直肠癌患者与健康对照组的临界值。分别设定临界值(cutoff value)为 1个 CTC,2个CTC和3个CTC,AUC面积分别为0.950、0.866、0.761;约登指数分别为0.86、0.70、0.47;灵敏度分别为91.0%、69.8%和46.5%;特异度分别为95.3%、100%和100%。当CTC=1个/7.5mL时,AUC面积和约登指数最大(AUC=0.950;Youden index=0.86)。所以将CTC=1个/7.5 mL定为结直肠癌的诊断临界值,相应的灵敏度为91.0%,特异度为95.3%,假阳性率为4.7%,假阴性率为9.0%,准确性92.0%(图2A)。
术前CEA>5 ng/mL的28例(41.8%);术前CA-199>37 U/mL的18例(26.7%)。将CEA的临界值设定为5 ng/mL,CA-199为37 U/mL时,进一步使用受试者工作特征曲线(ROC)分析,CEA和CA-199曲线下面积分别为0.63和0.63,其灵敏度分别为51.0%和49.0%,其特异度均为85.0%(图2A)。进一步分析CTC与CEA、CA-199之间的关系,CEA和CTC之间的相关性系数为-0.012(P=0.734),表明CEA和CTC是相对独立的参数(图2B)。CA-199与CTC的相关性系数-0.000 45(P=0.923),因此CA-199和CTC也是相对独立的参数(图2C)。

图2 结直肠癌患者CTC与血清CEA和CA-199水平的关系Fig.2 Association of CTC number with serum CEA and CA-199 levels from colorectal cancer patients
2.3 结直肠癌CTC数值与临床病理参数的相关性
术前CTC的阳性率在Ⅰ期88.9%,Ⅱ期为89.2%,Ⅲ期为90.4%(P=0.592);术前CTC中位值Ⅰ期3个(IQR 1,3),Ⅱ期为3个(IQR 1,4.5),Ⅲ期为2(IQR 1.5,4;P=0.529)。术后CTC的阳性率Ⅰ期88.9%,Ⅱ期100%,Ⅲ期95.2%(P=0.102);术后CTC中位值Ⅰ期2个(IQR 2,3.5),Ⅱ期为 2个(IQR 2,3),Ⅲ期为 3(IQR 2.5,4;P=0.138)。术后CTC数值与侵袭深度和肿瘤部位有关(P=0.001;P=0.044),与性别、年龄、肿瘤大小、淋巴结转移、CEA水平以及CA-199水平没有相关性。术前CTC数值与上述临床病理参数均不相关(表1)。

表1 术前、术后CTC数值和临床参数的相关性Table 1 Association of preoperative and postoperative CTC with clinicopathological parameters
2.4 结直肠癌CTC数值与DFS和OS的相关性研究
2.4.1 术前CTC数值不能预测无病生存期(DFS)和中位总生存期(OS) 全组病例均获完整的随访资料,失访0例,随访率100%。末次随访日2018年12月31日,随访时间53.0个月。随访期间出现远处转移15例,局部复发5例,其中死亡13例(远处转移10例,局部复发3例)。中位DFS为32.3个月(IQR 20.7~48.5),中位OS为43.9个月(IQR 33.0~49.00)。
使用ROC曲线分析CTC与无病生存期(DFS)和总生存期(OS)的关系。术前CTC对DFS和OS预测意义不大(AUC=0.359,P=0.068;AUC=0.428,P=0.423);术后以CTC=3个/7.5 mL为临界点对DFS和OS预测意义显著,AUC值最大(AUC=0.936,P < 0.001;AUC=0.863,P < 0.001;图3)。

图3 ROC曲线分析CTC与无病生存期和总生存期的关系Fig.3 Prediction effect of CTC on disease free survival and overall survival by ROC curve
使用Kaplan-Meier和Log-rank方法进一步分析发现术前CTC各组数值与DFS和OS无统计学意义(P=0.155,P=0.729;图4)。
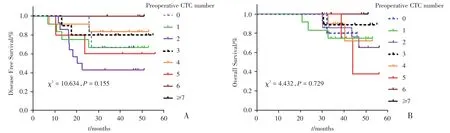
图4 术前CTC各组数值与无病生存期和总生存期的关系Fig.4 Relationship between preoperative CTC values and disease free survival and overall survival
2.4.2 术后CTC数值可以预测DFS和OS 术后CTC<3的48例(71.6%),术后CTC≥ 3的19例(28.4%)。术后CTC<3组的DFS和OS均较CTC≥3组显著延长(DFS:43.7月 vs 20.4月,P < 0.001;OS:54.4月 vs 43.3月,P <0.001;图5)。

图5 术后CTC数值与无病生存期和总生存期的关系Fig.5 The relationship between postoperative CTC value and disease free survival and overall survival
术后CTC升高的25例(37.3%),持平或降低的42例(62.7%)。CTC持平或降低组的DFS和OS均较术后CTC增高组显著延长(DFS:48.7月vs 26.8月,P < 0.001;OS:54.8月 vs 45.1月,P < 0.001;图6)。
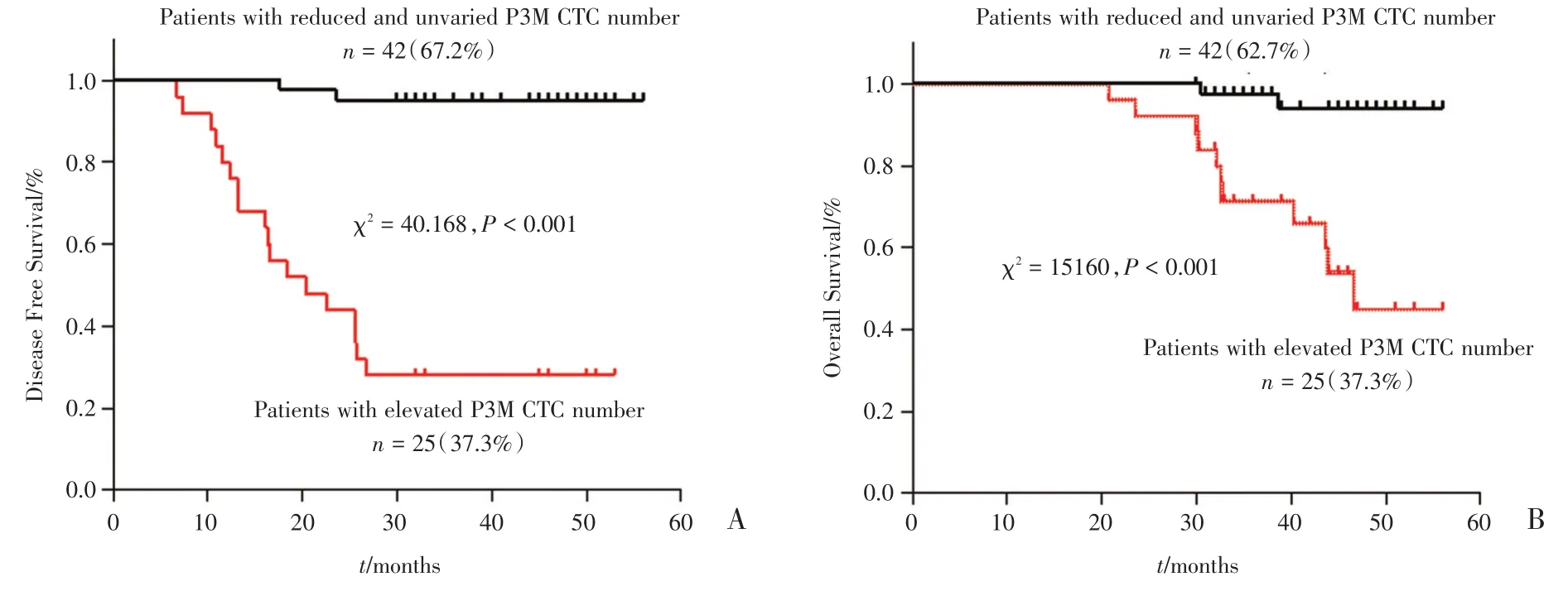
图6 手术前后CTC数值变化与无病生存期和总生存期的关系Fig.6 The relationship between CTC value before and after surgery and disease free survivaland overall survival
2.5 结直肠癌预后的单因素和多因素分析
利用单因素Cox比例风险回归模型对性别、年龄、肿瘤部位、肿瘤大小、侵袭深度、淋巴结转移、CEA水平、CA199水平以及CTC数值进行分析。发现术后TNM分期、术后CEA>5 ng/mL、术后CTC≥3个/7.5 mL、术后CTC数值增加与DFS不良预后有关。然后将上述4个变量纳入多因素Cox比例风险回归模型中,结果发现术后CEA>5 ng/mL和术后CTC≥3个/7.5 mL是早中期结直肠癌DFS不良预后的独立判断因素(表2)。其次术后TNM分期、淋巴结分期、术后CEA>5 ng/mL、术后CTC≥3个/7.5 mL及术后CTC数值增加(与术前比较)与OS不良预后有关。然后将上述5个变量纳入多因素Cox比例风险回归模型中,结果发现临床TNM分期、淋巴结分期及术后是早中期结直肠癌OS不良预后的独立判断因素(表2,3)。

表2 早中期结直肠癌单因素和多因素回归分析赋值表Table 2 Univariate and multivariate Cox regression assignment table
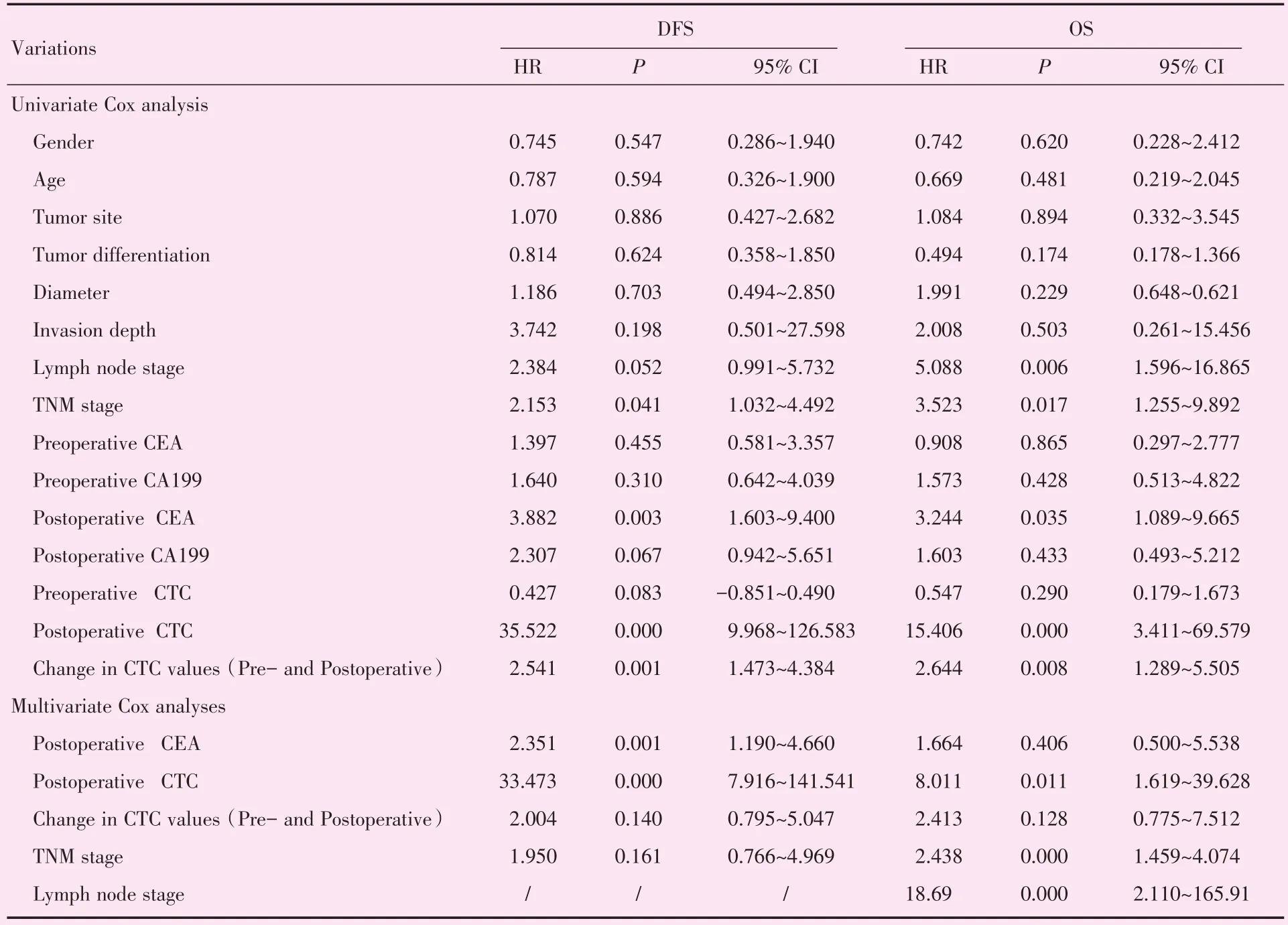
表3 早中期结直肠癌无进展生存期和总生存期的单因素和多因素回归分析Table 3 Univariate and multivariate Cox regression for disease free survival and overall survival
3 讨论
随着肿瘤医学科学的发展,结直肠癌的治疗进入全程精确管理模式。尤其对早中期结直肠癌患者,如何早期发现、有效治疗以减少肿瘤的转移和复发,同时避免不必要的治疗以及相应的副作用是目前临床研究的重点。CTC检测作为一种相对无创且可以重复进行的液体活检技术对结直肠癌的诊断具有潜在的应用价值[10-11]。
外周血循环肿瘤细胞的鉴定主要经过CTC细胞的富集和识别两个过程,但不同实验室的标准并未完全统一。目前CellSearch系统是检测CTC最常用的平台,通过藕联了抗EpCAM抗体的磁珠捕获上皮细胞,使用CK(8、18、19)识别CTC。本研究使用广谱细胞角蛋白抗体(pan-CK antibody)识别CK家族成员(CK4、5、6、8、10、13和18),但结果显示CK阳性的结直肠癌患者只有22.4%(15/67)。这一结果也在一定程度上证明循环肿瘤细胞EMT过程中CK的表达出现下调甚至缺失。先前多项研究证明,CellSearch系统阳性检出率在4.9%~47.5%之间,不适合早期非转移性结直肠癌的监测[12-13]。
本研究采用的差减富集技术(subtraction enrichment technology,SET)可以有效去除红细胞、白细胞,而最大程度的留取CTC用于后续实验。免疫荧光原位杂交技术(iFISH)是将免疫荧光染色方法与原位荧光杂交方法相整合。在本研究中使用CK、CD45、DAPI分析细胞表面蛋白表型的同时,使用CEP-8检测染色体核型,共同识别CTC。多倍体是肿瘤细胞主要的染色体异常,细胞核不稳定的表现,极易发生基因突变,驱动癌症的发展[14-15]。使用CEP8检测CTC染色体数目的变化,根据染色体拷贝数的不同,CTC可以分为单倍体、二倍体、三倍体、四倍体和≥5倍体等不同亚型[16]。本组研究中有123个三倍体细胞(占48.6%);39个四倍体细胞(占15.4%);91个≥5倍体细胞(占36.0%)。由此我们可以认为,iFISH与单纯的免疫荧光染色方法或者单纯染色体的原位荧光杂交方法相比,其生物信息量更大。利用SE-iFISH可以检测肺癌、肝癌、鼻咽癌及骨肉瘤等多种实体肿瘤的CTC,CTC的阳性率统计结果在75%~100%[17-18]。本研究中的结直肠癌患者CTC阳性率91.04%,与CEA和CA199相比,在早期结直肠癌检测上具有更高的灵敏性与特异性,而且是相对独立的血清标志物,因此CTC有望成为早期结直肠癌筛查与诊断的有效指标。
目前,结直肠癌患者CTC和临床病理各参数之间的关系仍无统一认识。Hinz等[19-20]采用CK20 RT-PCR技术检测分别对术前辅助放化疗后的267例直肠癌和299例结肠癌进行CTC检测,发现在结肠癌中CTC的检出率与肿瘤分期、淋巴结分期、肝脏转移呈正相关,但在直肠癌中却没有相关性。有趣的是,在本研究中我们发现术前CTC计数与各临床病理参数无显著差异,但是术后结肠癌的CTC计数比直肠癌显著升高,其次T3-T4的CTC计数比T1-T2显著升高。这一结果可能与直肠癌和结肠癌在解剖、功能和胚胎起源方面存在差异,以及结肠癌与直肠癌的治疗存在差异有关。
外周血CTC在晚期结直肠癌的预测作用已经得到了肯定,但对于早中期结直肠癌,尤其是围手术期的结直肠癌,是否同样可以预测预后仍存在争议。Rahbari等[21]虽然证明外周血CTC对早期结直肠癌的预后具有预测意义,但认为在这项分析中只有2项研究是根据手术前后循环肿瘤细胞提供独立预后数据,因此提出需要对同一患者群体的术前和术后样本进一步研究,以评估术后肿瘤细胞检测是否为预测预后最准确的指标。在我们的研究中,分别在术前24 h和术后3月检测CTC,发现术前CTC的预后预测意义较小,但术后CTC临界值3个/7.5 mL对预后预测意义显著。研究发现早中期结直肠癌术后分为良好预后组(术后CTC<3或者术后CTC数目持平或减少)和不良预后组(术后CTC≥3或者术后CTC数目增加),良好预后组的DFS和OS均较不良预后组显著延长。多项研究表CTC可以反映结直肠癌患者的化疗敏感性[22-23],并与接受化疗的结直肠癌患者的放射影像进展相关[24]。但Chu等[25]研究提示CTC与结直肠癌新辅助化疗疗效无相关性。本研究中术后辅助放化疗在术后一个月开始,所以术后3个月的CTC值可能反应辅助放化疗的疗效,有望成为判断辅助放化疗敏感性的指标;其次术前与术后CTC预测意义不同,也可能与术后进行了辅助放化疗有关,但仍需扩大样本进一步研究。
影响早中期结直肠癌的预后有多种因素,在本研究中我们发现术前CTC数值与预后不相关,但是术后CEA>5 ng/mL和术后CTC≥3个/7.5 mL是PFS独立不良预后因素,TNM分期、淋巴结分期及术后CTC≥3个/7.5 mL是OS独立不良预后因素。这个结果与之前Yang等[26]在211例Ⅰ-Ⅲ期结直肠癌的发现类似,术后CTC阳性是不良预后的独立指标,而术前CTC阳性与预后无关;术后CTC阳性的患者复发风险高于术前CTC阳性的患者数量。因此术后进行CTC检测具有重要临床意义,可以独立预测早期结直肠癌的进展和生存,从而确定治疗方案;还可以在治疗过程中实时监测治疗进程和效果,对治疗方案加以修正,为个体化治疗提供有用参考。
综上所述,本研究通过前瞻性队列研究,利用SE-iFISH技术检测循环肿瘤细胞数目,并证实SE-iFISH技术检测早中期结直肠癌患者外周血的CTC具有高灵敏性与高特异性的优势。本研究还发现,术前CTC不能预测早中期结直肠癌的预后,但术后CTC可以独立预测早中期结直肠癌的预后;其次动态监测手术前后CTC的变化也可以预测早中期结直肠癌的预后。

