RNA干扰高迁移率族蛋白1对Aβ25-35刺激HT22细胞中晚期糖基化终末产物受体/Toll样受体4信号通路相关蛋白表达的影响
韩 园,刘 煜,戈文威,王孝庆,曹 红,李 军
(温州医科大学附属第二医院,育英儿童医院麻醉与围术期医学科,浙江 温州325027)
阿尔茨海默病(Alzheimer disease,AD)是一种多发的病因未明的中枢神经系统退行性疾病,主要表现为记忆力减退,认知功能障碍以及性格改变,严重影响患者正常生活和基本工作[1]。目前公认主流学说“β 淀粉样蛋白(amyloid-β,Aβ)级联瀑布假说”,是指脑内沉积的Aβ主要由淀粉样前体蛋白(amyloid-β precursor protein,APP)经过β 分泌酶Ⅰ和γ 分泌酶1 和酶2 所合成,然后又通过脑啡肽酶(neprilysin,NEP)等方式降解。AD 患者脑内Aβ的形成和清除的不平衡导致过量的Aβ产生级联作用,可通过炎症反应、氧化应激、糖氧剥离、细胞凋亡、线粒体功能障碍等多种途径加速AD 的病程。AD 患者脑内的Aβ 激活了神经元细胞和小胶质细胞,继而释放大量的炎症因子,通过氧化还原反应对神经元以及突触造成伤害[2]。高迁移率族蛋白box-1(high mobility group box-1 protein,HMGB1)是一种非组DNA结合蛋白,不仅参与DNA的转录,且在神经元细胞和小胶质细胞上广泛表达,参与脑中神经炎症的进程,其受体主要有晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)、Toll样受体2(Toll-like receptor 2,TLR2)和TLR4等[3]。近年来研究表明,靶向特异性抑制HMGB1对于慢性炎症反应和自身免疫性疾病等的治疗有一定作用[4],而小干扰RNA(small interfering RNA,siRNA)沉默HMGB1 表达,可减少Aβ25-35刺激下原代海马神经元细胞中HMGB1 的表达,其机制可能与RAGE/TLR4信号通路相关[5],故本研究探讨siRNA抑制HMGB1的表达对Aβ25-35刺激HT22的影响,进一步研究HMGB1在AD病理机制中的作用。
1 材料与方法
1.1 药物和试剂
Aβ25-35(A4559)和MTT(M5655)购自美国Sigma公司;DMEM培养基和胎牛血清购自美国Gibco公司;脂质体转染试剂GenMute(SL100568)购自美国Signagen公司;兔抗小鼠HMGB1多克隆抗体(ab18256)、兔抗小鼠RAGE多克隆抗体(ab3611)、兔抗小鼠NF-κB P65 单克隆抗体(ab7970)购自英国Abcam 公司;小鼠抗小鼠TLR4 单克隆抗体(sc-293072)购自美国Santa公司;兔抗小鼠β肌动蛋白多克隆抗体(ap0060)购自美国Bioworld公司;小鼠IL-1β 和TNF-α ELISA 检测试剂盒购自美国R&D 公司;DyLight-594 驴抗兔(E032421)购自美国Earthox 公司,HRP 标记的山羊抗兔IgG 二抗(BYE003)和HRP 标记的山羊抗小鼠IgG 二抗(BYE004)购自美国Jackson 公司(上海博蕴生物科技有限公司分装)。
1.2 细胞培养
HT22 细胞购自ATCC 细胞库,该细胞是小鼠海马细胞来源的HT-4 细胞系的一个亚系[6]。将HT22细胞接种于DMEM完全培养基(含1%青链霉素、10%胎牛血清),置于37°С,5%CO2恒温培养箱中培养。
1.3 MTT法测Aβ25-35细胞存活
对数生长期的HT22 细胞经胰酶消化,按5×107L-1的密度接种于96孔板。16 h后,细胞铺满孔底,吸去孔内培养液,各组加入不同浓度的Aβ25-35(0,2.5,5,10,20和40 μmol·L-1),每组设3个复孔,孵育24 h 后,加入20 μL MTT 溶液,继 续培养4 h 后,每孔加150 μL DMSO,振荡10 min,使结晶物充分融解。用酶标仪测定在490 nm处的吸光度A490nm,并计算细胞存活率,实验重复3 次。细胞存活率(%)=(处理组A490nm-空白组A490nm)/(对照组A490nm-空白组A490nm)×100%。计算得出其半抑制浓度(IC50)
1.4 HMGB1 siRNA序列的筛选
根据siRNA 的设计原则和GenBank 中的HMGB1 的基因序列,设计出具有特异性的针对HMGB1 的4 个大小为21 个核苷酸的干扰序列(siRNA551,siRNA706,siRNA773 和siRNA821),以及与HMGB1 序列无同源性的阴性对照片段(scramble siRNA)。siRNA 序列委托上海吉玛公司合成:siRNA551:5′-CAAGGCUCGUUAUGAAAGATT-3′(正义链),5′-UCUUUCAUAACGAGCCUUGTT-3′(反义链);siRNA706:5′-GCUUAUCCAUUGGUGAUGUTT-3′(正 义 链),5′-ACAUCACCAAUGGAUAAGCTT-3′(反义链);siRNA773:5′-GCAGCCCUAUGAGAAGAAATT-3′(正义链),5′-UUUCUUCUCAUAGGGCUGCTT-3′(反义链);siRNA821:5′-GGAUAUUGCUGCCUACAGATT-3′(正义链),5′-UCUGUAGGCAGCAAUAUCCTT-3′(反义链)。
选取对数生长期的细胞,用0.25%胰酶消化后,加入含10%胎牛血清的DMEM,调整细胞浓度为1×108L-1,接种至6孔板中,待细胞生长达50%~60%融合度时进行转染,转染按GenMute转染试剂说明书操作。转染24 h 后收集细胞进行Western印迹检测。
1.5 免疫荧光法观察HMGB1的定位
取对数生长期的HT22 细胞,接种于带有细胞爬片的6孔板上,16 h后加入Aβ25-35处理24 h,经多聚甲醛固定,Triton X-100 通透,山羊血清封闭,加一抗(兔抗小鼠HMGB1 多克隆抗体,1∶1000)和荧光标记二抗(DyLight-594 驴抗兔,1∶50),以及4’,6-二脒基-2-苯基吲哚(DAPI)复染核,最后在荧光显微镜下进行观察。
1.6 Western印迹法检测HMGB1,RAGE,TLR4和NF-κB P65蛋白量表达
将对数生长期的HT22 细胞分为5 组:正常细胞对照组(按常规方法培养不做任何处理),Aβ25-35组(加入终浓度为40 μmol·L-1的Aβ25-35,处理24 h);siRNA 组(转染siRNA 50 μmol·L-1,作用24 h);siRNA 或scramble siRNA+Aβ25-35组(转染siRNA或scramble siRNA 50 μmol·L-1作用24 h后,加入终浓度为40 μmol·L-1的Aβ25-35继续孵育24 h)。
收集细胞,提取细胞蛋白,BCA 法测定蛋白质浓度,经制胶、上样(10 μL体积含30 μg蛋白样品)、电泳、转膜、封闭、孵育一抗(HMGB1,1∶1000;RAGE,1∶1000;TLR4,1∶500;NF-κB P65,1∶2000和β肌动蛋白,1∶1000)及二抗(HRP标记的山羊抗兔IgG 二抗,1∶5000;HRP 标记的山羊抗小鼠IgG二抗,1∶5000)后曝光,用Quantity One软件对蛋白HMGB1,RAGE,TLR4,NF-κB P65 和β 肌动蛋白进行积分吸光度(integrated absorbance,IA)分析。待测蛋白相对表达水平用IA目标蛋白/IAβ肌动蛋白比值表示。
1.7 ELlSA法检测细胞上清液中lL-1β和TNF-α的水平
收集正常细胞对照组(不做任何处理)、Aβ25-35组(加入终浓度为40 μmol·L-1的Aβ25-35,处理24 h)、siRNA+Aβ25-35组(转染siRNA 50 μmol·L-1作用24 h后,加入终浓度为40 μmol·L-1的Aβ25-35继续孵育24 h)各组细胞上清液,按ELISA 试剂盒说明书操作,用酶标仪测定标准品及样本吸光度值,根据标准品的浓度和吸光度绘制标准曲线,计算样本IL-1β和TNF-α水平。
1.9 统计学分析
2 结果
2.1 Aβ25-35作用HT22细胞24 h时lC50
MTT 结果显示(图1),Aβ25-350,2.5,5,10,20和40 μmol·L-1作用HT22 细胞24 h 后,HT22 细胞的存活率随着Aβ25-35浓度增加而下降,IC50为41.17 μmol·L-1,为此本研究采用Aβ25-3540 μmol·L-1进行后续实验。
2.2 Aβ25-35对HT22细胞形态的影响
显微镜观察细胞形态结果(图2)显示,正常组HT22 细胞形态良好,胞体丰满,突起细长明显,突起间连接紧密;Aβ25-3540 μmol·L-1作用24 h 后,细胞大量死亡,聚集成团,突起减少,细胞间隙增大(箭头所示)。
2.3 Aβ25-35引起HT22细胞中HMGB1的定位改变
免疫荧光观察结果(图3)显示,蓝色荧光代表DAPI染色阳性的细胞核,红色荧光代表HMGB1染色阳性的细胞,在正常对照组,红色荧光与蓝色荧光重合,说明HMGB1定位在核内;经Aβ25-3540 μmol·L-1作用24 h 后,红色荧光分布于蓝色荧光周围,说明HMGB1从核内逐渐释放至核外(见箭头所示)。

Fig.3 Effect of Aβ25-35 on location of high mobility group box-1 protein (HMGB1) in HT22 cells by immunofluorescence staining. Red colour represents HMGB1-positive cells;blue colour represents DAPI-positive cells. HT22 cells were stimulated by Aβ25- 35 40 μmol·L- 1 for 24 h. Arrows show location changes of HMGB1.
2.4 siRNA对HMGB1表达的抑制
Western印迹结果(图4)显示,与正常对照组相比,siRNA551,siRNA706,siRNA773和siRNA821组细胞中HMGB1 蛋白表达均显著降低(P<0.05);提示4条特异性的siRNA序列均抑制HMGB1蛋白的表达,siRNA821抑制率最高,故选择其用于后续实验。
2.5 沉默HMGB1 对Aβ25-35诱导的HMGB1,RAGE,TLR4 和NF-κB P65表达的影响

Fig.4 lnhibitory effect of four kinds of small interfering RNAs (siRNAs) on expression of HMGB1 protein by Western blotting. HT22 cells were transfected by siRNA551,siRNA706,siRNA773 and siRNA821 or scramble siRNA at concen-50 μmol·L-1 for 24 h. B was the semi-quantitative result of A.s,n=3.*P<0.05,compared with normal control group;#P<0.05,compared with scramble siRNA group.

Fig.5 Effect of HMGB1 inhibited by siRNA821 on expressions of HMGB1,receptor for advanced glycation end products(RAGE),Toll-like receptor 4(TLR4)and NF-κB P65 in HT22 cells induced by Aβ25-35 by Western blotting.HT22 cells were transfeced with siRNA821 or scramble siRNA at concentration of 50 μmol·L-1 for 48 h and induced by Aβ25-35 40 μmol·L- 1 for 24 h. B was the semi-quantitative result of A.s,n=3. *P<0.05,compared with normal control group;#P<0.05,compared with Aβ23-35 40 μmol·L-1 group;ΔP<0.05,compared with siRNA821+Aβ25-35 group.
Western 印迹结果(图5)显示,与正常对照组相比,Aβ25-3540 μmol·L-1组HMGB1,RAGE,TLR4和NF-κB P65 的表达均升高(P<0.05),siRNA821组以上各蛋白表达均下降(P<0.05),提示siRNA821沉默HMGB1 对以上各蛋白的表达有抑制作用;与Aβ25-3540 μmol·L-1组相比,siRNA+Aβ25-35组HMGB1,RAGE,TLR4和NF-κB P65的表达均降低(P<0.05),而scramble siRNA+Aβ25-35组各蛋白表达无明显变化,提示siRNA821沉默HMGB1可特异抑制Aβ25-35诱导的各蛋白表达的增高(P<0.05)。
2.6 沉默HMGB1 对Aβ25-35诱导的HT22 细胞分泌lL-1β和TNF-α含量的影响
ELISA 结果(图6)显示,与正常对照组相比,Aβ25-3540 μmol·L-1处理HT22 细胞24 h 后,Aβ25-3540 μmol·L-1组上清液中IL-1β和TNF-α含量明显升高(P<0.05);与Aβ25-3540 μmol·L-1组相比,Aβ25-35+siRNA 组上清液中IL-1β 和TNF-α 水平明显下降(P<0.05),提示siRNA821沉默HMGB1表达后,可抑制HT22细胞IL-1β和TNF-α的表达。
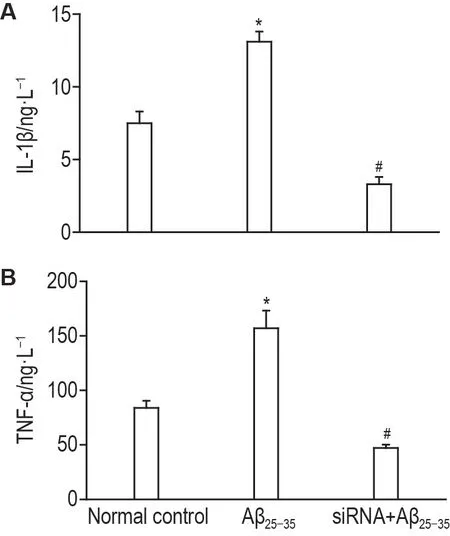
Fig.6 Effect of HMGB1 inhibited by siRNA821 on levels of interleukin-1β(lL-1β)and tumor necrosis factor-α(TNF-α)in culture supernatants of HT22 cells induced by Aβ25-35 by ELlSA. See Fig.5 for the cell treatment.s,n=3.*P<0.05,compared with normal control group;#P<0.05,compared with Aβ23-35 group.
3 讨论
海马区作为大脑边缘系统的主要组成部分,参与机体学习、记忆和整合处理外界信号等重要生理过程。动物实验虽能模拟AD 的发病过程,但因实验受多因素影响,故本研究采用HT22 细胞。该细胞来源于小鼠的海马神经元,因具有可长期连续传代、增殖速度快、均一性好、经济快速便捷、易于转染等优势,常被神经科学研究用于与海马相关的记忆形成和认知障碍方面的分子机制的研究[7]。人工合成Aβ25-35是具有神经毒性的氨基酸片段,故经常被用来建立AD 模型[8]。本研究中,Aβ25-35在40 μmol·L-1时刺激小鼠HT22 细胞,出现细胞活力下降,且细胞形态发生改变,轴突树突变短,胞体间连接减少,继而出现细胞死亡。这模拟了AD 患者脑内海马细胞的病理生理过程,可以作为有效的AD离体模型用于本研究。
本研究采用免疫荧光双标的方法观察到,Aβ25-35刺激HT22 细胞后,HMGB1 从核内转移到核外。HMGB1 主要存在于细胞核内,参与维持DNA稳定,修复损伤DNA,在DNA的转录调控与自我复制等过程中起着十分重要的作用,此外HMGB1 还是启动和维持炎症级联反应的关键分子,与中枢神经系统炎症反应密切相关。临床研究发现,AD 患者的颞叶皮质中,HMGB1 的表达水平升高[9],脑室内联合注射HMGB1和Aβ加剧AD动物模型脑内神经元的死亡并延迟Aβ 从脑中的清除[10]。此外,HMGB1 还与Aβ 形成复合体,稳定Aβ 的低聚体状态,抑制小胶质细胞对于Aβ的吞噬作用[9]。这可能是海马细胞通过HMGB1 核转位实现自我修复的“保护”作用。
本研究发现,Aβ25-35刺激HT22 细胞后,细胞上清液中IL-1β 和TNF-α 水平升高,细胞中HMGB1,RAGE,TLR4 和NF-κB P65 等蛋白的表达均升高。HMGB1 的下游受体主要是RAGE 和TLR 成员,包括TLR2和TLR4。RAGE在神经元及胶质细胞表面均有表达,Aβ 与RAGE 结合后可促进Aβ 由胞外向胞内的转运,加快Aβ 在脑内的沉积,而HMGB1 与RAGE 结 合 后,下 游P38 和ERK 被 激活,继而激活NF-κB,从而导致NF-κB 相关促炎基因的表达上调[11]。而HMGB1 和TLR4 结合后,通过MyD88 依赖性途径进而促使NF-κB 活化,导致大量炎症因子释放[12]。故推测Aβ 可能是通过HMGB1激活了下游NF-κB通路,分子机制见图7。

Fig.7 Aβ triggers nuclear HMGB1 release that can contribute to neuroinflammation via HMGB1-RAGE/TLR4-NF-κB signaling pathway.
RNA 干扰技术(RNA interference,RNAi)已逐渐用于疾病的基因治疗,并已取得初步效果,RNAi利用具有同源性的双链RNA 诱导特异序列的目标基因沉寂,迅速降低基因活性[13]。本研究发现,给予siRNA 沉默HMGB1 表达,可减少Aβ25-35刺激下HT22 细胞内HMGB1 表达的升高,同时也减少了下游RAGE,TLR4和NF-κB P65的表达,并降低了细胞上清液中IL-1β和TNF-α的水平。本课题组前期实验证实,RNA 干扰HMGB1 表达可减少Aβ25-35刺激下BV-2细胞内NF-κB的表达[14]。这与本团队近期的研究结果[5]一致。该研究采用的原代海马细胞取自胎鼠海马组织,尽管原代细胞更能反映体内环境,但培养困难、不易增殖、不易转染,且极易污染。
本研究将治疗策略的重点集中在基因水平上,并大胆地锁定在HMGB1这个位点上。这与前期其他学者研究的蛋白水平方向是一致的。Fujita等[15]研究表明,在AD 大鼠模型上,给予HMGB1 特异性拮抗剂能够抑制神经元退化以及淀粉样沉淀Aβ 形成,有益于改善大鼠的认知功能。Wang 等[16]研究发现,在糖尿病大鼠缺血再灌注损伤模型上,ip给予HMGB1 拮抗剂能够逆转炎症反应以及脑损伤程度。特异性抑制HMGB1 表达在改善神经炎症、改善认知功能方面具有一定保护作用。近年来,抗HMGB1中和抗体、重组A-box蛋白、丙酮酸乙醋和甘草酸苷等天然或合成的小分子HMGB1抑制剂用于HMGB1相关机制疾病的研究得到了越来越多的关注[4],这些研究是在蛋白水平抑制HMGB1 的表达,而本研究将治疗策略的重点集中在基因水平上。
综上所述,通过RNA 沉默HMGB1 的表达,可以降低Aβ25-35刺激下HT22 细胞内炎性蛋白的表达和炎性因子的分泌。可见HMGB1 在AD 发生发展过程中具有重要作用,HMGB1-TLR/RAGE-NF-κB炎症信号通路在AD 模型中具有重要地位。HMGB1有可能成为AD诊断中的一个重要的生物标志物以及AD基因治疗潜在的生物靶点,为AD的治疗提供一种新的思路。然而,将RNAi技术运用到动物模型和人体试验中,仍需要进一步研究和探索。

