人源干扰素基因刺激因子激动剂G10抑制HBV复制
刘博伟,王 伟,孙锁锋,兰 玲,袁 媛,靳钰炜,张 昊,韩双印,李修岭,李 健
1.河南省人民医院 郑州大学人民医院 河南大学人民医院消化科,河南 郑州 450003; 2.上海长海医院消化科; 3.河南省人民医院病理科
乙型肝炎病毒(hepatits B virus, HBV)感染可导致慢性乙型肝炎(chronic hepatitis B, CHB),进而导致肝功能衰竭、肝硬化和肝细胞癌,严重危害人类健康。目前HBV治疗主要依靠干扰素和核苷类药物,存在有效率低、耐药率高和停药后复发等缺点,HBsAg血清学转换更难以实现,使HBV治疗举步维艰。HBV引起CHB的发病机制,既有病毒的始动作用,又有机体固有免疫和适应性免疫功能不足,其中机体足够的免疫系统功能是彻底清除病毒,最终达到临床治愈的决定性因素。从理论上讲,适应性免疫应答过程中任何环节障碍均可造成免疫耐受[1]。因此,通过免疫策略,突破机体免疫耐受,重新激活免疫系统,彻底清除肝细胞内HBV cccDNA对治愈CHB具有重要意义,为当前HBV感染治疗的一个新策略[2-4]。
1 材料与方法
1.1 主要试剂与仪器荧光实时定量PCR(quantitative real-time PCR,qRT-PCR)引物由上海生工生物工程股份有限公司合成。淋巴细胞分离液购自美国Sigma公司,Trizol购自Invitrogen公司,SYBR Green PCR定量试剂盒购自Roche公司。G10,一种小分子人源STING激动剂,购自Aobious公司。
1.2 细胞THP1细胞由中国科学院干细胞库提供,用质量浓度为100 g/L胎牛血清的DMEM培养基(Gibco)常规培养。HepAD38由美国Baruch S.Blumberg Institute Jinhong Chang教授馈赠。HepAD38细胞来源于HepG2细胞,其HBV表达受四环素调控。HepAD38细胞用质量浓度为100 g/L胎牛血清的DMEM培养基(Gibco),400 μg/ml的G418和1 μg/ml的四环素进行常规培养。采用Ficoll-Hypaque密度梯度离心法从健康志愿者全血分离PBMCs,用质量浓度为100 g/L胎牛血清和谷氨酰胺的RPMI-1640培养基(Corning)常规培养。所有健康志愿者抽血前均签署知情同意书。
1.3 PBMCs的分离提取利用Ficoll-Hypaque密度梯度离心法,取20 ml新鲜采集的肝素钠抗凝全血离心去除血浆后,用PBS稀释1倍,加至15 ml淋巴细胞分离液上层,400×g离心30 min,收集离心管中云雾状白膜层(即单核细胞和淋巴细胞富集层),PBS洗涤2遍,得到PBMCs,供下游实验使用。
1.4 qRT-PCR检测PBMCs和THP1细胞IFN-β、TNF-α、IL-28A、IL-29 mRNA表达按照RNA提取试剂盒操作说明,采用柱提法逐步提取RNA。引物序列见表1,以β-actin作为内参, PCR反应体系按说明书配好后,瞬时离心,要注意避光,立即使用Roche Light Cycle 480 Ⅱ仪进行检测。反应条件为:95 ℃变性10 s,60 ℃退火20 s,40个循环。最后进行溶解曲线分析的1个循环:95 ℃ 15 s;60 ℃ 30 s;95 ℃ 15 s。每个样本3个复孔,观察溶解曲线可以分析引物特异性,根据各反应孔的Ct值,计算平均Ct值,采用2-△△Ct计算方法,并用β-actin为内参照,计算每孔待测基因的相对表达量。
1.5 HBV DNA检测采用酚-氯仿核酸提纯法,每份样本加入0.3 ml的Trizol裂解液,用移液枪吹打混匀10~20 s,在冰上静置5 min。将细胞裂解物转移至离心管,300×g,4 ℃,离心5 min以去除细胞碎片。取每管0.2 ml上清至新的离心管,加入0.1 ml蛋白酶K消化液,45 ℃,温浴1 h。每管加入0.3 ml氯仿,轻轻吹打混匀,300×g,4 ℃,离心15 min。弃上清液,置入高压过的1.5 ml离心管中,加入0.3 ml异丙醇颠倒混匀10次,300×g,离心10 min,弃上清液。用0.5 ml预冷的70%乙醇洗涤2次,吸净上清,70 ℃温浴5~10 min,加50 μl的蒸馏水溶解。HBV DNA由qRT-PCR检测,引物序列见表1,以β-actin作为内参,PCR反应体系按说明书配好后,瞬时离心,立即使用Roche Light Cycle 480 Ⅱ仪进行检测反应条件同1.4。

表1 qRT-PCR检测引物序列Tab 1 Primer sequence detected by qRT-RCR
1.6 统计学方法采用SPSS 10.0统计软件包进行分析。计量资料进行单因素方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 G10诱导PBMCs 细胞IFN-β、TNF-α、IL-28A、IL-29 mRNA表达G10处理6 h后收集细胞,进行qRT-PCR检测。结果显示,G10处理的PBMCs细胞IFN-β、TNF-α、IL-28A、IL-29 mRNA表达水平显著高于对照组(P<0.05),以诱导IFN-β表达作用最强,可上调达678倍,并呈剂量依赖性(见图1)。这提示G10能诱导PBMCs表达以IFN-β为主的细胞因子。
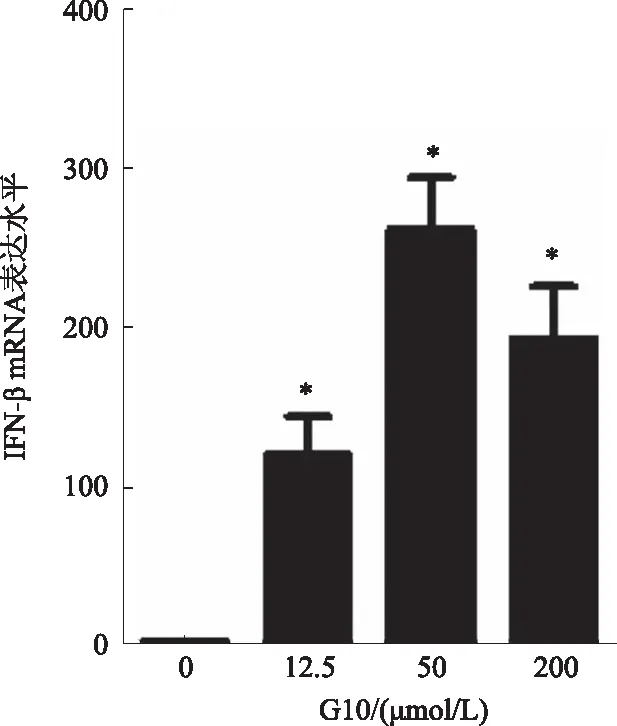
2.2 G10诱导THP1细胞IFN-β mRNA表达G10处理6 h后收集细胞,进行qRT-PCR检测。结果显示,与对照组相比,G10显著上调THP1 细胞表达IFN-β mRNA(P<0.05),在G10 50 μmol/L达峰值(见图2)。提示G10能诱导THP1 细胞高表达IFN-β细胞因子。
2.3 评价G10诱导的抗HBV作用的细胞培养体系的建立我们首先用G10处理THP1细胞,然后用含1/2 THP1上清液与不含四环素细胞培养基常规培养HepAD38 72 h(间接作用),观察G10在HepAD38的抗HBV作用。并用G10直接作用于HepAD38(直接作用)作为对照(见图3)。

注:与对照组比较,*P<0.05。
注: 与对照组比较,*P<0.05。
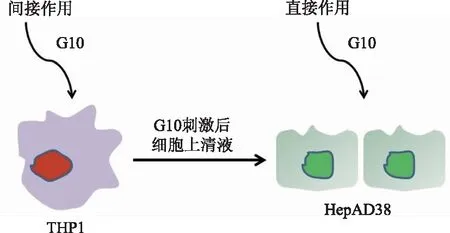
图3 细胞处理示意图Fig 3 Schematic representation of treatment strategy
2.4 G10间接作用抑制HepAD38 HBV DNA表达间接处理72 h后收集HepAD38细胞,进行qRT-PCR检测。结果显示:与对照组相比,G10明显抑制HepAD38细胞HBV DNA,最高抑制率可达14.8%。而G10直接刺激HepAD38细胞却无类似效应(见图4)。提示G10可通过诱导THP1激活固有免疫反应发挥抗HBV作用。
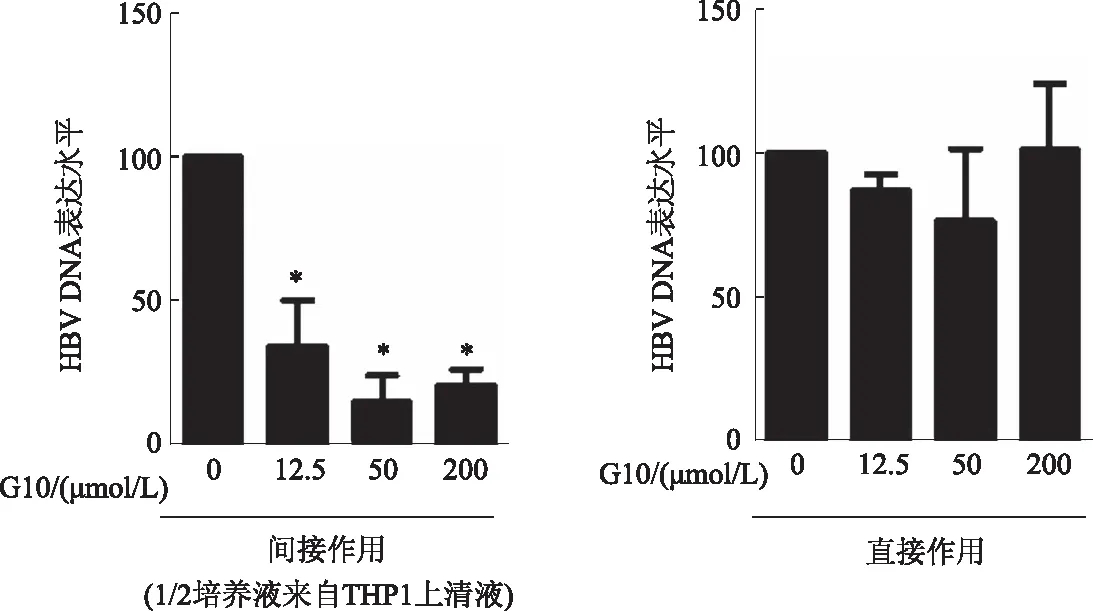
注:与对照组比较,*P<0.05。
3 讨论
通过增强或恢复机体抗HBV免疫功能以控制和清除HBV感染的免疫治疗,是当前抗HBV治疗的一个新策略[2,5]。此外,发现CHB患者接受HBV自愈者的骨髓移植后得到治愈,直接证实了免疫治疗的有效性[6]。那么如何突破机体免疫耐受,重新激活免疫系统?宿主细胞通过模式识别受体(PRRs)识别并抵御病原体入侵的方式,让人们更清晰地理解了细胞中调节固有免疫抵抗病原微生物在分子水平上的机制,可能为免疫治疗提供了一种新策略。病原体入侵机体后通过多种途径引起IFN-Ⅰ产生,病原体表面的病原相关分子模式(PAMPs)能被TLRs、维甲酸诱导基因1样受体(RLRs)等PRRs识别介导抗感染固有免疫应答,并调节适应性免疫应答[7]。
STING作为一种能识别细胞质DNA的信号传导分子和识别细菌第二信使的PRRs[8],在病原体(病毒、细菌、寄生虫等)感染时识别胞质DNA、诱导IFN-Ⅰ、激发人体固有免疫,发挥免疫防御作用,在抵御病原微生物入侵、抗肿瘤免疫效应中发挥重要作用[9-11]。STING作为抗HBV免疫治疗的新靶点逐渐进入人们的视野,其抗HBV作用日益受到人们的关注。可激活人源STING小分子化合物目前仅有G10和DSDP[12-13],前者能够激活STING-TBK1-IRF3通路、诱导IFN-Ⅰ表达,发挥抗病毒作用。后者是我们通过高通量药物筛选体系从16 000个化合物中筛选出的人源STING激动剂。前期的研究发现,DSDP能激活PBMCs和人成纤维细胞的STING-TBK1-IRF3通路,诱导IFN-Ⅰ的表达。DSDP在黄热病病毒(yellow fever virus,YFV)、登革热病毒(Dengue virus, DENV)及塞卡病毒(Zika virus,ZIKV)的抗病毒作用已被证实[12]。
我们的前期研究还发现,STING激动剂cGAMP能诱导肝细胞产生包括IFN-β在内大量的细胞因子,抑制感染HBV肝细胞HBV cccDNA转录,降低HBsAg表达[14]。但cGAMP激活STING通路需要破膜剂才能使药物通过细胞膜,临床应用受限。本研究拟观察人源STING激动剂G10诱导人源细胞IFN-Ⅰ表达情况,并初步观察其抗HBV作用,为STING激动剂抗HBV治疗提供实验基础和理论依据。
由于肝细胞缺乏或低水平表达STING,直接用STING激动剂处理肝细胞难以有效激活STING信号通路诱导IFN-Ⅰ、激发人体固有免疫,发挥抗HBV作用。而免疫细胞如巨噬细胞和抗原递呈细胞(dendritic cells,DC)高表达STING可有效诱导IFN-Ⅰ、激发人体固有免疫。而肝脏微环境存在大量非实质细胞如Kupffer细胞和DC高表达STING,推测G10有可能通过激活肝脏的免疫细胞,而后者释放大量以IFN-Ⅰ为主细胞因子,发挥抗HBV作用。因此,我们用G10处理的THP1细胞上清液处理HepAD38细胞,建立间接抗HBV反应体系,观察G10在HepAD38的抗HBV作用。正如我们预期,我们的研究提示,G10能够诱导PBMCs和THP1高表达以IFN-β为主的细胞因子。这提示G10能诱导人免疫细胞分泌IFN-β为主的细胞因子。进一步研究发现,与对照组相比,用G10处理后的THP1细胞上清液明显抑制HepAD38细胞HBV DNA,最高抑制率可达14.8%。而G10直接刺激HepAD38细胞却无类似效应。提示G10可通过诱导THP1激活固有免疫反应发挥抗HBV作用。我们的研究与以往研究一致[14-15],证实了激活 STING能够诱导固有免疫反应而发挥抗HBV作用。
我们的研究进一步证实了激活STING通路能够诱导细胞因子表达发挥抗HBV作用,同时也证实开发人源小分子STING激动剂作为治疗CHB的免疫治疗是可行的,为STING激动剂抗HBV治疗提供实验基础和理论依据。本研究为靶向STING抗HBV免疫治疗提供实验基础和理论依据,为乙肝治疗探索新方法。当然,G10的抗HBV作用还需要在动物实验中进一步验证。

