异唑草酮水解及在水中的光解
汤涛 张昌朋 吴珉 许振岚 赵华 赵学平
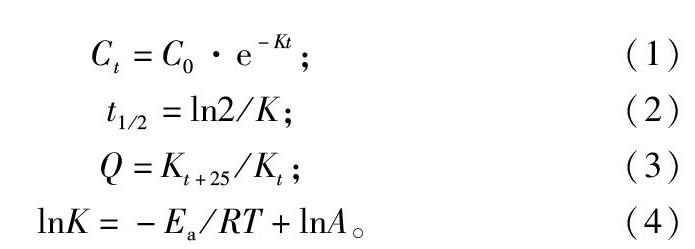
摘要:实验室条件下,采用高效液相色谱研究了异唑草酮水解和在水中的光解动态特性,结果表明,异唑草酮在碱性缓冲液中水解最快,在酸性缓冲液中水解最慢,其水解速率随着温度的升高而加快,温度效应系数和活化能均是在碱性缓冲液中最低。在pH值分别为4、7、9的缓冲液中,25 ℃时异唑草酮的水解半衰期分别为15070、8250、3.90 h,50 ℃时的水解半衰期分别为19.40、4.10、0.75 h,根据我国农药登记试验水解等级划分标准,异唑草酮属于易水解农药。在25 ℃,光照度为3 350 lx以及紫外强度为58.8 μW/cm2条件下,异唑草酮在水中的光解半衰期为6.4 h,根据我国农药登记试验的光解特性等级划分标准,异唑草酮属于中等光解类农药。
关键词:异唑草酮;水解;光解;高效液相色谱
中图分类号: TQ457.2 文献标志码: A 文章编号:1002-1302(2019)03-0249-04
异唑草酮(isoxaflutole),化学名称为5-环丙基-1,2- 唑-4-基酮,是罗纳-普朗克公司1992年发现、现由拜耳作物科学公司生产和销售的异唑类除草剂[1],其结构式见图1。异唑草酮为对羟基苯基丙酮酸双氧化酶抑制剂,其在植株和土壤中可快速代谢并打开异唑环形成二酮腈,从而发挥除草作用,被广泛应用于去除玉米、甜菜、甘蔗等旱作物田中的杂草,土壤处理也可以有效防除一年生禾本科杂草如稗草、狗尾草和其他阔叶杂草等[2]。异唑草酮对鸟类、蜜蜂和鱼类等表现出较低和中等毒性,但对水中甲壳类生物则表现出较高的毒性[3]。目前,对异恶唑草酮的研究主要集中于防治效果、检测方法和在土壤中的降解吸附等方面[4-6],有关其在水中的水解和光解研究却很少。农药的水解及光解性能与其在环境中的持久性密切相关,是影响农药在环境中归宿的重要因素之一,也是评价农药在水体中滞留性的重要指标。因此本研究采用室内模拟方法,对异唑草酮光解和水解的影响因素进行了研究, 旨在为异唑草酮的合理使用和环境安全性评价提供科学依据。
1 材料与方法
1.1 药剂及试剂
异唑草酮(isoxaflutole)标准品(纯度为98.6%,百灵威科技有限公司)、异唑草酮原药(纯度为96%,上虞颖泰精细化工有限公司)、色谱纯乙腈、分析纯乙腈、分析纯乙酸乙酯、超纯水、蒸馏水(pH值为7.2)。超纯水和色谱纯乙腈过0.45 μm滤膜后使用。
标准溶液配制:准确称取(5.10±0.01) mg异唑草酮标准品,用乙腈溶解并定容至10 mL,得到质量浓度为 5.03×102 mg/L的标准溶液。
工作溶液配制:准确称取(104.2±0.01) mg异唑草酮原药,用10.0 mL乙腈溶解,再用蒸馏水定容于100 mL容量瓶中,得到质量浓度为1.00×103 mg/L的工作溶液。
pH值为4的缓冲溶液配制方法为量取0.1 mol/L邻苯二甲酸氢钾溶液500.0 mL,加入0.1 mol/L氢氧化钠溶液 4.0 mL,用蒸馏水定容至1.0 L。
pH值为7的缓冲溶液配制方法为量取0.1 mol/L氢氧化钠296.3 mL,加入0.1 mol/L磷酸二氢钾500.0 mL,用蒸馏水定容至1.0 L。
pH值为9的缓冲溶液配制方法为量取0.1 mol/L氢氧化钠213 mL,加入含0.1 mol/L硼酸和0.1 mol/L氯化钾溶液500 mL,用蒸馏水定容至1 L。
1.2 主要仪器设备
2695/2475 PDA(光电二极管阵列检测器)高效液相色谱仪(美国沃特世公司);BP2110D万分之一电子天平(德国赛多利斯公司);XT5409氙灯光解恒温实验箱(浙江杭州雪中炭恒温技术有限公司);DHP-9052型电热恒温培养箱(上海一恒科技有限公司);TES-1339R照度计(中国台湾泰仕公司);双通道紫外辐射计(上海亿欧仪表设备有限公司);YX280A手提式不锈钢蒸气消毒器(上海三申医疗器械有限公司);PB-10型pH计(德国Sartorius公司)。
1.3 试验方法
1.3.1 水解试验 在pH值为4、7、9的缓冲溶液中分别添加异唑草酮原药工作溶液,使其质量浓度为5.00 mg/L,随后将其分装于具塞试管中,分别置于(25±1) ℃和(50±1) ℃ 的恒温培养箱中避光进行反应,每种缓冲溶液设2个平行,于不同时间取样处理检测。所用缓冲溶液及玻璃器皿在使用前均经高温高压灭菌,试验溶液分装在无菌条件下进行。
1.3.2 水中光解试验 向蒸馏水中添加异唑草酮工作溶液,使其质量浓度为5.00 mg/L。将其分装于具塞石英光解管中,盖紧塞子,置于光解恒温实验箱中进行光解试验。试验温度为(25±2) ℃,平均光照度为3 350 lx,平均紫外强度为58.8 μW/cm2。每处理设置2个平行,并设黑暗对照,于不同时间取样处理检测。
1.3.3 样品前处理 将20 mL试验水样置于分液漏斗中,加入20 mL乙酸乙酯手动振荡提取1 min,收集上层乙酸乙酯提取液并置于平底烧瓶中,在40 ℃下旋轉蒸发至近干,用流动相定容至5 mL,取1 mL过0.45 μm滤膜,待液相色谱检测。
1.3.4 HPLC检测条件 色谱柱为Waters XBridgeTM C18(5 μm,250 mm×4.6 mm);柱温箱为40 ℃;流动相体积比 乙腈 ∶ 水=80 ∶ 20,流速为1.0 mL/min;进样体积10 μL;运行时间6 min;检测波长为270 nm;保留时间约为3.3 min。
1.3.5 线性范围 将0.10、0.50、1.01、2.01、5.03、10.06、20.11 mg/L异唑草酮系列标准工作溶液按仪器检测条件进样,每浓度进样3针,获得色谱响应值,以浓度-峰面积绘制异唑草酮标准曲线。
1.3.6 添加回收率 在pH值为4、7、9的缓冲溶液及蒸馏水中分别添加异唑草酮标准溶液,使其质量浓度分别为010、5.03 mg/L,每个添加水平均设5个重复,同时设置不加药剂的空白对照,按样品处理和仪器检测条件进行分析。
1.4 数据计算与统计分析
采用Sigmaplot 10.0统计软件对异唑草酮水解和在水中的光解试验数据进行一级动力学方程拟合,计算不同降解条件下的半衰期、温度效应系数(Q)和反应活化能(Ea,kJ/mol)
式中:Ct为t时水中异唑草酮残留含量,mg/L;C0为水中异唑草酮初始含量,mg/L;K为降解速率常数,h-1;t为培养时间,h;t1/2为降解半衰期,h;R为气体常数,其值为 8.314 J/(K·mol),T为绝对温度,K;A为频率因子。
2 结果与分析
2.1 检测方法的验证
异唑草酮标准工作液在0.10~20.11 mg/L范围内的回归方程为y=83 115.665 4x-4 116.732 8(r2=0.999 5),线性相关性良好;在添加水平为0.10、5.03 mg/L时,异唑草酮在不同pH值缓冲溶液和蒸馏水中的平均回收率为 90%~99%,相对标准偏差(RSD)为0.5%~3.3%;仪器对异唑草酮的最小检出量(LOD)为4.00×10-9 g,异唑草酮在水体中的最低检出浓度(LOQ)为0.025 mg/L。异唑草酮标样及水中添加回收色谱见图2。
2.2 异唑草酮的水解特性
2.2.1 异唑草酮的水解动力学 研究结果表明,在2种试验温度条件下,异唑草酮在3种pH值缓冲溶液中的浓度
均随着反应时间的延长而逐渐降低,其水解动力学均符合一级动力学方程(表1)。25 ℃条件下,异唑草酮在pH值为4、7、9的缓冲溶液中的水解速率分别为0.004 6、0.008 4、0179 0 h,半衰期分别为150.70、82.50、3.90 h。50 ℃条件下,异唑草酮在pH值为4、7、9的缓冲溶液中的水解速率分别为0.035 7、0.169 0、0.924 0 h,半衰期分别为1940、410、0.75 h。根据我国农药登记试验水解等级划分标准[7],异唑草酮属于易水解农药。
2.2.2 温度对水解的影响 在pH值为4的缓冲溶液中,异唑草酮在25、50 ℃条件下的水解曲线见图3-A。25 ℃条件下异唑草酮在pH值为4缓冲液中的初始实测浓度为487 mg/L,水解反应30 h时,残留浓度为3.96 mg/L,其水解率仅为19%;50 ℃條件下异唑草酮在pH值为4的缓冲液中的初始实测浓度为4.86 mg/L,水解反应30 h时,残留浓度为1.71 mg/L,其水解率达到65%。异唑草酮在其他2种缓冲液中也表现出相同的水解规律,即其水解速率随温度的升高而加快。有机化合物的水解与温度密切相关,化合物水解反应的活化能主要来源于分子之间的碰撞,因此温度升高,分子之间碰撞概率增多,则水解速率加快[8]。通常采用温度效应系数来说明水解速率常数与温度的关系,在本研究中,异唑草酮在pH值为4、7、9的缓冲液中Q值分别为7.8、201、5.2,结果表明异唑草酮在中性条件下的水解速率受温度影响较大。
2.2.3 pH值对水解的影响 25 ℃条件下, 异唑草酮在3种不同pH值缓冲溶液中的水解动态见图3-B。在pH值为4和pH值为7的缓冲溶液中水解率达到90%以上分别需要552 h和336 h,而在pH值为9的缓冲溶液中反应23 h,其水解率就高达98%。因此,异唑草酮在碱性缓冲溶液中水解速率最快,中性缓冲液中次之,而在酸性缓冲液条件下的水解速率则最慢。活化能是基态反应物分子与过渡态之间的能量差,其决定反应发生的快速程度,只有发生碰撞分子的能量等于或超过某一定的能量(活化能)时,才可能形成有效碰撞。反应的活化能越低,则在一定温度下活化分子数越多,反应就越快。在本研究中,根据Arrhenius经验式[9]计算异唑草酮在pH值为4、7、9缓冲液中的Ea值分别为57、83、 45 kJ/mol(表2),表明异唑草酮在pH值为9的缓冲液中发生水解反应所需要的能量最低,水解速率应最快,这一推断也与本试验研究结果一致。同时计算获得的异唑草酮在pH值为7的缓冲液中Ea值高于pH值为4的缓冲液,但其在pH值为7的缓冲液中的水解速率亦快于pH值为4的缓冲液,说明异唑草酮水解反应速率除与活化能有关外,还可能与缓冲液的成分和浓度有关,即其水解受亲核试剂影响,推测异唑草酮在缓冲液中水解易受氢氧根离子进攻,且应是双分子亲核取代反应[10-12]。
2.3 异唑草酮在水中的光解特性
黑暗和光照条件下异唑草酮在水中的降解动态曲线见图4。黑暗条件下,异唑草酮的初始实测浓度为 4.78 mg/L,光解反应24 h时的残留浓度为4.51 mg/L,降解率仅为6%;光照条件下,异唑草酮的质量浓度随光解反应时间的延长逐渐下降,其初始实测浓度为4.68 mg/L,光解反应24 h时的残留浓度为0.30 mg/L,降解率达到了94%。对异唑草酮在水中的光解动态数据进行回归分析,得到较好的一级动力学方程Ct=4.218 5e-0.108 4t(R2=0.991 3),半衰期为6.4 h,根据我国农药登记试验的光解特性等级划分标准,异唑草酮在水中的光解性能为中等光解。
3 讨论与结论
异唑草酮的水解速率随体系温度的升高而加快,在碱性条件下水解速率最快,在酸性条件下则最慢,其温度效应系数和活化能均是在碱性缓冲液中最低。异唑草酮的水解特性符合一级动力学方程,25 ℃条件下其在pH值为4、7、9的缓冲溶液中的水解半衰期分别为150.70、82.50、3.90 h;50 ℃ 条件下的水解半衰期分别为19.40、4.10、0.75 h,粮农组织/世界卫生组织农药残留联合专家会议(JMPR)对异唑草酮的水解评估结果也是在碱性条件下最快,其在pH值为5、7、9的缓冲溶液中水解半衰期分别为11.1 d、20.1 h、32 h[13],本研究结果与JMPR评估结果基本一致。根据我国农药登记试验水解等级划分标准,异唑草酮属于易水解农药。异唑草酮在水中的光解趋势明显,在25 ℃、光照度为3 350 lx以及紫外强度为58.8 μW/cm2条件下其光解半衰期为6.4 h,JMPR评估的结果是40 h,本研究结果与之差别较大,原因可能是JMPR提供的研究介质是pH值为5的缓冲液且加了1%的乙腈,本研究的介质是纯水,相比较而言,JMPR提供的结果更真实地反应了异唑草酮在水中的光解特性,而本研究的结果更符合实际水中光解情况。根据我国农药登记试验的光解特性等级划分标准,异唑草酮在水中的光解性能为中等光解。异唑草酮主要应用于玉米、甘蔗、甜菜等作物田,防治一年生杂草,即可喷施也可用于土壤处理,被植物吸收后,可快速打开唑环,形成代谢物二酮腈。因此,在研究评估其环境安全风险时,应同时考察母体和代谢物二酮腈的作物残留、土壤降解、土壤吸附、水解、光解等环境行为,确保客观地评估其环境安全性。
参考文献:
[1]朱文达. 玉米新型除草剂—isoxaflutole[J]. 农药译丛,1997,19(6):61-63,38.
[2]Bhowmik P C,Kushwaha S,Mitra S,et al. Response of various weed species and corn(Zea mays)to RPA 20172[J]. Weed Technology,1999,13(3):504-509.
[3]Pesticide properties database[EB/OL]. [2018-08-02]. http://sitem.herts.ac.uk/aeru/ppdb/en/Reports/412.htm.
[4]高兴祥,孙作文,李 美,等. 异唑草酮防除玉米田杂草及玉米安全性效果测定[J]. 玉米科学,2016,24(5):157-160.
[5]王 东,闫思月,贾春虹,等. 分散固相萃取/超高效液相色谱-串联质谱法测定玉米和土壤中噻酮磺隆-异唑草酮及其代谢物残留[J]. 分析测试学报,2017,36(3):355-360.
[6]Alletto L,Benoit P,Bergheaud V,et al. Variability of retention process of isoxaflutole and its diketonitrile metabolite in soil under conventional and conservation tillage[J]. Pest Management Science,2012,68(4):610-617.
[7]化學农药环境安全评价试验准则:GB/T 31270—2014[S]. 北京:中国标准出版社,2015.
[8]欧晓明,雷满香,裴 晖,等. 新农药硫肟醚的水解研究[J]. 农业环境科学学报,2007,26(6):2309-2315.
[9]Morrica P,Trabue S,Anderson J J,et al. Kinetics and mechanism of cymoxanil degradation in buffer solutions[J]. Journal of Agricultural and Food Chemistry,2004,52(1):99-104.
[10]Jhillu S Y,Soma S D,Adithya P,et al. Convergent synthesis of panclicin-D via intramolecular SN2 displacement approach[J]. Tetrahedron Letters,2014,55(11):1952-1955.
[11]郑和辉,叶常明. 乙草胺和丁草胺的水解及其动力学[J]. 环境化学,2001,20(2):168-171.
[12]王 雪. 唑酰草胺的水解和光解特性研究[D]. 长春:吉林农业大学,2013:21-23.
[13]Isoxaflutole[EB/OL]. [2018-08-02]. http://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/JMPR/Evaluation13/Isoxaflutole.pdf.叶 岳,姜玉霞,陈 华. 大型土壤动物功能类群对小生境环境因子的响应[J]. 江苏农业科学,2019,47(3):253-257.

