FDA药物监管权力结构简析
文/孟八一
作为美国政府监管食品和药品庞大而复杂的国家部门,FDA自1906年组建至今的110多年中,已从最初20余人的团队逐渐发展成为拥有17000名雇员的庞大组织,该机构管理着价值美国国内生产总值约四分之一的产品,并促进美国成为全球规模最大的药品市场和药品生产国。可以说,FDA对全球医药工业都有一定的影响,其组织结构、法律法规文本和执法方式也影响着很多国家和地区的监管部门。对于FDA是怎样管理和引导美国制药工业,FDA的监管权力是怎样构成的,本文尝试从权力结构的角度,对FDA的药物监管做一简单的解析。
Jeremiah J. Kelly在2015年描述了FDA的职责[1]:FDA对美国境内的某些产品和商品负有保证安全、保证有效和/或保证其社会安全(security)的责任。这些产品包括:人和动物用药,生物制品(疫苗,血液制品),人体组织,医疗器械,食品,食用补充剂和化妆品。FDA的职能包括:上市前审查和批准,制定标准,制定法规(正式或非正式),制定法规指南,公众教育,执法和诉讼。
根据Jeremiah J. Kelly的解释,本文作者将FDA的药物监管权力分为法规制定权(rulemaking),行政管理权(administration)和执法起诉权(enforcement and ltigation),试着从这三个角度和层次解析FDA药物监管权力。
一、法规制定权
根据美国的法律体系,FDA是国会授权的食品、药品和化妆品监管机构。FDA依照国会制定的法律行使监管和执法责任,以保证在美国境内的相关产品和商品安全和有效。从1906年至今,美国的四部法律构成了药物监管的基本构架。他们分别是:1906年的《纯净食品药品法案》; 1938年的《联邦食品药品和化妆品法案》;1962年的《联邦食品药品和化妆品法案》修正案;和1984年的《药物价格竞争和专利期恢复法案》,另外还有几十部其他法案。
1938年,美国制定了《联邦登记法案》,国会把各行业执行国家法案的实施细则汇编成集,出版了首部联邦法规集。FDA根据国家法律和联邦法规集进行监管和执法。1968年国会把50个行业的法规整理出版成美国联邦法规集(Code of Federal Regulations),其 中 第 21项(Tittle 21)涵盖医药相关产业,简称21 CFR。除此之外,FDA还颁布各种各样的指导意见(Guidance)。美国药物监管的法律和法规分为三个层次,依次是法律、法规和指南(图1)。

图1 美国药物监管法律和法规示意图
要强调的是,法律和法规是强制性条款,而指南仅反映FDA当下对法律的理解和对法规的解释。指南是指导意见,不具有强制性。下面重点讨论FDA法规制定权形成的过程和方式。
按照1938年《联邦食品药品和化妆品法案》,国会赋予FDA对药物的审查和过程监管责任并不是很多,主要集中于事后检查和追责。1962年,反应停事件后,美国国会颁布《联邦食品药品化妆品法案》修正案。该修正案对药物研究、开发和制造提出了很多新的要求,1963年颁布《研究性新药申请(IND)法案》,1966年开始药物有效性评价(DESI)。《联邦食品药品和化妆品法案》修正案和随后的法律,对FDA的监管和执法提出了很多新的要求。由于对标准、词汇和概念的理解存在差异,FDA不得不经常与各种各样的利益集团和个人打官司,使得FDA的监管和执法异常艰难。1975年美国法院做出判决:赋予FDA在国会法律框架内制定法规的权力,以此减少FDA诉讼或者应对诉讼的工作。从1975年开始,FDA承担了起草21 CFR的主要工作。现在的21 CFR 几乎囊括了医药行业的全部法规。
从1962年到1985年,美国制药工业和FDA监管发生了天翻地覆的变化。20多年中,国会的法律也在不断变化,从1975年开始,FDA有意识减少制定法规,而是通过演说和问题讨论等“非正式”方式发布FDA对法规或拟定中的法规的解释。后来发现,这种方式可以更加有效地引导被监管对象适应法规,同时可以对法律法规做出调整,使之更适于行业发展和监管责任。后来这种“非正式”方式逐步演变成指南,成了FDA与企业交流,并推动相关法规的一种方式。
发布指南最突出的特点就是FDA可以对概念、术语和词汇做出明确和详细的解释而不触及法律,虽然指南不具法律效力,FDA也不对指南承担法律责任,但是这种方式使得FDA可以更具体,更清晰的表达执法和监管意图和方法。
医药行业是一个充满了概念、术语和词汇的行业。欧洲是美国制药的启蒙者和引导者,但据统计,从20世纪50年代开始,FDA创造的概念、术语和行业词汇超过欧洲,现在欧洲药物监管机构也开始大量引用FDA的词汇、概念和术语。“模糊”也产生权力。FDA对模糊概念和模糊术语的解释权和定义权使得FDA几乎“无所不管”。以充分的有 效 性 证 据(substantial evidence of effectiveness) 为 例,1962年《 联 邦食品药品和化妆品法案》修正案首次提出这一概念。在当时及后来很长一段时间,不但制药企业和研究者对这个说法一头雾水,就连FDA自己的某些审查官也没有明确的定义。在开启DESI后,制药企业和FDA因为对抗生素合并用药的充分有效性证据对簿公堂,FDA对它的解释是两组对照试验(大约是1970年)。到了1980年,在国会听证时,FDA的医学审查员对充分有效证据的解释为:①设计合理且有良好对照的试验(adequate and well-controlled investigations); ② 这些试验需要由经过科学训练且有经验的专家 完 成(experts qualified by scientific training and experience);③在此基础上所设计的研究可以保证客观而确切的证实其所宣称的疗效(on the basis of which it can fairly and responsibly be concluded that the drug will have its claimed effect)。也就是说,由 FDA 来审核申办方的设计,申办方要雇佣FDA认可的有资质的人员,试验结果符合FDA要求。其中,如安全(safe)、有效(efficacy)、 适 当(adequate)、 合 理设计(reasonable design)、可靠证据(substantial evidence)、良好控制的研究(well-controlled experiments)、 详细陈述(detailed statement)等词语均为模糊术语。由此看出,模糊的定义和解释,给了FDA很大的自由裁量空间[2]。
由于医药行业的专业性和科学性,国会和法院一般不会质疑FDA的法规。在绝大多数情况下都不会否定FDA的决定。即便对FDA有所质疑,也多集中于程序是否合法。这一方面显示出国会和法院对FDA的尊重,也从另一方面反映了FDA制定法规的科学信誉[3]。
通过对医疗产品和相关活动的审查、批准、拒绝和检查等手段,FDA实施了对整个医药行业的经营行为、研究方法,经营程序,甚至经营模式的指导、指挥和监管。
二、行政管理
法律,法规和指南形成了制药工业的“游戏规则”。为了确保企业遵守“游戏规则”,FDA需要对各项活动开展实施行政管理(administration)。
例如,在申办方提交IND后,FDA要求补充数据,批准或不批准研究性新药申请(IND)和新药上市申请(NDA),都属于行政管理的范畴;而发现数据造假,给予警告或处罚,则属于执法范畴。
《联邦食品药品和化妆品法案》规定,凡是掺假和错误标示就属于违法;对此,1938年的《联邦食品药品和化妆品法案》解释如下:凡是其组成、制造或标示不能充分满足法律和规范法规要求的物品,都属于掺假或标示错误。除了详细且具体地制定法规和解释法律要求后外,FDA还需要通过行政管理的方式引导和监管药物的研究者、生产者、销售者甚至临床医生遵循法律和法规。引导和监管(同意,批准,拒绝,停止等)是FDA行政管理的主要内容。
通过对医疗产品和相关活动的审查、批准、拒绝和检查等手段,FDA实施了对整个医药行业的经营行为、研究方法,经营程序,甚至经营模式的指导、指挥和监管。
就药物而言,FDA设置了如下行政管理措施:
审查研究性新药申请(IND):为保证药物的安全有效性,药物申办方必须在药物开发的过程中向FDA提交阶段性研究方案,例如,IND包括临床试验前报告,临床试验阶段性研究方案(PhaseⅠ,PhaseⅡ,PhaseⅢ),所有这些,要按照FDA的审查意见分步进行。
审查新药上市申请(NDA):从1938年《联邦食品药品和化妆品法案》开始,药品上市需要经过FDA的上市前 审查 和 批准(premarket approval)。FDA的权力第一次由事后追责,变成了事先审批。FDA对医药工业的主宰,从NDA的批准权开始。
药物生产质量管理规范(GMP):1962年,FDA对药物制造的全过程制定了详细的程序、标准和规则,并发布于21 CFR的 GMP条款中。这是 FDA首次对药品生产过程实施监管。这一举措将FDA的监管,从产品检测转化为监管生产过程。
药 物 标 识 法 规(labeling regulations):法规涵盖了药物的所有印刷物、电子出版物和各种媒体广告及促销媒介的内容;企业不得超标示、超范围做药物说明、广告或促销。
FDA有权力撤销已经批准的药物上市资格,有权力终止药物审查,有权力取消企业或个人的申请资格。
通过制定法规和行政管理,FDA实现了对药物从研发到使用的全生命周期管理。正如基因泰克前总裁所言:“什么是FDA,FDA就是拿着机关枪对着制药企业的那个家伙。如果你是一家制药企业,FDA就是你的老板,他拥有你的躯体和灵魂[2]。”
通过制定法规和行政管理,FDA实现了对药物从研发到使用的全生命周期管理。
三、执法与诉讼(enforcement and litigation)
按照美国法律,FDA没有独立起诉权(independent litigating authority)。也就是说,FDA不能单独扣押货物,不能单独做犯罪起诉,而是必须通过美国司法部、地方检察院、贸易委员或美国海关实施扣押或起诉。但是,根据相关法律,FDA对一些行政管理措施有独立的执法权。因此,FDA的执法权分为独立执法权和共同执法权。独立执法范围包括检查、召回、传讯等;共同执法范围包括:起诉、扣押、禁令、民事赔偿等。
1.检查(inspections)
在1906年《纯净食品药品法案》法案出台之前,有FDA之父之称的维莱博士一直想通过检查和鉴别阻止有害食品和药品进入市场。为此,1902年维莱招募了11人组成以身试毒小组。这是官方最早尝试的检查方法。1906年,法律赋予当时的农业部化学局有权查处掺假和标示错误的食品和药品,维莱组建了第一支由28人组成的执法队伍,其中就包括后来的FDA第四任局长Walter.G.Campbell。FDA现 在 拥 有 约3000人的检查队伍、数十家分支机构、逾150个实验室。这些机构和人员分布于美国20多个州和全球多个国家。图2是美国国会审计署2017年统计的FDA国内和海外药物相关的检查[4]。
2.警告(warning letters)
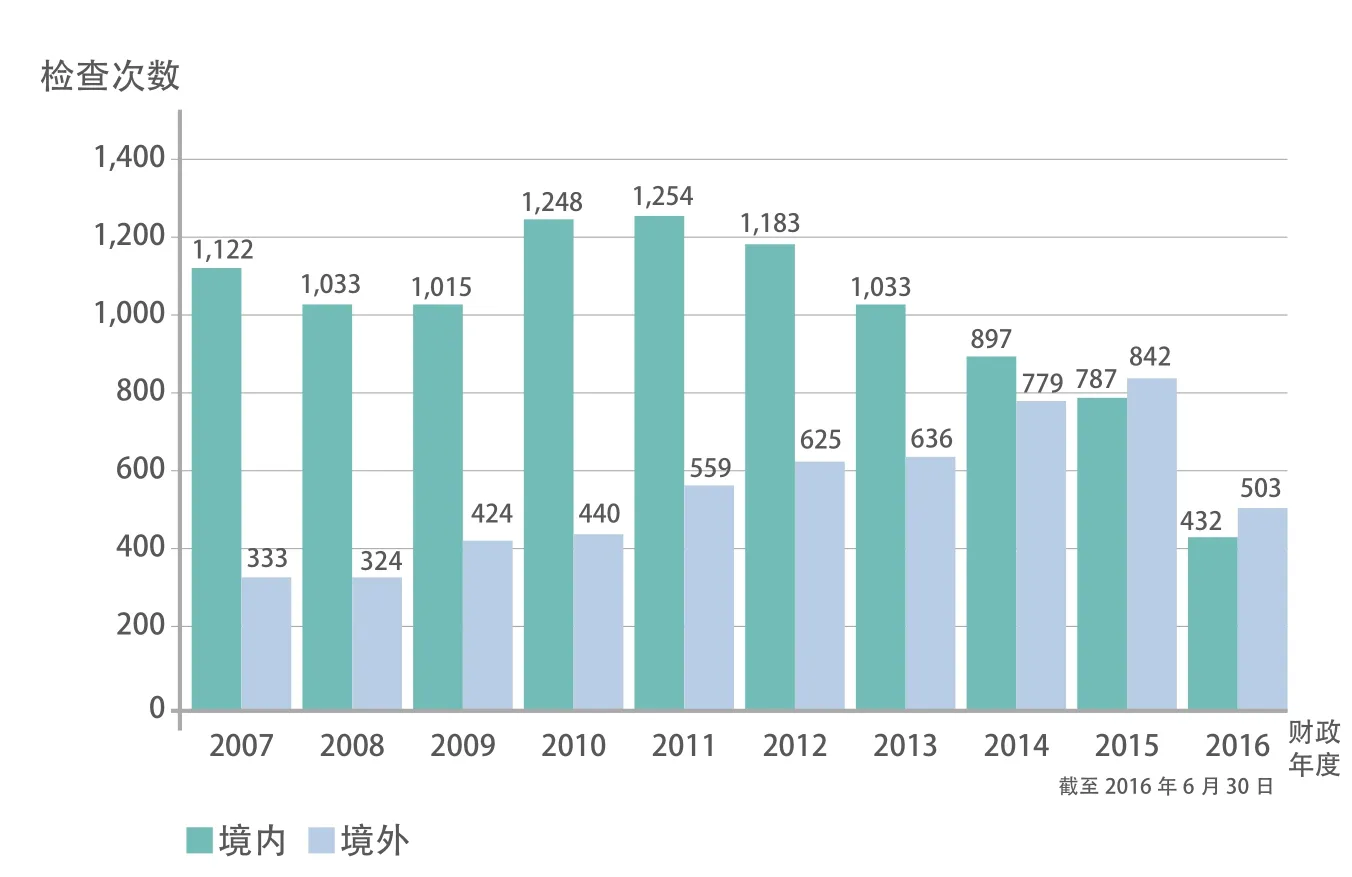
图2 2007至2016财政年度FDA对美国境内和境外药品检查的次数统计
FDA有两种形式的警告,一种叫作警告信,另一种叫作无标题信(untitledLetter)。警告信是在FDA认为企业或个人有违法违规行为时,FDA在采取进一步制裁行动前提出的警告,目的是希望对方主动纠正违法违规。如果不接受这样的警告或者不纠正错误,FDA将会实施制裁。2008至2017年由药品评价和研究中心(CDER)发出的警告信见图3[6]。
无标题信则是FDA认为有违法或违规的趋势,FDA给予提醒,但违法或违规程度还没有达到值得发警告信的地步[6]。
3.进口警告(import alerts)
根据法律,FDA可以将怀疑或举报的违法物品列入FDA进口警告或自动扣押名单,并通知海关实施扣押,这个程序称为进口警告。FDA以这样的方式扣押进口物品是对疑似违法嫌疑的执法。例如有人举报进口物品违反美国知识产权保护法,就可以展开的301调查。或者FDA对境外企业检查,认为其GMP或其他项目不合格时,这些FDA都可以发出进口警告。美国某些制药企业常用此手段打击国外竞争对手,阻止国外竞争产品进入美国。

图3 2008至2017年CDER发出的警告信数量统计
4.召回(recalls)
FDA有权要求企业或个人对已经流入市场的违法违规产品实施召回。召回分为强制召回和主动召回,多数召回为主动召回。除非产品的公共危害严重或者情况紧急,FDA一般不会对药品实施强制召回。因为一旦FDA发出药品的强制召回,法律就给被召回者提供面见FDA主要官员,进行非正式听证的机会[4]。多年的实践证明从维护市场安全考虑,召回比制裁更为有效。图4给出了从2008-2017年FDA公布的药品和相关召回事件的统计[6]:
5.扣 押(seizures) 和 禁 令(injunctions)
只要所管辖的违法违规的商品在进行跨州交易或,跨州运输,跨州储存,FDA都有权扣押,而对制造假药的原材料可以在任何时候都可以进行扣押。
地方法院可以发布禁止违法违规产品跨洲流动的命令,例如,禁止生产,禁止运输,禁止储存,销毁相关设施等。CDER在2008至2017年发出的相关扣押和禁令统计见图5。

图4 2008至2017年CDER公布的药品和相关召回的统计
6.刑事处罚(criminalpenalties)
对于严重违反法律和法规,且不改正错误,或者FDA发现故意欺诈导致损害公众健康时,FDA可以向美国司法部(DOJ)请求给予刑事处罚。FDA 设有专 门机构(office of criminal investigations,OCI)负责犯罪调查。针对个人的犯罪惩罚,起源于1943年的 United States v. Dotterweich 案例。该案例判决,企业拥有者或高级管理者要对违反《联邦食品药品化妆品法案》的行为承担法律责任。根据犯罪程度,分为轻罪和重罪,罚款从1000美元到25万美元,监禁半年到3年。不过FDA实施刑事处罚的案例比较少,不超过检查违法数目的1%。

图5 CDER在2008至2017年发出的相关扣押和禁令统计
7.民事赔偿
FDA直接处罚力度不大,而是尽量通过警告劝告违法者纠正错误。一旦被FDA判定为违法违规,可能会面临数额巨大的民事赔偿(1991至2015年美国制药企业受罚或赔偿额度见图6)。
四、权力的变化和对行业的影响

图6 1991年至2015年美国制药企业受罚或赔偿额度(单位:百万美元)
从上面的分析中可以看出,FDA的权力在过去的100多年里逐渐得以丰满。随着医学科学的进步和医药工业的发展,FDA的药物监管权力和结构也在不断地变化。国会和法院赋予FDA对药品监管的自由裁量权。1962年的《联邦食品药品化妆品法案》修正案颠覆性地改变了美国药物监管的理念和方式,也彻底改变了FDA的执法方式。1962年之前,FDA的执法主要以是以扣押和起诉为主的事后追责。从1970年开始,FDA的执法手段则变成了以引导、管理和告诫为主的事先监管和过程监管。正是FDA的柔性执法,才使得美国复杂的法律得以实施,也正是这些法律和执法的FDA改变了美国制药工业。表1统计了1940年至2010年FDA的药物监管执法情况[7]。
从1970年开始,FDA逐渐减少了犯罪起诉和扣押,更多地采用警告信和召回的方式。这一方面要归于医药商业对《联邦食品药品和化妆品法案》修正案的认可,更重要的是,这一期间国会和法院授予了FDA制定法规的权利。FDA正是通过撰写21 CFR和各种指南,通过对概念、术语及词汇的定义和解释,释放了FDA对监管对象的威慑力,执法方式也从事后检查和处罚,转变为事先审核批准和过程监管为主。从法律和经济学的角度,比起扣押和起诉,警告和召回劝阻违法违规更为经济和有效,更容易被监管对象接受。从另一个角度说明,权力的核心在于威慑、在于对权力恐惧。
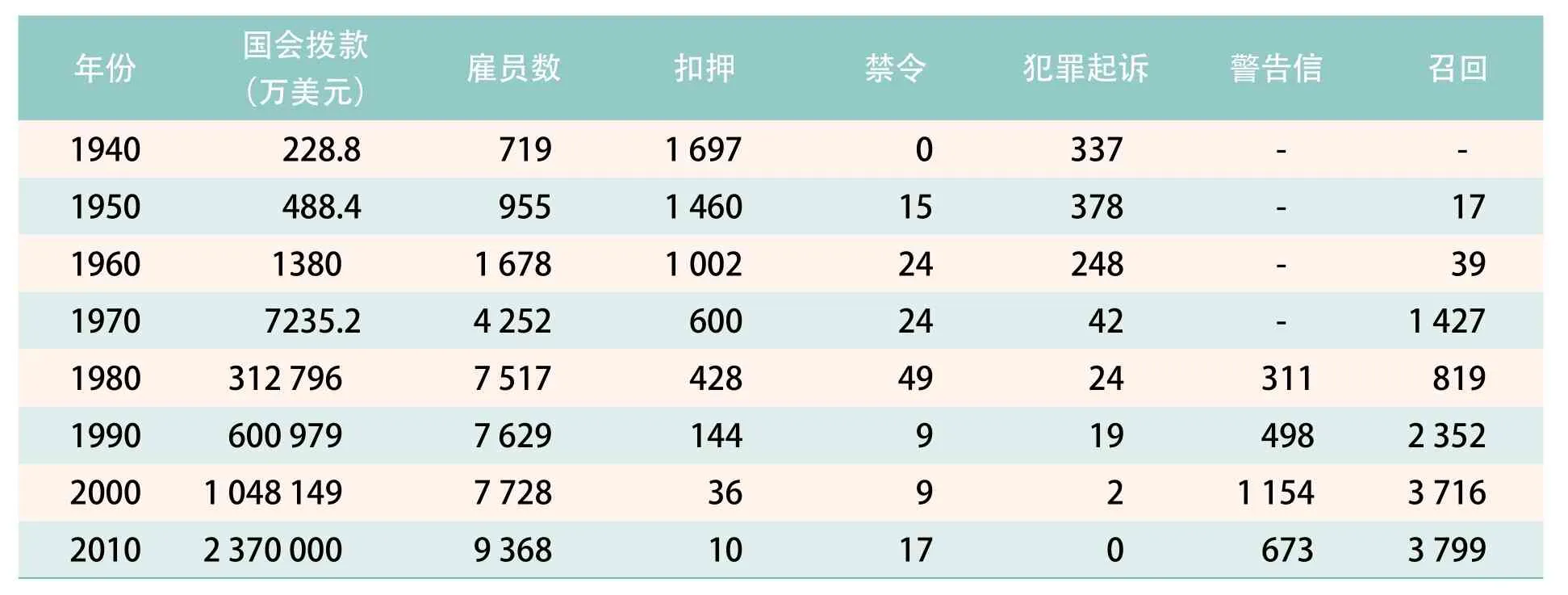
表1 FDA 历年国会拨款和执法统计
卡彭特教授在《威望和权力》一书的序言中把FDA的权力影响力归纳为7点[2]:定义成功与失败;限制广告和说明;管理药物制造;决定富有或贫穷;将企业或个人赶出市场;塑造医学和科学的概念;决定生命的生与死。
20世纪80年代末FDA批准了用于溶解血栓的第一个生物药TPA(组织型纤溶酶原激活剂)。1987年5月,FDA的专家委员会发布公告,要求TPA申办方基因泰克公司补充数据。发布消息时间是星期五,在股市收盘之后。结果周一华尔街一开盘,基因泰克股价大跌,瞬间从每股48.25美元跌到每股36.75美元,转眼间基因泰克的市值蒸发掉了9.28亿美元。5个月后,基因泰克提交了TPA的补充临床数据,FDA批准TPA上市。FDA要求补充数据的理由是:TPA剂量过大,会不会引起脑出血。TPA的血栓溶解作用对心脏病的治疗缺乏数据支持。
TPA例子说明了FDA的影响力:即决定成功与失败。如果FDA不要求补充数据,基因泰克和它的CEO,G.Kirk.Raab先生无疑是成功者;决定贫穷和富有,试想多少基因泰克的投资人为FDA的这一决定血本无归,而多少做空的人从中获利;决定术语和概念,TPA有没有效果,是不是溶解血栓,不是专家判定,而是由FDA判定;TPA是FDA批准的第一个大分子药物,大分子药物的剂量标准的制定者是FDA,而不是制药企业。

有人说,在美国医药经营和投资的成功标准,就是满足FDA的各种要求。这样的联系或许牵强,但无论如何,它反映出了制度赋予FDA的权力广泛和强大。G. Kirk. Raab 后来从基因泰克到雅培制药任CEO,他的机关枪比喻反复被人引用。在从多年与FDA的交往中,G.Kirk.Raab还是对FDA的工作态度和科学精神给出了很高评价:“有些事情我要澄清,FDA有着很多极富奉献精神,能力很强的人,在做着很重要的工作。有时我的意见与他们不一致,或者认为他们用时太长,但我知道,他们最终的目的还是为了美国公众的健康”。G. Kirk.Raab 感慨道,FDA不单单是民众健康的守卫者,还是科学证据的标准制定者,是科学概念的定义者[2]。这样的例子很多,华尔街的医药股票的投资者、医药商业的经营者、医药媒体和FDA可能每天都在上演着类似TPA的故事。
FDA对药物的否决权到底有多大影响?华尔街周刊统计了1989~2003年48个案例,以FDA驳回NDA或延期批准作为条件,与上市股票的价格相联系,其结论是:FDA的负面消息,使相关股票月平均跌幅为4.5%,负面消息当天的平均跌幅为15%,最大跌幅为87%[2],甚至个别公司会因为一个药品被FDA拒绝而破产。从商业的角度,尤其是从药物投资人的角度,药物研究的目的就是药物上市,而上市权力就在FDA的手中。

