酶解扇贝裙边制备复合氨基酸螯合钙的研究*
焦 奎 高 翔 于 佳 魏玉西 高 洁 张雪梅 王金梅 李钰金
酶解扇贝裙边制备复合氨基酸螯合钙的研究*
焦 奎1高 翔1于 佳1魏玉西1①高 洁1张雪梅1王金梅2李钰金2
(1. 青岛大学生命科学学院 青岛 266071;2. 荣成泰祥食品股份有限公司 荣成 264309)
扇贝裙边富含蛋白质、脂质等营养成分。为了高值化利用扇贝裙边,本研究选用中性蛋白酶、动物蛋白酶、风味蛋白酶、木瓜蛋白酶和酸性蛋白酶5种酶,以酶解液中游离氨基酸态氮为考察指标,对扇贝裙边进行酶解工艺条件探讨。首先,将5种酶制成复合蛋白酶进行正交实验,确定最佳酶解时间、温度、pH及加酶量,经检验,氨基酸转化率为77%;然后,通过实验确定CaCl2为最适钙源,以贝壳为原料,通过水飞法和酸法转化可制得贝壳源CaCl2。将扇贝裙边酶解液中复合氨基酸与来源于贝壳的钙螯合制备复合氨基酸螯合钙,以正交实验筛选出最佳螯合条件。经检验,该螯合反应螯合率达92%。
扇贝裙边;脱脂;酶解;氨基酸转化率;复合氨基酸螯合钙;螯合率
扇贝隶属珍珠贝目(Pterioida),广泛分布于世界各个海域(刘天红等, 2013)。我国现在扇贝年产量1400万t,占海水养殖动物总产量的22%。扇贝裙边是扇贝加工后的下脚料(包括扇贝边、性腺和肠腺等),由于受现有加工技术水平的限制,尚未得到大规模高值化利用,是亟待深度开发利用的重要海洋生物资源(魏玉西等, 2009)。扇贝裙边蛋白质含量高,对扇贝裙边进行酶解转变为复合氨基酸,可以提高其生物利用率及营养价值。目前,已有学者将扇贝裙边用于加工生产海鲜酱油、贝裙脆片和扇贝酱(严超等, 2016)等。关于蛋白质降解制备复合氨基酸的方法一般采用HCl水解法,但该法破坏某些氨基酸(如色氨酸),且HCl挥发性强,对设备的要求较高并容易污染环境(熊竹, 2016)。因此,利用蛋白酶酶解法制备复合氨基酸,被认为是一种更好的加工方式(桑亚新等, 2012;宋惠平等, 2015)。
Ca是人体必需的营养素,占人体体重的1.5%~2.2%,其中大部分(约99%)以Ca3(PO4)2的形式存在于骨中。中国人的饮食结构以植物性食物为主,不足以满足人体对Ca的需求,需要额外补充Ca (赵妍嫣等, 2011),而且对骨骼正常生长和体内生理调节来说,Ca是一种非常重要矿物元素,即使膳食Ca摄入量足够,但是由于Ca2+在肠道碱性环境内容易形成沉淀(Vavrusova, 2014),从而无法被小肠吸收,因此,生物利用率较低(Bao, 2008),且对胃有刺激作用(Straub, 2007)。
研究发现,蛋白质酶解得到的氨基酸具有较强的Ca2+结合活性,如鸡蛋壳粉氨基酸螯合钙(杜冰等, 2011)、罗非鱼骨粉氨基酸螯合钙(胡振珠等, 2010)、米渣蛋白氨基酸螯合钙(郭艳, 2006)以及文蛤氨基酸螯合钙(郑清等, 2009)等。这类补钙剂可以促进钙离子的生物利用度,因而Ca吸收率较高(丁媛媛等, 2017)。本研究旨在采用复合蛋白酶酶解法,将扇贝裙边蛋白质酶解成为游离氨基酸,探索最佳酶解条件,并进一步将酶解得到的氨基酸与无机钙离子进行螯合制备复合氨基酸螯合钙,以提高扇贝裙边利用附加值,为扇贝裙边作为功能性食品提供基础资料。
1 材料与方法
1.1 材料和试剂
实验用的扇贝裙边:栉孔扇贝,购自山东省青岛市沙子口;食品级酶制剂:中性蛋白酶、风味蛋白酶、木瓜蛋白酶、动物蛋白酶,购自广西南宁庞博生物工程有限公司;酸性蛋白酶,购自北京索莱宝生物科技公司。分析纯级试剂:石油醚,NaOH,EDTA-Na2自制复合酶制作过程:将中性蛋白酶、风味蛋白酶、木瓜蛋白酶、动物蛋白酶和酸性蛋白酶按等质量均匀混合后,放于4℃冰箱直至使用。
1.2 仪器与设备
索氏脂肪抽提器;PHS-3C pH计,上海雷磁仪器厂;GL-20G-II冷冻离心机,上海安亭科学仪器厂;真空冷冻干燥机,北京博医康实验仪器有限公司;SYKAM全自动氨基酸分析仪S-433D,SYKAM公司,德国;K9840全自动凯氏定氮仪,济南海能科技有限公司。
1.3 方法
1.3.1 贝壳为钙源的CaCl2制备 将扇贝壳刷洗干净,先以0.05 mol/L HCl浸泡2 h,以自来水充净后粉碎至60~80目,水飞法除去密度大的部分后烘干得钙源贝壳粉。取适量钙源贝壳粉,先加适量HCl使贝壳粉完全溶解,再继续加钙源贝壳粉至加入的贝壳粉不再溶解为止。过滤,将滤液经浓缩、酒精沉淀、烘干即得贝壳源氯化钙(魏玉西等, 2013)。
1.3.2 氨基酸态氮的测定 甲醛滴定法(杨佩荣, 2003);总氮(粗蛋白)的测定:凯氏定氮法(杨佩荣, 2003);pH测定:pH酸度计;钙离子的测定:EDTA滴定法(金其荣等, 1989);粗脂肪的测定:索氏抽提法(GB 5009.6-2016)。氨基酸分析方法:茚三酮法(GB 5009.124-2016)。
1.4 工艺优化实验
1.4.1 扇贝裙边的预处理 新鲜的扇贝裙边去杂后加入2倍体积蒸馏水煮沸5 min,沥干并于96℃干燥6 h,粉碎,过100目筛,即得均匀扇贝裙边粉末。
1.4.2 裙边粉末的脱脂 参考罗舜菁等(2017)、郑建明等(2017)方法并加适当改进。取3份、每份10 g扇贝裙边粉,各加入100 ml无水乙醇,60℃恒温水浴摇床6 min,抽滤,重复2次,过滤、晾干即得脱脂后的扇贝裙边粉末。脂含量测定结果取平均值。
1.4.3 酶解工艺流程 酶解工艺参魏玉西等(2009)并加适当改进。将脱脂后的扇贝裙边粉末加入20倍体积的蒸馏水,加入自制复合酶进行正交酶解实验。酶解完毕以后,立即升温至100℃灭酶5 min,冷却至室温以后,3500 r/min离心30 min,上清液即为酶解液。测定酶解液中氨基酸态氮含量并计算氨基酸转化率(杨佩荣, 2003)。
1.4.4 螯合钙制备工艺流程 首先对螯合钙的钙源的选择进行了优化,最后确定以贝壳粉制备的CaCl2为最优钙源,然后对螯合过程的时间、pH及温度因素进行了单因素和正交实验的优化,用EDTA滴定法测螯合率最终,确定了最优的螯合工艺。
1.4.5 氨基酸组成分析 分别取扇贝裙边粉末、酶解液和复合氨基酸螯合钙样品,采用SYKAM全自动氨基酸分析仪S-433D进行氨基酸组成分析(付萍等, 2016)。
2 结果与分析
2.1 脱脂效果分析
扇贝裙边脱脂结果见表1。经脱脂处理以后,扇贝裙边粉末脂肪含量明显降低,有利于下一步酶解,并且腥臭味消失,呈现出扇贝固有的鲜甜味。
2.2 正交实验结果
正交实验选取时间、加酶量、温度和pH 4个因素(刘淇等, 2013),通过预实验确定正交实验的因素和水平,进而进行正交实验。自制蛋白酶正交设计因素与水平排列见表2,正交实验结果见表3。总体来说,酶解pH的影响最主要,其次是酶解温度,而酶解时间和加酶量影响较小,实验结果与魏玉西等(2009)的研究结果相吻合。根据正交实验的结果,最后确定最佳酶解条件为:添加扇贝裙边粉末量0.15%()自制复合蛋白酶,介质pH=8,温度65℃,酶解7 h后在100℃水浴加热10 min灭酶,即得到复合氨基酸酶解液,氨基酸转化率达77%。
表1 脱脂次数与样品脂肪含量

Tab.1 Degreasing times and sample fat content (%)
表2 蛋白酶正交设计因素与水平排列

Tab.2 Protease orthogonal experimental design
表3 蛋白酶正交实验方案及结果分析

Tab.3 Orthogonal experiment design and results
2.3 螯合因素分析
2.3.1 钙源的选择 不同钙源参与的鳌合反应螯合率见表4。由表4可见,5种不同钙源对螯合率的影响差别较大,其中CaCl2参与螯合反应螯合率最高(达89%)。因此,本研究螯合反应选用CaCl2为钙源。这与文献(甘林火等, 2008)所报道的结果一致。同时为增加贝可利用度,选用贝壳为原料制备CaCl2。将扇贝壳刷洗干净,先以0.05 mol/L HCl浸泡2 h,以自来水充净后粉碎至60~80目,水飞法除去密度大的部分后,烘干得钙源贝壳粉。取适量钙源贝壳粉,先加适量HCl使贝壳粉完全溶解,再继续加钙源贝壳粉至加入的贝壳粉不再溶解为止。过滤,将滤液经浓缩、酒精沉淀、烘干即得贝壳源CaCl2。经实验证明,经该方法制备的CaCl2的鳌合率,与分析纯级CaCl2效果相同。因此,以下鳌合实验均使用贝壳CaCl2为钙源。
表4 钙离子与螯合率的关系

Tab.4 Relationship between calcium and chelation rate (%)
2.3.2 螯合反应单因素实验结果 鳌合反应单因素实验结果见图1、图2和图3。可见,鳌合过程的最佳温度为40℃,最佳时间为40 min,超过40 min以后,鳌合率下降,最佳pH为9。
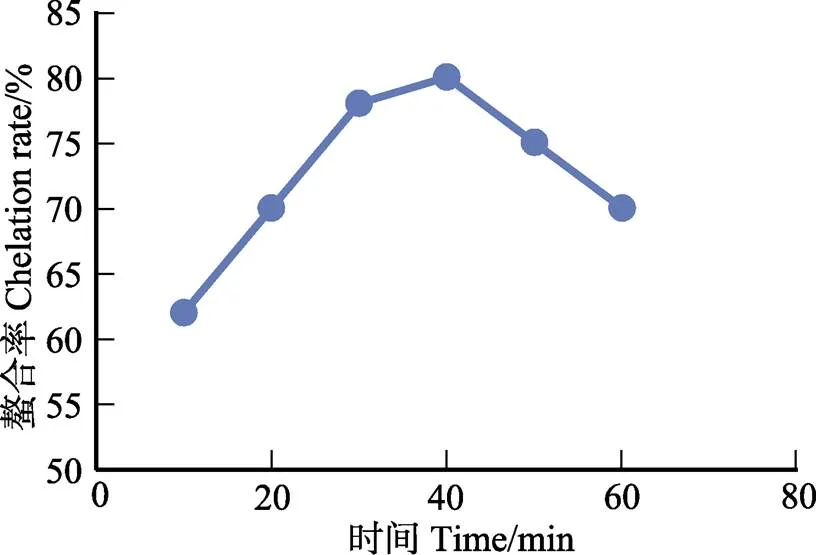
图1 反应时间对螯合率的影响
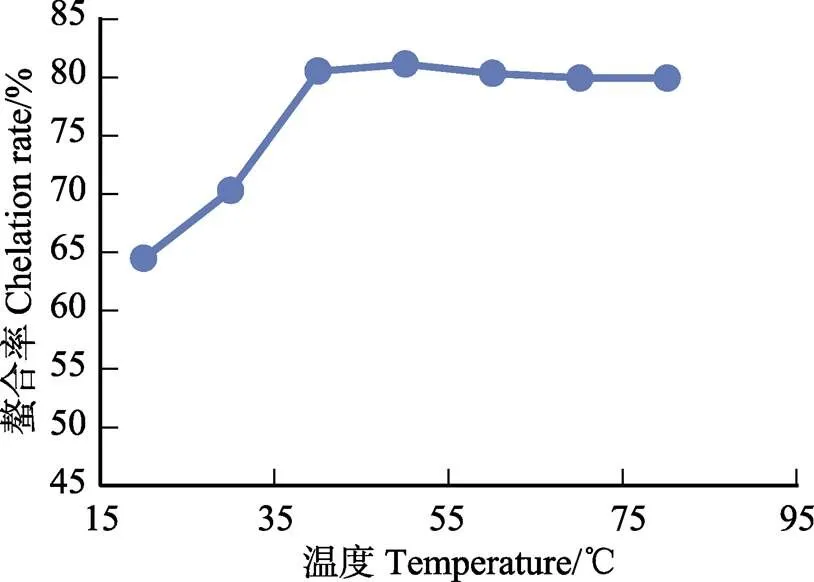
图2 温度对螯合率的影响

图3 pH对螯合率的影响
2.3.3 螯合反应正交实验结果 螯合反应正交设计因素与水平排列见表5,正交实验方案及结果见 表6。由表6可见,反应时间和介质pH对螯合率的影响最主要,而温度影响最小。具体地说,最佳螯合反应条件:反应温度为40℃,反应时间为40 min,介质pH为9。在此最佳工艺条件下进行螯合反应,螯合率可达92%。
2.4 氨基酸组成分析
扇贝裙边粉末中含有丰富的氨基酸,且含有7种人体必需氨基酸(魏玉西等, 2009)。本研究就扇贝裙边粉末、扇贝裙边粉末酶解液以及复合氨基酸螯合钙进行了氨基酸组成及含量测定,结果见表7。由表7可见,在扇贝裙边粉末酶解液中,末中含有较多谷氨酸和天冬氨酸,因此酶解液有浓郁的鲜味。选用贝壳制备的CaCl2为钙源,进一步提升了扇贝的利用度,降低了生产成本。由于酸性氨基酸(天冬氨酸和谷氨酸)更容易与钙离子进行螯合(Liu, 2013),在复合氨基酸螯合钙产品中,酸性氨基酸的含量相对于酶解液进一步提升,使天冬氨酸由10.89%上升到22.23%,谷氨酸由20.32%上升到33.87% ,因而使得复合氨基酸螯合钙产品有较显著的鲜味;但对于碱性氨基酸,如精氨酸、赖氨酸和组氨酸来说,因它们不易与钙离子进行螯合,所以在复合氨基酸螯合钙产品中其含量均有所下降;对中性氨基酸来说,在复合氨基酸螯合钙产品中的含量均无较大改变。
表5 螯合反应正交实验设计因素与水平排列

Tab.5 Factors and levels arrangement of chelation orthogonal experimental design
表6 螯合反应正交实验结果
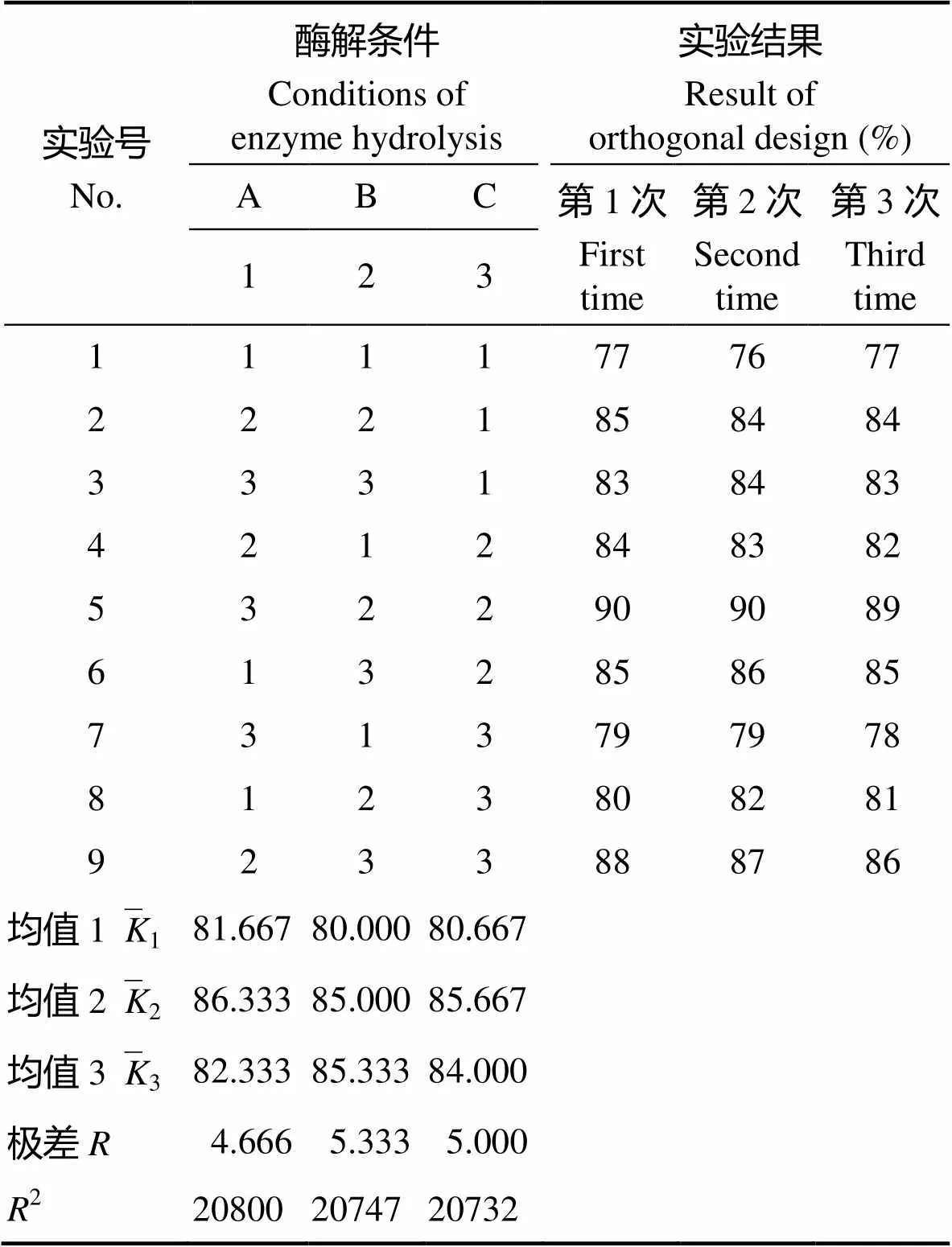
Tab.6 Chelating reaction orthogonal experimental design and results
表7 氨基酸组分及含量分析
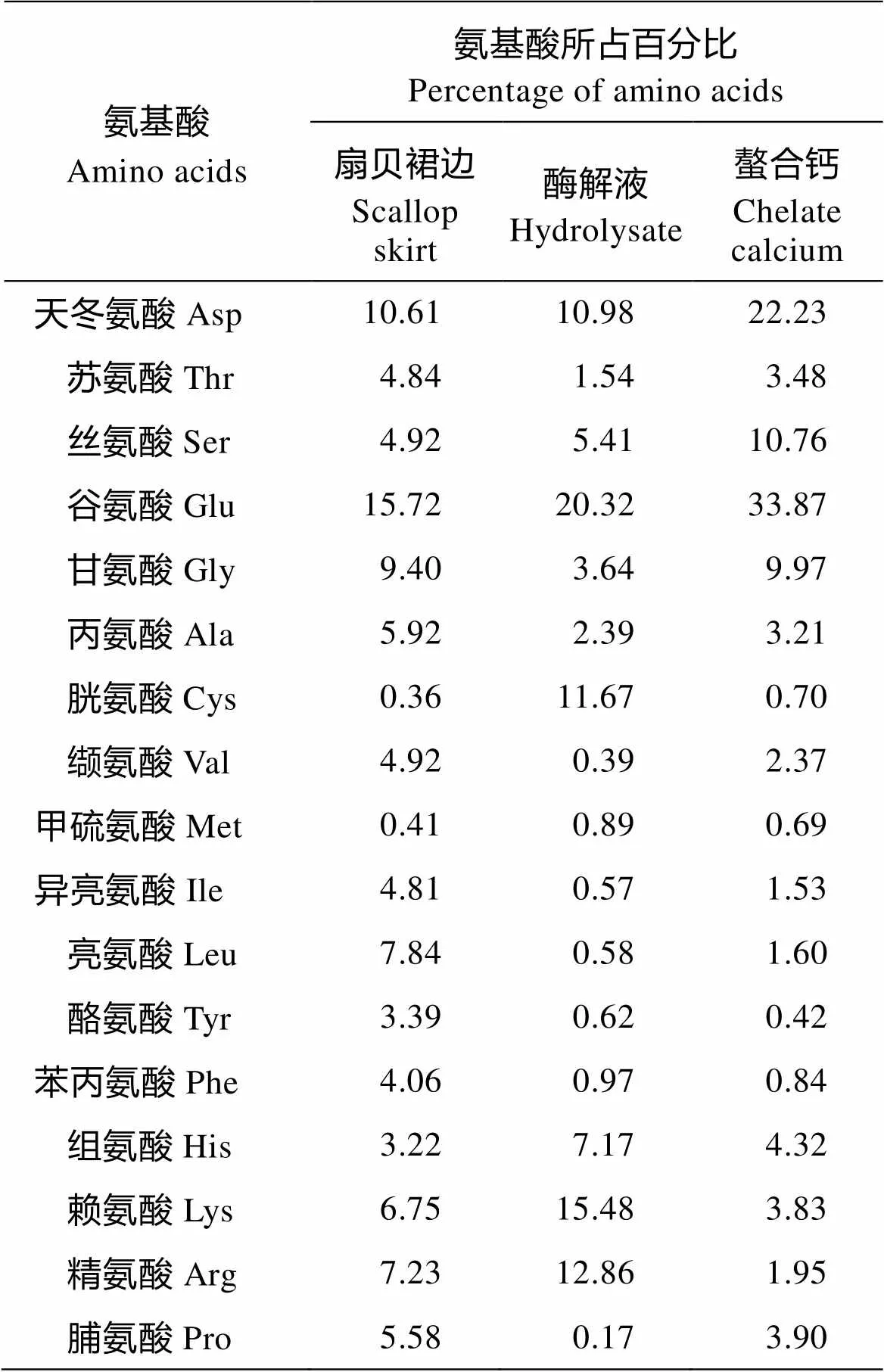
Tab.7 Analysis of amino acid composition and content
注:色氨酸未测
Note: Tryptophan is not detected
3 结论
本研究采用多种蛋白酶,对扇贝裙边进行复合蛋白酶酶解,采用正交实验设计进行优化酶解条件,使最终氨基酸转化率达到77%,较目前所报道的酶解条件(Choi, 2012)有更高的氨基酸转化率,且复合氨基酸中含有较多人体必需氨基酸。因为氨基酸的羧基存在钙离子结合能力(Bao, 2008),在酶解之后将氨基酸酶解液与来源于贝壳的无机钙离子进行螯合,制备复合氨基酸螯合钙,通过优化螯合反应条件,最终使螯合率达到92%,该产品可以提高人体对钙离子的生物利用率(Hou, 2015; Jeon2010)。因此,本研究结果不仅高值化利用扇贝裙边,将其中氨基酸游离出来并转化为复合氨基酸螯合钙,而且利用贝壳将其中钙质作为复合氨基酸螯合钙的钙源,将扇贝加工废弃物变废为宝,生产出的复合氨基酸螯合钙不仅具有补钙功能,而且具有鲜美的味感,可以作为补钙剂或功能性调味品食用。这对提高扇贝加工下角料的附加值,同时也为我们高值化利用其他水产加工废弃物、减少环境污染,促进蓝色经济的可持续健康发展提供了新的思路和方法。
Bao XL, Lü Y, Yang BC,. A Study of the soluble complexes formed during calcium binding by soybean protein hydrolysates. Journal of Food Science, 2008, 73(3): 117–121
Choi DW, Lee JH, Chun HH,. Isolation of a calcium- binding peptide from bovine serum protein hydrolysates. Food Science and Biotechnology, 2012, 21(6): 1663–1667
Ding YY, Wang L, Zhang XX,. Optimized preparation and structural characterization of calcium-chelating polypeptides from wheat germ protein hydrolysate. Food Science, 2017, 38(10): 215–221 [丁媛媛, 王莉, 张新霞, 等. 麦胚多肽–钙螯合物制备工艺优化及其结构表征. 食品科学, 2017, 38(10): 215–221]
Du B, Cai XK, Xie YC,. Study on preparation technology of
calcium amino acid chelate from eggshell power. Science and Technology of Food Industry, 2011, 32(4): 287–289 [杜冰, 蔡巽楷, 谢伊澄, 等. 蛋壳粉制备氨基酸螯合钙工艺优化. 食品工业科技, 2011, 32(4): 287–289]
Fu P, Lü JJ, Liu P,. Effects of different salinities on the free amino acids composition in the gill of. Progress in Fishery Sciences, 2016, 37(5): 122–126 [付萍, 吕建建, 刘萍, 等. 盐度胁迫对三疣梭子蟹()鳃中游离氨基酸含量的影响. 渔业科学进展, 2016, 37(5):122–126]
Gan LH, Weng LJ, Deng AH. Progress in preparation of calcium acid chelate. Amino Acids and Biotic Resources, 2008, 30(1): 44–46 [甘林火, 翁连进, 邓爱华. 制备氨基酸螯合钙的研究进展. 氨基酸和生物资源, 2008, 30(1): 44–46]
Guo Y. Hydrolysis of rice residue protein and synthesis of complex amino acid with calcium. Master′s Thesis of Sichuan University, 2006, 1–73 [郭艳. 水解米渣蛋白及制备氨基酸螯合钙的工艺研究. 四川大学硕士研究生学位论文, 2006, 1–73]
Hou T, Wang C, Ma ZL,. Desalted duck egg white peptides: Promotion of calcium uptake and structure characterization. Journal of Agricultural and Food Chemistry,2015, 63(37): 8170–8176
Hu ZZ, Yang XQ, Ma HX,. Preparation and antioxidant activity evaluation of amino acid chelated calcium from tilapia scraps. Food Science, 2010, 31(20): 141–145 [胡振珠, 杨贤庆, 马海霞, 等. 罗非鱼骨粉制备氨基酸螯合钙及其抗氧化性研究. 食品科学, 2010, 31(20): 141–145]
Jeon SJ, Lee JH, Song KB. Isolation of a calcium-binding peptide from chlorella protein hydrolysates. Journal of Food Science and Nutrition2010, 15(4): 282–286
Jin QR, Zhang JM, Xu Q. Organic acid fermentation technology. China Light Industry Press, 1989 [金其荣, 张继民, 徐勤. 有机酸发酵工艺学. 中国轻工业出版社, 1989]
Luo SJ, Geng Q, Yan XY,. Structural and functional properties of rice dreg protein prepared by different degreasing methods. Food Science, 2017, 38(5): 202–207 [罗舜菁, 耿勤, 颜小燕, 等. 不同脱脂条件下米渣蛋白的结构及功能性质. 食品科学, 2017, 38(5): 202–207]
Liu Q, Xie S, Zhao L,. Antimicrobial activity of hydrolysates from. Progress in Fishery Sciences, 2013, 34(2): 109–113 [刘淇, 谢沙, 赵玲, 等. 菲律宾蛤仔酶解产物的抑菌活性. 渔业科学进展, 2013, 34(2): 109–113]
Liu TH, Yu XQ, Sun FX,. Accumulation and depuration of mercury and MeHg in the tissue of. Progress in Fisheries Science, 2013, 34(5): 119–128 [刘天红, 于晓清, 孙福新, 等. 汞及甲基汞在栉孔扇贝全组织内的积累与净化. 渔业科学进展, 2013, 34(5):119–128]
Straub DA. Calcium supplementation in clinical practice: A review of forms, doses, and indications. Nutrition in Clinical Practice, 2007, 22(3): 286–296
Sang YX, Wang XH, Wang S,. Research on the process optimization of scallop skirt enzymatic hydrolysis and its amino acid analysis. Journal of Chinese Institute of Food Science and Technology, 2012, 12(8): 78–86 [桑亚新, 王向红, 王苏, 等. 扇贝裙边酶解工艺优化及其氨基酸分析研究. 中国食品学报, 2012, 12(8): 78–86]
Song HP, Yu J, Li S,. The antibacterial activity of peptides from. Progress in Fishery Sciences, 36(2): 140–145 [宋惠平, 于佳, 李钐, 等. 条斑紫菜蛋白酶解多肽的抑菌活性. 渔业科学进展, 2015, 36(2): 140–145]
Vavrusova M, Skibsted LH. Calcium nutrition. Bioavailability and fortification. LWT-Food Science and Technology2014, 59(2): 1198–1204
Wei YX, Cui YQ, Wang WX,. Preparation technology of calcium bis-L-calcium-pyroglutamate from clam shell. Chinese Journal of Marine Drugs, 2013, 32(6): 83–86 [魏玉西, 崔育倩, 王文秀, 等. 以蛤蜊壳为钙源的L-焦谷氨酸钙制备工艺. 中国海洋药物, 2013, 32(6): 83–86]
Wei YX, Yin BZ, Liu Q,. Study on the preparation of amino acid nutrition powder with scallop skirt. Progress in Fishery Sciences, 2009, 30(3): 112–116 [魏玉西, 殷邦忠, 刘淇, 等. 扇贝裙边氨基酸营养粉的制备工艺研究. 渔业科学进展, 2009, 30(3): 112–116]
Xiong Z. Study on preparation of complex amino acid chelated calcium from shrimp powder. Agricultural Techonology Service, 2016, 33(5): 107–107 [熊竹. 虾粉制备复合氨基酸螯合钙工艺研究. 农技服务, 2016, 33(5): 107–107]
Yan C, Mu JL, Wang J,. Fermentation technology of scallop bean paste. Food Science and Technology, 2016, 41(12): 245–249 [严超, 牟建楼, 王颉, 等. 扇贝豆酱发酵工艺条件的研究. 食品科技, 2016, 41(12): 245–249]
Yang PR. Development of compound amino acids. Science and Technology of Food Industry, 2003, 24 (10): 114–115 [杨佩荣. 复合氨基酸的研制. 食品工业科技, 2003, 24(10): 114–115]
Zhao YY, Hu LL, Jiang ST. Optimum conditions of producing collagen polypeptide chelated Ca using pig bone. Transactions of the Chinese Society of Agricultural Eneineering, 2011, 27(S2): 277–281 [赵妍嫣, 胡林林, 姜绍通. 猪骨粉制备胶原多肽螯合钙工艺优化. 农业工程学报,2011, 27 (s2): 277–281]
Zheng JM, Yan JL, Chen SQ,. Effects of dietary skimmed krill meal on the growth, non-specific immunity and serum physiological metabolism indices of juvenile spotted halibut (). Progress in Fishery Sciences, 2017, 38(5) : 107–113 [郑建明, 严俊丽, 陈四清, 等. 脱脂磷虾粉对圆斑星鲽()幼鱼生长、非特异性免疫力和血清生理代谢指标的影响. 渔业科学进展, 2017, 38(5):107–113]
Zheng Q, Wang YQ. Preparation of composite amino acids calcium copper from shell ofLinnaeus. Anhui Chemical Industry, 2009, 35(1): 25–28 [郑清,王玉琴. 利用文蛤壳制备复合氨基酸螯合钙. 安徽化工, 2009, 35(1): 25–28]
Study of the Preparation of Compound Amino Acid-Chelated Calcium by Protease Hydrolysis of Scallop Skirts
JIAO Kui1, GAO Xiang1, YU Jia1, WEI Yuxi1①, GAO Jie1, ZHANG Xuemei1, WANG Jinmei2, LI Yujin2
(1. School of Life Sciences, Qiingdao University, Qingdao 266071; 2. Rongcheng Taixiang Food Co. Ltd, Rongcheng 264309)
Scallop skirts are by-products of scallop processing that are rich in nutrients such as proteins and lipids. Owing to the limitations of the existing processing technology, they have not been used on a large scale and are not currently of much value. In this study, to effectively utilize the scallop skirt, neutral protease, animal-complex protease, flavor protease, papain, and acidic proteinase were used to hydrolyze the scallop skirt. The free amino acid nitrogen content in the hydrolysate was used as an indicator for optimized reaction conditions. First, alcohol was used to degrease the scallop skirt, which increased the degree of enzymatic hydrolysis. Subsequently, single-factor experiments were performed on five enzymes to select the optimize enzymatic hydrolysis time, temperature, pH, and enzyme dosage. Subsequently, orthogonal experiments were performed to determine the optimum hydrolysis conditions for the five enzymes. The results showed that the amino acid conversion rate of the hydrolysate prepared under the optimum hydrolysis conditions was as high as 77%. In previous studies, calcium chloride was determined to be the most suitable calcium source. The scallop shell was used as a raw material to obtain calcium chloride by acid treatment and water flying, and then calcium chloride was mixed with compound amino acids in the hydrolysate to prepare complex amino acid-chelated calcium. The calcium ion content in the chelated calcium was chosen as an index; subsequently, single factor experiments were performed to determine the time, temperature, and pH of the chelation process. The optimum chelating conditions were screened by an orthogonal experiment. A chelation rate of up to 92% was obtained in the final products. The compound amino acid-chelated calcium not only functions as a calcium supplement, but also has a delicious taste; it can be used as a calcium supplement or functional condiment. Our findings will assist in achieving additional value from scallop-processing waste, and also provide us with novel insights and methods for high-value utilization of other aquatic processing waste.
Scallop skirts; Degrease; Enzymatic hydrolysis; Amino acids conversion rate; Amino acid chelated calcium; Chelation rate
WEI Yuxi, E-mail: yuxiw729@163.com
* 山东省重点研发计划(重大关键技术)项目(2016ZDJS06A01)和青岛市民生科技计划项目(17-3-3-68-nsh)共同资助[This work was supported by Shandong Province Key Research and Development Project (2016ZDJS06A01), and Qingdao People's Livelihood Technology Project (17-3-3-68-nsh)]. 焦 奎,E-mail: 312596995@qq.com
魏玉西,E-mail: yuxiw729@163.com
2018-03-24,
2018-06-02
S985.3
A
2095-9869(2019)04-0178-07
10.19663/j.issn2095-9869.20180324001
焦奎, 高翔, 于佳, 魏玉西, 高洁, 张雪梅, 王金梅, 李钰金. 酶解扇贝裙边制备复合氨基酸螯合钙的研究. 渔业科学进展, 2019, 40(4): 178–184
Jiao K, Gao X, Yu J, Wei YX, Gao J, Zhang XM, Wang JM, Li YJ. Study of the preparation of compound amino acid-chelated calcium by protease hydrolysis of scallop skirts.Progress in Fishery Sciences, 2019, 40(4): 178–184
(编辑 陈辉)

