蚕丝力学性能的研究进展
邹邦兴, 肖文福, 董思材, 张友洪, 周安莲, 肖金树, 郭俊英
(四川省农业科学院 蚕业研究所, 四川 南充 637000)
家蚕是鳞翅目昆虫的代表,也是主要的经济昆虫之一,同时也是用作功能基因分析的重要鳞翅目模式昆虫,在我国已有数千年的驯养历史,传统上以养蚕缫丝织绸为主要用途。因其蚕丝具有轻盈、光滑、柔美的特点为其赢得了“纤维皇后”的美誉。然而在蚕丝制品的开发研究中,蚕丝的机械性能严重限制了蚕丝制品的高端开发与应用,与蜘蛛丝相比,蚕丝的拉伸强度、韧性性能较差,主要表现在蚕丝易断、韧性不够等。为了克服这一缺陷,广大学者利用转基因技术进行了蚕丝机械性能研究,笔者就目前基于基因编辑在蚕丝力学性能上的研究及进展进行概述,并对存在的问题和发展趋势进行讨论。
当前蚕桑行业每况愈下,传统的栽桑养蚕缫丝织绸模式已不能满足行业发展需求,为拓展蚕桑行业发展,国内外学者利用蚕丝的生物学特性,开发蚕丝新功能、新用途,进而促进蚕业繁荣发展。然而蚕丝作为纺织材料在应用方面存在断裂强度低、韧性弱等力学性能方面的不足,因此严重限制了蚕丝的高端应用和开发。随着转基因技术的发展,目前已经成功将控制蜘蛛丝的基因导入家蚕,并获得了一系列机械性能强于传统蚕丝的转基因素材。但到目前为止,各研究机构所获得的成果仅限于试验阶段,生产上仍没有力学性能得到改良的蚕品种,蚕丝用途拓展仍处原地。因此,总结了近10年来蚕丝改良的研究方法及进展,为在今后蚕丝改良方面的研究提供借鉴与参考。
1 基因编辑技术的发展
基因组编辑(Genome Editing)技术作为生命科学技术史发展中的一项突破性技术,实现了针对基因的精准修改,包括基因的插入、缺失或替换等[1]。利用基因组编辑技术可以在基因功能分析和疾病基因治疗研究方面具有广阔应用前景。目前实验室所用的基因编辑技术主要有第一代基因编辑工具锌指核酸酶(zinc finger nuclease,ZFN)、第二代基因编辑工具类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,TALEN)及第三代基因编辑工具成簇规律间隔短回文重复序列CRISPR (clusteredregularly interspaced short palindromic repeats,CRISPR)相关核酸酶Cas9(crisprassociatednuclease Cas9)系统(即CRISPR/Cas9 系统)的3种不同基因编辑工具。其中以CRISPR/Cas9为代表的基因编辑技术目前在全球各大实验室得到广泛应用。
1.1 第一代基因组编辑技术
锌指核酸酶是一种由锌指模块和Fokl核酸酶结构域组成的嵌合蛋白[2-3]。锌指是普遍存在于转录因子中小的天然DNA结构域,DNA识别域是由一系列Cys2-His2锌指蛋白(zinc-fingers)串联组成(一般3~4个),1个锌指可以特异识别3个碱基;锌指核酸内切酶的特点是Folk需要形成1个二聚体才具有切割DNA双链的酶活性[4]。自从锌指核酸酶首次在果蝇中成功敲除yellow基因后,先后在斑马鱼、小鼠、猪、家蚕、拟南芥[5-9]等生物体上进行基因修饰,但是编辑效率较低,而且耗时较长,成本较高。
1.2 第二代基因编辑技术
类转录激活因子核酸酶是来源于植物病原菌黄单胞杆菌的分泌蛋白,最先由Adam J.Bogdanove团队和Ulla Bonas[10-11]团队发现其可以和DNA作用。其后的研究解析了TALEN的DNA结合域的重复可变双氨基酸残基(repeat variable diresidues,RVDs)和靶DNA的核苷酸之间有某种一一对应的关系。在发现了TALE的密码后,研究者将TALE蛋白与核酸酶组合形成了第二代基因编辑工具TALENS。该技术出现后,很快在斑马鱼、小鼠、果蝇、昆虫[12-15]等动物上成功进行基因修饰。和ZFN相比,TALEN从原来识别3个碱基变成了识别1个碱基,增加了基因编辑的难度,但是后者在设计上比前者简单,不需耗费大量时间,在靶位点识别上,TALEN的选择范围更广,特异能力更强,靶效率更高。但是这2种方法都是用蛋白质识别目的基因的核酸序列,因此在使用时工作量较大,且编辑效率不高。
1.3 第三代基因编辑技术
CRISPR/Cas最先由NAKATA等[16]在大肠杆菌的iap基因下游发现的1个成簇的29 bp重复序列,随后在古细菌中也陆续发现,这些重复序列后来被称为间隔序列(spacer)DNA的非重复短序列。2002年JANSEN和MOJICA将这类短重复序列统称为CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats,CRISPR)。CRISPR在不同物种间其位点数量和包含的重复序列存在差异[17]。后来,研究者发现与CRISPR相关的4个蛋白基因(Cas)[18],此后在广大科学家[19-25]的努力下,先后在葡萄球菌、嗜热链球菌的CRISPR上进行试验,发现CRISPR/Cas系统中的Cas9蛋白被gRNA引导切割DNA,这些重要发现,为深入研究CRISPR/Cas系统的作用机制打下了基础。
与ZFN和TALEN相比,CRISPR/Cas系统介导的基因组靶向编辑在原理上是全新的,其靶位点识别由与靶标序列互补的短RNA决定。目前最为常用的CRISPR/Cas系统是仅在细菌基因组中发现的Ⅱ型CRISPR/Cas系统,其工作原理为将CRISPR元件转录生成的CRISPR RNA (crRNA ) 和transactivating-CRISPR RNA (tracrRNA) 这2个非编码RNA改造成一种单导向RNA( single-guideRNA,sgRNA),sgRNA能够引导Cas9 蛋白结合并切割靶位点DNA序列[26-27]。
2 基因编辑在家蚕中的应用
随着基因编辑技术的不断发展,家蚕作为模式生物,具有饲养周期短、各阶段形态特征明显的优点被国内外广大学者作为基因编辑技术应用的首选。自夏庆友[28-29]将家蚕全基因组测序及精细图谱构建以来,蚕丝生物反应器的开发迎来井喷时代,如蚕丝合成与分泌机制研究[30]、变态发育的激素调控研究[31]、性别调控研究[32]以及转基因家蚕丝腺生物反应器开发等领域[33-34]。与此同时MA[35]和WANG[36]分别利用 TALEN和CRISPR/Cas9系统介导的基因组靶向编辑技术成功实现了对BmBLOS2 基因的定点敲除,并获得了阳性纯合突变体家蚕。随后,来自日本国立农业生物资源研究所、日本信州大学纤维学部以及浙江大学动物科学学院的研究人员,相继利用基于TALEN或CRISPR/Cas9系统的基因组靶向编辑技术实现了对家蚕Bm-re[37]、BmFibH[34]和Bm-ok[38]等内源基因的定点敲除。WANG[39]和TAKASU等[40]分别用Golden Gate 组装体系建立了一套适用于家蚕的TALE 核苷酸骨架组装的方法,LIU等[41]将sgRNA和Cas9核酸酶表达载体质粒混合导入体外培养家蚕细胞,实现了对家蚕细胞基因组靶位点的精确定点敲除与染色体结构变异操作,并证实CRISPR/Cas9系统具有在家蚕细胞和胚胎中介导实现多基因敲除的潜力。自此,分别由ZFN,TALEN和CRISPPR/Cas9系统这3类介导的基因组靶向编辑技术均已经在家蚕中成功建立并取得应用。
近年来随着蚕业发展中面临的问题:土地成本增加、青壮年劳力外出、产业结构调整、行业不稳定等因素制约,传统蚕桑经营模式已不能满足产业发展。为了产业转型升级,将功能单一化的蚕桑业转为多元化发展,桑果综合利用、桑叶茶开发、蛋白饲料桑、蚕蛹粉、蚕丝用途研发等蚕桑副产业应运而生,其中围绕蚕丝新用途的研发较为热门,根据其生物学特性,转基因蚕丝不断在医学、美容、军工上取得进展,研究者们成功研制了一批转基因生物学茧丝材料,主要成果有:TAN[42]等应用转录激活因子效应核酸酶介导的同源定向修复,用蜘蛛Nephila clavipes中主要的壶腹蛛丝蛋白-1基因(MaSp1)取代家蚕丝素重链基因(FibH),成功用1.6 kb的MaSp1基因替换了家蚕丝素重链中16 kb的内源FibH基因,构建了表达蜘蛛丝纤维的转基因蚕,并在茧壳中实现了高达35.2%的嵌合MaSp1蛋白量(图1)。WANG等[43]利用家蚕丝腺多基因生物反应器系统成功将人碱性成纤维细胞生长因子和人转移细胞生长因子2种重组蛋白同时表达至蚕丝纤维中,建立获得可以稳定遗传的新型蚕丝家蚕素材品系,以实现双生长因子新型蚕丝的高效低成本生产,对拓展蚕丝在组织工程和再生医学领域中的应用具有重要促进作用。ZHANG等[44]利用蚕丝具有和人类皮肤高度亲和的特点,开发了一种丝素蛋白膜,有效地减少了平均伤口愈合时间,具有更好的皮肤再生,该研究提供了系统的临床前和临床证据,证明丝素蛋白膜促进伤口愈合,从而为其在临床中应用皮肤修复和再生奠定了基础。YERRA[45]研究表明饲喂亚精胺(Spd)可显著增加纤维长度,进而影响蚕茧的结构,机械和分子水平的丝质量,这可以在丝绸生物材料生产中被利用。与此相应CHENG等[46]通过在家蚕日粮中添加不同物质,发现酪氨酸和丝素蛋白氨基酸显著增加丝纤维中的钾含量,诱导α-螺旋和无规卷曲转变为β-折叠结构,从而产生更高的结晶度和更好的机械性能(图2)。该发现提供了绿色且有效的方法,用于大规模生产具有高结晶度的机械增强的丝纤维。WANG等[47-48]研究表明,利用转基因蚕产生的丝具有良好的生物相容性、生物降解性和自组装能力,为生物医学应用提供良好材料。 KAWABATA 等[49]开发丝-弹性蛋白聚合物,这种新型材料具有从液体到凝胶的能力,可以应用于难用水溶液处理的各种伤口。笔者将羊毛角蛋白基因转入到家蚕丝腺中,获得阳性个体,但经力学性能检测,其性能并未提高,且比对照低,其原因可能是外源基因难在丝腺内完整表达。这些研究均为蚕丝的利用提供技术支撑方向,为今后蚕业的发展提供选择。
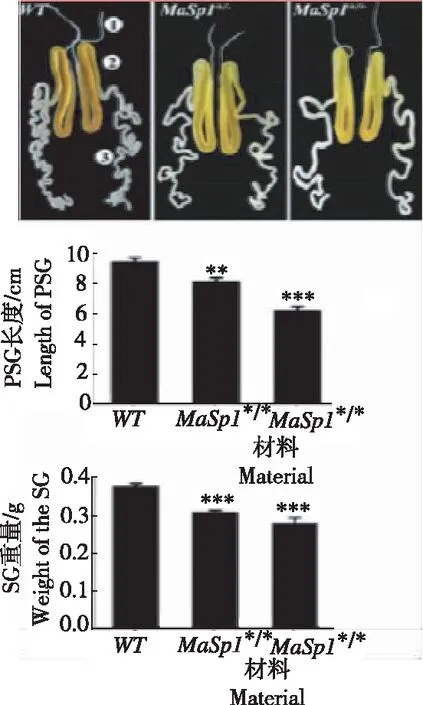
图1 转蜘蛛MaSp1基因蚕丝腺对比
Fig.1 Comparison of silk glands in transgenic spiderMaSp1 gene
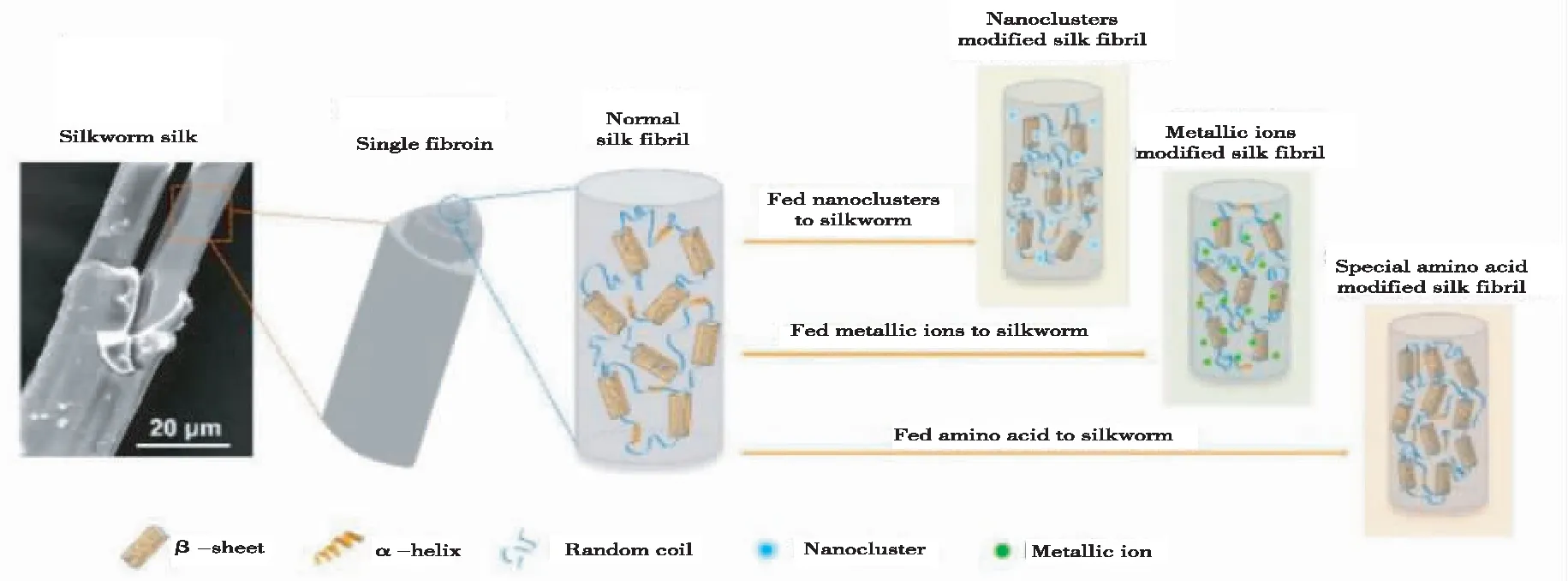
图2 蚕丝天然结构的改变
3 展望
我国是传统的栽桑养蚕大国,抗战时期,我国靠着丝绸织物出口创外汇给军队提供补给。改革开放初期,丝绸每年占据我国外汇的1/3。而随着经济大发展,蚕桑行业采取“东桑西移”的发展战略,加之近年来农村劳力大量外出,产业结构不断调整,蚕桑发展面临严重挑战。传统的栽桑养蚕缫丝织绸模式已不能满足当前行业发展的需求,蚕桑行业要继续发展,必须要开发其他用途,蚕丝作为天然纤维,具有很好的皮肤亲和能力,因此可以开发成手术缝合线;丝绸织物具有轻盈特点,可以制作成防弹衣和宇航服。这些都能满足蚕丝行业的继续发展,而目前最急需解决的是蚕丝力学性能的改良,因为当前生产上使用的品种均不能完全满足上述蚕丝特殊用途。
国内外研究者纷纷通过转基因手段、外源添食方法及理化原理进行蚕丝的生物学性状改良,以提高蚕丝的力学性能,并取得一系列研究成果,但到目前为止仍然没获得可以在生产上应用的改良品种,原因主要有转基因茧丝素材遗传稳定性不够,脱靶效率增加转基因材料获取的难度,外源基因与宿主基因存在排斥,导致许多功能性状好的基因无法植入家蚕体内,外源基因在家蚕体内的表达量不足;实验室需要从事基础研究,而许多基础研究在转变成成果的过程中又与国家政策存在矛盾,主要体现在公众对转基因生物安全问题存在担忧,因此农业部将转基因动植物申报列为三大安全性评估内容之一,加大对转基因品种的制约。这些客观因素均制约转基因材料走出实验室,同时也影响科研人员从事更加深入基础研究的信念,如何处理好转基因蚕丝材料的研发和应用将是今后蚕业科研人员长期面临的问题。针对这种现状,笔者认为今后的研究应当围绕市场需求和产业发展趋势深入开展,在符合转基因品种安全的条件下加大对家蚕茧丝的基础研发力度。同时各科研单位之间应加强沟通与合作,开展学术交流,取长补短,避免重复研究。

