秋水仙素对渥丹百合种子多倍体诱导的影响
王宇婷,张雅倩,杨青杰
(东北林业大学 园林学院, 黑龙江 哈尔滨 150040)
渥丹百合(LiliumconcolorSalisb.)属百合科百合属的多年生球根植物[1],花呈直立、星状开展,深红色小型花朵、无斑点,是东北地区百合属植物育种的优良资源,因其具有观赏价值高、适应性强、耐寒等优良特征,备受人们的青睐。渥丹百合同时还具有食用、药用价值,亦可作香料。目前,未见渥丹百合在园林绿化及室内装饰方面的应用研究报道,若经过引种驯化和适当筛选,其在园林应用上将会是很好的材料,在未来培育适应东北地区百合属观赏植物方面具有很大潜力。
多倍体育种具有多目标性状的综合改良效果,对于新品种选育及育种工作的发展进步具有重大意义[2]。有研究表明,经秋水仙素诱变处理得到的百合植株大多数都属于嵌合体,很容易恢复又突变为二倍体植株[3]。因此,对于诱导获得的变异植株必须要进行多倍体鉴定,以确保其能够具有稳定的多倍性。李旦等[4]对野生紫斑百合的丛生芽进行多倍体诱导研究表明,用浸泡法对紫斑百合的丛生芽进行多倍体诱导时,以秋水仙素浓度为0.3%、浸泡处理12 h获得的诱变效果最佳,并通过形态观察、气孔观测和染色体压片计数等方法鉴定了变异植株。目前,国内有关于渥丹百合的研究仅限于居群的核型分析及Giemsa C-带法的染色体分析[5-6],其染色体诱导加倍方面的研究也仅有对诱导后植株个体的气孔方面的描述[7]。为探究秋水仙素诱导渥丹百合加倍的最适条件,笔者等通过秋水仙碱诱导渥丹百合染色体加倍,并对诱变植株进行鉴定,获得染色体加倍的渥丹百合诱变个体和最佳诱导条件,旨在为渥丹百合的应用及未来的育种研究奠定理论和实践基础,同时也可为北方地区的园林绿化提供新的素材。
1 材料与方法
1.1 试验材料
供试材料为渥丹百合种子,购于吉林长春。试验用试剂分别为秋水仙素、蒸馏水、碱性品红、苯酚、70%酒精、冰醋酸、福尔马林(38%甲醛溶液)、山梨醇、浓盐酸和无水乙醇,均购于哈尔滨雨泽科技有限公司。
1.2 试验方法
1.2.1 种子处理 挑选饱满成熟、胚呈棕黄色且完整的渥丹百合种子800粒,用浓度为2%的次氯酸钠溶液漂洗15~20 min,再用清水漂洗15~20 min后备用。
1.2.2 秋水仙素诱导 于遮光条件下用电子天平秤取秋水仙素粉末放入烧杯,再用量筒量取蒸馏水加入烧杯,配制浓度为0(对照)、0.02%、0.05%、0.10%和0.15%的秋水仙素溶液各50 mL,分别移至5个烧瓶中,作好标记,备用。将渥丹百合种子分成5组,每组160粒,分别浸泡在上述配置好溶液中。每个浓度梯度再分为4组,每组40粒,分别设置24 h、48 h、72 h、96 h浸泡处理时间。
1.2.3 处理种子培养 秋水仙素处理结束后将渥丹百合种子移至培养皿,放入模拟土壤环境的培养箱中培养7~10 d,记录种子发芽时间及数量,待种子长出强健粗壮的根毛后,移入花盆中进一步培养。培养期间定期浇水,观察试验结果并拍照记录种子生长状况。花盆土配制:将壤土、珍珠岩、蛭石以2∶1∶1的比例混合后灭菌处理,待混合土温度降至20℃左右后置于花盆。
1.2.4 根尖压片 待渥丹百合幼苗生长至叶片近完全展开后,取1~3 cm生长状况良好的须根根尖,取样时间为9:00、9:20、9:40、10:00。分别剪取根尖进行预处理、固定、解离、漂洗、染色、制片。然后根据压片情况,找出其在细胞中期附近的2个时间点,在此区间再设置4个时间梯度,重复上述过程,以明确最佳中期分裂取样时间。预处理:将根尖清洗后置于4℃实验室冰箱中低温水浴保存24 h。固定:经过预处理的根尖,用水洗净后再用滤纸吸干表面水分。用卡诺固定液(无水乙醇∶冰醋酸为3∶1,现用现配)固定24 h后置于4℃实验室专用冰箱中保存备用。解离:取固定好的根尖置于小烧杯内,加解离液(1 mol/L HCl溶液)后室温处理6~8 min。漂洗:解离后用蒸馏水小心冲洗8~10 min。染色:将根尖放置于载玻片上,在根尖顶端部位截取2~3 mm的分生区,用滤纸吸干其表面的水分,然后滴加1滴卡宝品红染液,分别染色10 min、15 min、20 min、25 min和30 min,根据观察显示的着色情况找出最适染色时间,染色后用45%的乙酸进行分色1~2 min,再用滤纸吸去多余的染色液。压片:用酒精灯外焰加热1~2 s迅速移开[8],如此反复4~5次后加盖玻片。用带有橡皮头的铅笔均匀用力压片,直至材料呈雾状后结束压片。观察:先在低倍镜下(10×)找到渥丹百合分生区的细胞,然后换高倍镜(40×)观察。找出各处理组中明显处于各分裂时期的细胞,并对染色体的形态进行观察,对细胞分裂中、后期的染色体进行计数。若染色体形态清晰且处于分裂中、后期的细胞较多,则可将其制作成永久压片标本长期保存。
1.2.5 叶片的形态学鉴定 进行染色体数目及形态鉴定后,确定所有的变异植株,继续培养。同一试验环境下相同生长阶段,对标记好的四倍体植株与二倍体植株的外部形态特征即叶片的长度、宽度、厚度等指标进行测定比较。
1.2.6 叶片的细胞学鉴定 待渥丹百合幼苗生长至一定阶段,取相同生长状态和相同数量的四倍体植株和二倍体植株叶片,取其中部进行气孔检测。因为百合属植物叶片中部的气孔大小相对更为稳定[9],且该部位气孔变化幅度不明显。在显微镜物镜为20×的视野下,随机选择20个视野的保卫细胞,测量其长度、宽度并计算出平均值,统计气孔密度。
1.3 测定项目
统计种子发芽率、发芽指数(GI)、成活率、变异率及幼苗叶型指数。
发芽率=发芽种子数/种子总数×100%
发芽指数(GI)=∑(Gt/Dt)[10]
式中,Gt为在时间t天内的发芽个数,Dt为t所代表的的天数。
成活率=可成长幼苗的种子数/种子总数×100%;
变异率=诱变为多倍体的植物株数/处理的种子总数×100%。
叶型指数=叶片长度/叶片宽度。
2 结果与分析
2.1 秋水仙素对渥丹百合种子萌发的影响
在种子萌发的过程中,对照(无秋水仙素处理,清水浸泡)的种子最先出现萌发迹象,0.02%秋水仙素处理的次之,0.15%秋水仙素处理的萌发最慢。从表1看出,清水浸泡(对照)96 h的发芽率最高,为97.5%;0.15%秋水仙素处理48 h和96 h的发芽率最低,均低于50%。总体看,对照渥丹百合种子发芽率随浸泡时间延长呈增高趋势,秋水仙素处理的渥丹百合种子发芽率随秋水仙素浓度升高,整体发芽水平逐渐降低。表明,秋水仙素对渥丹百合的种子的萌发有一定的抑制作用,且随浓度增加,抑制作用越明显。

表1 不同浓度秋水仙素处理渥丹百合种子的萌发情况
2.2 秋水仙素对渥丹百合胚根发育的影响
渥丹百合种子经不同浓度的秋水仙素处理后,较对照处理(清水浸泡)其萌发出的胚根普遍明显膨大(图1)。经秋水仙素处理的胚根大多呈浅绿色,而对照种子胚根大多呈乳白色。同时可观察到,萌发后期秋水仙素处理的种子其根毛生长速度较对照缓慢。
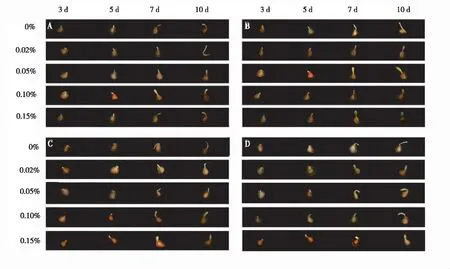
注:A,B,C,D分别为浸泡24 h,48 h,72 h,96 h的处理组,横向为种子生长时间,纵向为秋水仙素浓度。
Note: The seed-soaking hours of A, B, C and D treatments are 24 h, 48 h, 72 h and 96 h separately. The transverse direction is seed growth days. The longitudinal direction is colchicine concentration.
图 1不同浓度秋水仙素处理渥丹百合种子的萌发过程
Fig.1 Germination process ofL.concolorseeds treated with different colchicine concentration
2.3 秋水仙素对渥丹百合幼苗成活率的影响
从表2看出,秋水仙素处理的渥丹百合幼苗的成活率普遍低于对照,表明,秋水仙素影响渥丹百合幼苗成活,且随浓度增加影响越明显。相同浓度秋水仙素处理条件下,不同处理时间之间成活率差异明显,低浓度下随处理时间延长成活率提高;而高浓度条件下,成活率随处理时间延长而降低。
表2不同浓度秋水仙素处理渥丹百合幼苗的成活率
Table 2 Survival rates of seedlings germinated fromL.concolorseeds soaked in different colchicine concentration

秋水仙素/%ColchicineConcentration处理时间/hTreatment hours移栽数/个Number oftransplanted seedlings成活数/个Survival number成活率/%Survival rate0243636100.0048373594.59723838100.0096393897.440.0224352880.0048353085.7172343294.1296323093.750.0524342882.3548333090.9172312580.6596302480.000.1024262076.9248241875.0072231252.1796201155.000.1524241562.5048191368.4272261246.15 9619842.11
2.4 诱导处理后幼苗根尖倍性鉴定
普通渥丹百合为二倍体,其植株体细胞内染色体数量为16~18条(图2),经秋水仙素处理后成功诱导加倍,加倍后的幼苗根尖体细胞内染色体数目增为原来的1倍左右,即获得渥丹百合四倍体(图3)。在不同浓度的秋水仙素诱导中,0.05%秋水仙素浸泡48 h处理的染色体加倍现象十分明显。
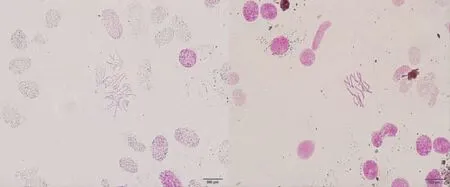
图2 清水浸泡48 h 处理组渥丹百合幼苗根尖染色体情况
Fig.2 Morphology of root tip chromosome ofL.concolorseeds soaked in water for 48 h
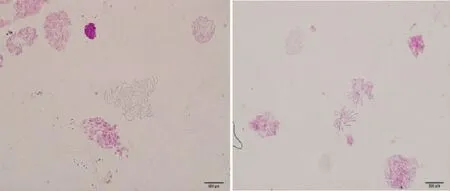
图30.05% 秋水仙素浸泡48 h 处理渥丹百合幼苗根尖染色体情况
Fig.3 Morphology of root tip chromosome ofL.concolorseeds soaked in 0.05% colchicine solution for 48 h
2.5 秋水仙素对渥丹百合种子四倍体诱导效果
从表3看出,0.05%秋水仙素浸泡48 h处理的诱变效果最佳,其变异率为20%;其次是0.02%秋水仙素处理96 h,变异率为17.5%;0.05%秋水仙素处理72 h也可获得相对较好的诱变效果。表明,适宜的秋水仙素浓度和处理时间是获得大量渥丹百合四倍体的关键因素。
表3不同浓度秋水仙素处理渥丹百合的变异率
Table 3 Effect of different colchicine concentration on mutation rate ofL.concolorseedlings

秋水仙素/%ColchicineConcentration处理时间/hTreatment hours变异数/个Mutation number变异率/%Mutation rate02400 4800 7200 9600 0.022425 48410.072512.596717.50.0524512.548820.072615.096410.00.1024410.04825.07225.09600 0.152437.54825.07200 9612.5
2.6 渥丹百合二倍体与四倍体幼苗的形态学及细胞学差异
2.6.1 形态学差异 从表4看出,渥丹百合四倍体植株的叶片长度、宽度和厚度均明显大于二倍体,分别为二倍体植株的109.65%、107.39%和163.16%。四倍体植株的叶型指数随之变小,为二倍体的93.34%。整体上看,四倍体植株表现为叶片宽大、叶柄色泽更深、叶片颜色更浓绿、根系粗壮等特征,体现了多倍体植株的器官巨大性的特点。叶片厚度、长度以及叶形指数可作为初步鉴别四倍体植株与二倍体植株的重要指标。

表4 渥丹百合四倍体与二倍体植株叶片形态差异
2.6.2 细胞学差异 植株叶片气孔的变化是植物多倍化的一个重要细胞学鉴定指标。从表5看出,渥丹百合四倍体植株叶片的保卫细胞较二倍体明显增大,其平均长度为二倍体植株的167.45%,平均宽度的为二倍体的158.74%;同时,四倍体植株的气孔密度明显下降,为二倍体的61.09%。

表5 渥丹百合四倍体与二倍体植株叶片的细胞学差异
3 结论与讨论
研究结果表明,渥丹百合的种子发芽率随秋水仙素浓度升高逐渐降低。通过秋水仙素处理渥丹百合种子可以有效诱导多倍体植株的形成,0.05%秋水仙素处理48 h为诱导渥丹百合染色体加倍较适宜的浓度与处理时间,诱变率达20.00%。秋水仙素在诱发种子染色体加倍时,会对细胞产生毒副作用,进而影响其生长发育[11]。刘静等[12]通过对兰州百合进行秋水仙素加倍处理发现,相同处理时间条件下,随秋水仙素浓度增大,鳞茎数与小鳞茎产生率逐渐减少;秋水仙素浓度相同时,随着处理时间延长,鳞茎数、小鳞茎产生率也逐渐减少。
对根尖进行压片处理时,最佳取材时间为9:30-9:35,这段时间内渥丹百合根尖的有丝分裂最为旺盛,压片效果最好。赵庆等[8]对万寿菊根尖染色体观测最优方法进行研究表明,有丝分裂前中期为最佳观测阶段,前中期时间点应处于9:00左右。根尖压片染色最适染色时长为20 min,并于染色结束后立即用45%的乙酸溶液进行1.5 min的分色,观察效果更佳。
通过对渥丹百合种子萌发情况的观察分析发现,种子培养过程中保持水分和无污染,尽可能减少种子的霉菌感染,若出现霉菌感染可能是培养过程中的环境温度或湿度并非最佳[13]。植物根尖染色体观测受很多因素的影响,包括根尖培养方式、根尖成熟程度以及制片过程中各个阶段的处理技术等[14]。在根尖染色制片过程中发现,有许多幼苗经秋水仙素处理后成为了嵌合体。对于如何解决用秋水仙素诱导处理渥丹百合种子以获得多倍体中易出现不稳定嵌合体的问题,以及渥丹百合嵌合体的进一步形态学细胞学研究,还需更深层次的研究探索。

