异丙安替比林通过抑制蛋白激酶B通路诱导人肾癌细胞凋亡和自噬
李明俊,赵冬
虽然,人们对肿瘤的认知和理解已经取得很大的进步,但是,肿瘤依然是威胁人类生命健康的重要原因之一[1]。考虑到抗肿瘤药物研发费用高、失败率高和试验周期长等问题,“老药新用”抗肿瘤有望成为一种行之有效的治疗方案[2]。异丙安替比林(Propyphenazone)是一种安替比林衍生物,并具有与安替比林相类似的解热、镇痛功效[3]。然而,这种抗炎药物对于肿瘤的作用和机制尚未报道。我们通过一系列体外细胞实验发现,异丙安替比林对肾癌细胞系Caki-1的增殖具有抑制作用,并且初步探究了其作用机制,为其抗肿瘤作用以及临床应用的进一步研究奠定基础。
本研究起止时间为2016年12月至2017年9月。
1 材料与方法
1.1 细胞和试剂 人肾癌细胞系Caki-1和人肝细胞系LO2由暨南大学惠赠。异丙安替比林购买自MCE公司(货号HY-A0273)。MTT(四甲基偶氮唑盐)和Hoechst 33342购自Sigma公司,Annexin V-FITC/PI试剂盒购自天津三箭有限公司。
1.2 抗体和仪器 丝氨酸/苏氨酸蛋白激酶AKT(蛋白激酶B)、磷酸化的丝氨酸/苏氨酸蛋白激酶(p-AKT)、DNA修复酶(PARP)、甘油醛-3-磷酸脱氢酶(GAPDH)、自噬标志物LC3的蛋白一抗均购自Cell Signaling Technology公司。超净台购买自江苏苏净集团,细胞培养箱购买自Thermo Electron Corporation公司。激光共聚焦显微镜购买自Olympus公司。FACS流式细胞仪购买自Beckham公司。
1.3 方法
1.3.1 细胞培养 人肾癌Caki-1细胞系用McCOY’s 5A培养基(含有10%胎牛血清)、人肝细胞LO2细胞系用DMEM培养基(含有10%胎牛血清)于37 ℃、含5%二氧化碳的恒温培养箱中培养。培养2 d后更换新鲜培养基,当细胞生长到80%时,用0.25%胰酶消化并传代。
1.3.2 MTT(四甲基偶氮唑盐)实验 生长状态良好的Caki-1细胞种于96孔板中,每孔先加入100 μL细胞悬液,细胞密度8 000个/孔,培养24 h。待细胞贴壁后再加入不同浓度的异丙安替比林100 μL,然后置于培养箱分别培养24 h、48 h、72 h。MTT检测前,每孔加入10 μL 5 g/L MTT孵育4~6 h,弃去上清,每孔加入100 μL二甲基亚砜(DMSO)溶液,结晶充分溶解后,酶联检测仪的波长调整为570 nm,检测每孔的光密度值(OD值),然后,计算Caki-1细胞增殖率。
1.3.3 克隆形成抑制实验 生长状态良好的人肾癌细胞系Caki-1,接种于6孔板中(600个细胞/孔),置于恒温培养箱中,培养2周后弃去上清,用磷酸盐缓冲液(PBS)浸洗3遍,加入75%乙醇固定15 min,吸去固定液后,适量0.1%结晶紫染色30 min后,冲洗,干燥,拍照。
1.3.4 Hoechst 33342染色 生长状态良好的人肾癌细胞系Caki-1置于 5%二氧化碳培养箱培养24 h后,去除培养基,PBS洗涤3遍,加入Hoechst 33342避光染色15 min,流水冲洗干净,晾干,显微镜拍照。
1.3.5 流式细胞术检测细胞凋亡 生长状态良好的人肾癌细胞系Caki-1接种于6孔板,24 h后加入不同浓度的异丙安替比林。48 h后收集细胞,2 000 r/min,离心5 min,弃去上清,PBS洗1遍,加入200 μL Binding Bufffer吹悬细胞,分别加入1 μL Annexin V-FITC和1 μL碘化丙啶(PI),混匀,避光,室温染色15 min,流式上机检测凋亡比例。
1.3.6 蛋白质印迹法(Western Blot)检测相关信号通路蛋白 人肾癌细胞系Caki-1用不同浓度的异丙安替比林处理24 h后,PBS洗3遍,加入RIPA细胞裂解液(含蛋白酶和磷酸酶抑制剂)冰上裂解15 min,12 000 r/min,4 ℃离心15 min,吸取上清至新的EP管,然后,BCA法测定蛋白浓度。取25 μg蛋白上样跑电泳,转膜,封闭,一抗4 ℃孵育过夜,等渗缓冲盐溶液(TBST)洗4遍,每遍5 min,二抗室温孵育至少1 h,TBST洗4遍,每遍5 min,化学发光显色。
1.3.7 免疫荧光 生长状态良好的Caki-1细胞种于含有玻片的24孔板,异丙安替比林处理24 h后,吸出原培养基,PBS洗2遍,每遍3 min。然后,加入4%多聚甲醛固定15 min,PBS洗2遍,每遍3 min,然后,加入0.25% Triton X-100打孔,PBS洗2遍,每遍3 min。加入4%牛血清蛋白(BSA)封闭后孵育一抗(1∶200稀释),室温1 h,吸出液体,PBS(含2%Tween 20)洗2遍,每遍3 min。然后,加入二抗(1∶200稀释)室温孵育1 h。吸出液体,PBS(含2%Tween 20)洗2遍,每遍3 min。经DAPI染核后,再将玻片取出晾干后,置于激光共聚焦显微镜下观察并拍照。
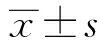
2 结果
2.1 异丙安替比林对人肾癌Caki-1和人肝细胞LO2增殖抑制的影响 MTT细胞活性实验表明,对照组Caki-1细胞增殖率为100%,异丙安替比林(20、40、80、100 μM)组处理24 h的细胞增殖率分别为(89.1±3.6)%、(80.5±6.2)%、(78.5±3.1)%、(53.2±2.4)%。异丙安替比林(20、40、80、100 μM)组处理48 h的细胞增殖率分别为(84.5±5.3)%、(82.6±2.5)%、(73.6±4.2)%、(40.6±6.8)%。异丙安替比林(20、40、80、100 μM)组处理72 h的细胞增殖率分别为(85.7±4.9)%、(63.4±2.1)%、(20.4±2.8)%、(11.4±4.1)%。由此证明,异丙安替比林对Caki-1细胞增殖呈现时间依赖性和浓度依赖性的抑制作用。经SPSS 17.0软件计算,异丙安替比林处理24 h后,对Caki-1细胞的半抑制浓度(IC50)=105 μM;异丙安替比林处理48 h后,对Caki-1细胞的IC50=83 μM;异丙安替比林处理72 h后,对Caki-1细胞的IC50=56 μM。然而,对人正常肝细胞LO2无显著增殖抑制作用(P>0.05),见图1。
2.2 异丙安替比林对人肾癌Caki-1细胞克隆形成抑制的作用 异丙安替比林作用于Caki-1细胞7 d,与对照组相比,随着异丙安替比林浓度增加,细胞集落克隆数显著减少,并且克隆体积显著变小(P<0.05)。20 μM和40 μM的异丙安替比林处理Caki-1细胞后,克隆形成率分别降为38%(P<0.05)和20%(P<0.01),见图2。

图1 异丙安替比林对人肾癌Caki-1(A)和人肝细胞LO2(B)增殖的影响
2.3 异丙安替比林对人肾癌Caki-1细胞凋亡形态的影响 Hoechst 33342染色结果表明,对照组的Caki-1细胞核内染色均一,说明细胞状态良好。随着异丙安替比林的浓度增加,Caki-1细胞核内出现聚集点,说明Caki-1细胞发生凋亡,并伴随染色质的固缩,见图3。
2.4 异丙安替比林对人肾癌Caki-1细胞凋亡的影响 Annexin V-FITC/PI检测凋亡细胞比例,结果表明,Caki-1细胞在不同浓度的异丙安替比林(40 μM、80 μM、100 μM)处理下,随着浓度增加,凋亡的Caki-1细胞比例逐渐增加,其中,当使用0 μM、40 μM、80 μM和100 μM 的异丙安替林处理Caki-1细胞后,细胞凋亡率分别为7.4%、13.5%、34.5%和50.9%,见图4。
2.5 Western Blot检测细胞凋亡相关蛋白表达水平 不同浓度异丙安替比林处理Caki-1细胞24 h,随着药物处理浓度的增加,p-AKT蛋白表达逐渐降低,但对AKT蛋白的表达未有影响,并且PARP出现酶切条带,证明异丙安替比林抑制了AKT蛋白的活性,并且诱导Caki-1细胞发生了凋亡,其中,80 μM处理细胞后,细胞凋亡最为显著,见图5。
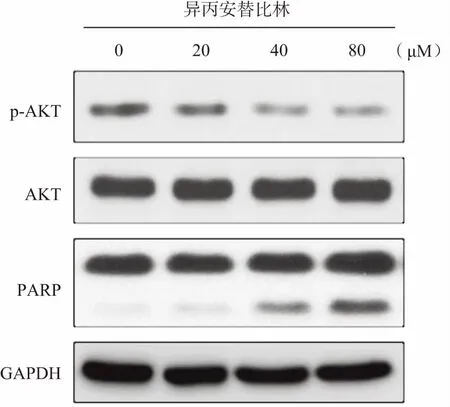
图5 异丙安替比林对人肾癌Caki-1细胞凋亡和AKT通路的影响
2.6 异丙安替比林诱导人肾癌Caki-1细胞自噬 免疫荧光检测发现,异丙安替比林(80 μM)处理人肾癌Caki-1细胞24 h后,LC3出现点状聚集现象,而DMSO对照组LC3呈现弥漫状分布,见图6。这表明异丙安替比林很可能诱导了Caki-1细胞发生了自噬现象。
3 讨论
肾癌是最为常见的泌尿系统恶性肿瘤之一,居泌尿系统恶性肿瘤第二位[4],来源于肾上皮组织。流行病统计研究表明,仅2012年肾癌发病率占男性恶性肿瘤发病率的第9位,占女性恶性肿瘤发病率的第14位,并仍处于上升趋势[5]。一旦出现周围组织侵犯或者远端转移,五年生存率小于10%。目前,临床主要治疗策略有:肾脏切除、靶向治疗和免疫治疗[6]。随之带来的治疗费用高、周期长、耐药风险大等原因,因而迫切需要安全有效的辅助性抗肿瘤药物。
在这里,我们发现一种临床批准使用的抗炎、镇痛药物——异丙安替比林,具有抑制人肾癌细胞系Caki-1增殖的作用,并且与克隆形成抑制实验的结果趋势一致。通过流式细胞术发现,异丙安替比林能诱导Caki-1细胞的凋亡。进一步的Hoechst 33342染色更加表明,异丙安替比林使得Caki-1细胞核发生染色质的固缩,并呈现出细胞凋亡的表型。
AKT,也称为蛋白激酶B,是PI3K/AKT信号通路的关键蛋白,是细胞重要的生存通路,与多种细胞生物学进程相关,如葡萄糖代谢、细胞凋亡、细胞增殖和细胞迁移等[7]。AKT可分为3个亚型:AKT1、AKT2和AKT3[8]。AKT1主要通过抑制凋亡并且诱导胞内蛋白合成来促进细胞的生存。AKT2主要参与胰岛素信号的转导。AKT3的功能未知,尚未有大量的研究报道。AKT与人类多种肿瘤相关,而磷酸化的AKT是其活化形式,当AKT激活后,会通过磷酸化下游Forkhead家族的转录因子,导致细胞凋亡相关基因的转录表达下调,从而促进细胞的增殖[9]。细胞凋亡包括死亡受体介导的细胞凋亡、B淋巴细胞瘤-2(BCL-2)家族介导的内源性凋亡和内质网压力(ER-Stress)介导的细胞凋亡。其中,内源性凋亡主要由BCL-2家族调节,通过半胱氨酸天冬氨酸特异性蛋白酶-9(Caspase-9)和半胱氨酸天冬氨酸特异性蛋白酶-3(Caspase-3)的级联反应,导致下游DNA修复酶PARP失活,最终使得细胞发生凋亡[10-12]。我们通过Western Blot发现,异丙安替比林对人肾癌Caki-1细胞AKT蛋白表达未有影响,但是显著下调磷酸化AKT的表达,进而抑制了AKT蛋白活性,并促进PARP切割失活,这些结果均与细胞凋亡的表型一致。
LC3由MAP1LC3A基因编码,是自噬体膜的内在组件,主要参与自噬泡的形成过程。LC3被认为是细胞自噬分子标志物,并在自噬领域中被广泛研究[13]。当细胞发生自噬时,LC3由Ⅰ型转变为Ⅱ型,并与p62(自噬底物识别受体)结合,并被包裹于自噬体内膜,此时,LC3会在细胞中发生点状聚集[14-15]。本研究发现,异丙安替比林处理Caki-1细胞后,通过激光共聚焦显微镜能够明显观察到LC3的点状聚集,意味着细胞在药物处理条件下发生了自噬。
综上所述,异丙安替比林能抑制人肾癌细胞的增殖,并通过抑制AKT和PARP活性而促进细胞发生凋亡和自噬。本研究工作将有助于异丙安替比林作为廉价抗癌药物或辅助抗癌药物的研究和开发。

注:与对照组(DMSO)相比,aP<0.05,bP<0.01图2 异丙安替比林对人肾癌Caki-1克隆形成抑制的影响

图3 异丙安替比林对人肾癌Caki-1凋亡形态的影响(Hoechst 33342染色×100)

图4 异丙安替比林对人肾癌Caki-1凋亡比例的影响

图6 异丙安替比林对人肾癌Caki-1细胞自噬的影响(免疫荧光染色×400)

