克罗米芬促排卵周期中应用寿胎丸对小鼠着床窗口期子宫内膜及其容受性、妊娠结局的影响▲
李 楠 王丽君 张 辉
(陕西中医药大学附属医院妇科,咸阳市 712000,电子邮箱:linan_80_311@163.com)
临床上,克罗米芬用于治疗排卵障碍性不孕症,具有价格低廉、口服给药、使用安全等优点[1]。但是由于克罗米芬同时具有抗激素作用,易造成子宫内膜容受性下降而出现“高排低孕”现象。中医药治疗是解决克罗米芬负面效应的有效方法之一。为了明确中医药寿胎丸对子宫内膜容受性的影响,本研究建立克罗米芬诱发排卵模型,观察寿胎丸对着床窗口期子宫内膜形态、厚度,子宫内膜容受性标志物白血病抑制因子(leukemia inhibitory factor,LIF)的表达,以及对妊娠率的影响,为中药辅助促排卵药物提高妊娠率提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:成熟期、未孕雌性ICR系无特定病原体小鼠,6~8周龄,体重(30±5)g,清洁级性成熟雄性小鼠体重,6~8周龄,体重(30±5)g,均由成都达硕实验动物中心提供,合格证号:SCXK(川)2015-030。喂养条件:室温(20±2)℃,自由摄食、饮水,普通饲料喂养。
1.1.2 药物:枸橼酸氯米芬胶囊(商品名:克罗米芬)购自康和药业(批号:k0702),人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)购自上海丽珠集团丽珠制药厂(批号:170901-1)。寿胎丸由菟丝子、续断、桑寄生、阿胶组成,均由陕西中医药大学附属医院药剂科对中药材的来源及品种进行鉴定后,采用水提醇沉法制备药液,药物终浓度为1 g生药/mL, 4℃冰箱保存。
1.1.3 主要试剂及仪器:苏木精-伊红(hematoxylin-eosin,HE)染色液(批号:C0105)购自碧云天生物技术公司,4%多聚甲醛(批号:P8430-25)、1%氯化氢-75%乙醇(批号:80176961)、氢氧化钠碱液(批号:C380215000)、95%乙醇(批号:10009128)、80%乙醇(由95%乙醇配制)、丙三醇(批号:40025861)、二甲苯(批号:10023418)、磷酸缓冲盐溶液(批号:GL1263)、0.01%聚乙二醇辛基苯基醚(Triton X-100,批号:A30313503)均购自中国国药集团,湿盒(批号:YA0764)购自上海索莱宝生物科技有限公司,辣根过氧化物酶标记二抗(批号:A0216)购自碧云天生物技术公司,二喹啉甲酸蛋白定量测定试剂盒(批号:PT0001)购自武汉博士德生物工程有限公司,聚偏氟乙烯膜(批号:ISEQ00010)购自美国Millipore公司,电化学发光试剂(批号:32109)购自德国Roche公司,兔抗LIF多克隆抗体(批号:sc-20087)购自美国Santa Cruz公司,PrimeScriptTMRT试剂盒(批号:RR037Q)、SYBR®Premix Ex TaqTMⅡ试剂(批号:RR820L)均购自TaKaRa公司。CM3050S型冷冻切片机、IX71型倒置显微镜均购自Leica公司,StepOnePlus型实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)仪购自美国应用生物系统公司,Trans-Blot型电泳及转膜设备购自美国Bio-Rad公司,2-16k型离心机购自德国Sigma公司,LS-2型超净工作台购自北京安泰公司,S648型电热恒温水箱购自上海医疗器械厂,XSZ-81型光学显微镜购自广西梧州市光学仪器厂。
1.2 方法
1.2.1 分组方法:每日将棉签蘸少许生理盐水后,于雌性小鼠阴道壁外1/3处旋转一圈后取出,行阴道涂片,均匀涂于载玻片上,晾干后用95%乙醇固定30 min;洗去玻片上的乙醇,经苏木素染色5 min,流水冲净,置入酸性乙醇分化液中浸提2次,每次不超过10 s,清水洗涤去除多余分化液;将载玻片经伊红染色3 min,自来水洗涤;干燥后在显微镜下观察并记录。连续观察2个动情周期,将具有规律动情周期的90只雌性小鼠纳入本研究。从第3个动情周期开始实验。采用随机数字表法将雌鼠分为对照组、克罗米芬组和中药组,每组30只。
1.2.2 给药方法:小鼠动情周期为4~5 d,分为动情前期、动情期、动情后期、动情间期,于动情前期参照文献[2]用药,参照小鼠等效剂量相当于人用剂量的9.1倍,计算小鼠灌胃剂量。对照组按照1 mL/100 g灌服生理盐水,1次/d,直至合笼后第4天。克罗米芬组按照140 mg/(kg·d)给予克罗米芬,每次按1 mL/100 g灌服,1次/d,连续2 d;合笼后12 h开始按照1 mL/100 g灌服生理盐水,1次/d,直至合笼后第4天。中药组在克罗米芬组基础上,从合笼后12 h开始按1 mL/100 g灌服中药,1次/d,直至合笼后第4天。在连续灌胃2 d后上午8时,给各组小鼠腹腔内注射HCG 5 IU,注射后12 h与雄性小鼠合笼,雌雄比例为2 ∶1。合笼后第4天,每组各处死10只雌性小鼠,观察妊娠数,并取子宫观察内膜厚度和形态学变化,并检测着床窗口期LIF的表达;分别于第5天、第7天每组各处死10只雌性小鼠,观察各组的妊娠数。
1.2.3 HE染色观察着床窗口期子宫内膜形态学变化:合笼后第4天,小鼠断颈处死,于75%乙醇中浸泡消毒5~10 min。无菌条件下,用生理盐水冲洗小鼠子宫,体式显微镜下检到囊胚,则确定为妊娠小鼠,随即留取整个子宫,放置于4%多聚甲醛中固定24 h。将小鼠子宫包埋于包埋剂后,于冷冻切片机上切片,设置切片厚度为5 μm。选取平整的切片进行HE染色。将切片于4%多聚甲醛中固定10~30 s,水洗;染苏木素3~5 min,水洗;1%氯化氢-75%乙醇分化5~10 s,水洗;用碱水促蓝20 s,水洗;伊红染色30~60 s,水洗;80%乙醇洗3~5 s,95%乙醇洗3~5 s,无水乙醇洗3~5 s,丙三醇封片。倒置显微镜下采用Leica Qwin Plus图像处理软件观察着床窗口期子宫内膜厚度,以及腺体的周长、面积和最大直径。
1.2.4 检测着床窗口期小鼠子宫内膜LIF蛋白的表达:获取合笼后第4天的妊娠小鼠子宫组织。将组织标本经预冷的磷酸缓冲盐溶液洗涤2次,剪成约为0.5 g的多个组织块,加液氮研磨后加入RIPA裂解液,超声波破碎,冰浴裂解30 min。4℃下15 000 r/min离心20 min,取上清,采用二喹啉甲酸蛋白测定试剂盒测定蛋白浓度。随后向蛋白中加入上样缓冲液,100℃水浴10 min使蛋白变性。用湿转法将蛋白转移到聚偏氟乙烯膜上,转膜后用含10%脱脂奶粉的TBST(20 nm三羟甲基氨基甲烷,150 nm氯化钠,0.05% Tween-20)室温封闭2 h,随后将膜转入含有兔抗LIF多克隆抗体的封闭液中,4℃过夜孵育。一抗孵育结束后用TBST洗膜3次,10 min/次。洗涤后的膜放入含有辣根过氧化物酶标记的二抗封闭液中,室温孵育2 h。孵育结束后用TBST洗膜3次,10 min/次。洗涤后的膜用化学底物发光法进行显色,然后到暗室中曝光。采用Quantity One软件进行对特异蛋白条带进行灰度扫描和定量分析。
1.2.5 着床窗口期小鼠子宫内膜LIF mRNA的表达:获取合笼后第4天的妊娠小鼠子宫组织。利用TRIzol法提取RNA,反转录合成cDNA后,以各组子宫内膜的cDNA为模板,利用特异性定量引物进行RT-qPCR反应,基因特异性引物见表1,每个样品重复3次。反应体系为20 μL,包括2×SYBR® Premix Ex TaqTMⅡ 10 μL,上游引物(10 μm)0.8 μL,下游引物(10 μm)0.8 μL,50×ROX Reference Dye 0.4 μL,模板(cDNA)2 μL,双蒸水6 μL。RT-qPCR反应程序为95℃ 30 s、95℃ 5 s、60℃ 30 s,共40个循环,行溶解曲线分析。实验选取甘油醛-3-磷酸脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因。采用2-△△CT法计算mRNA表达量,每组数据值取3个独立样品的平均数。

表1 荧光定量PCR引物序列
1.2.6 妊娠率的计算:合笼后第4天、第5天、第7天,摘取各组小鼠子宫,记录孕鼠数。生理盐水冲洗子宫,体式显微镜下观察是否有胚胎,有胚胎者视为孕鼠,无胚胎者视为未孕。总妊娠率=(总孕鼠数/交配雌鼠数)×100%。
1.3 统计学分析 采用SPSS 17.0软件进行统计分析。计量资料用(x±s)表示,多组间比较用单因素方差分析,两两比较选择LSD-t检验;计数资料以例数(率)表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组小鼠着床窗口期子宫内膜厚度及形态学变化 合笼后第4天,与其他两组比较,克罗米芬组的子宫内膜厚度变薄,腺体周长、面积和最大直径均较小(均P<0.05),而中药组与对照组比较差异无统计学意义(均P>0.05),见表2。镜下观察到对照组小鼠子宫内膜腺体数量增多,间质疏松、水肿,血管弯曲,管腔扩张,腺腔分泌丰富;克罗米芬组小鼠子宫内膜腺体排列稀疏,腺上皮呈低柱状,间质致密,部分腺腔内见空泡;中药组小鼠子宫内膜腺体腺上皮呈高柱状,腺腔内见较多空泡,间质疏松,血管延长,腺体数目及成熟度接近对照组。见图1。

表2 3组小鼠着床窗口期子宫内膜厚度及形态学的比较(x±s)
注:与对照组比较,aP<0.05;与中药组比较,bP<0.05。
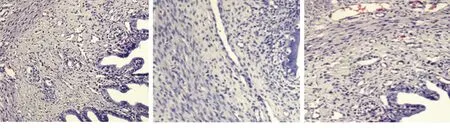
对照组 中药组 克罗米芬组
图1 3组小鼠着床窗口期子宫内膜形态学变化(HE染色,×200)
2.2 3组小鼠着床窗口期子宫内膜LIF mRNA及蛋白表达水平比较 合笼后第4天,与对照组及中药组比较,克罗米芬组着床窗口期子宫内膜LIF mRNA及蛋白的表达均降低(均P<0.05),见图2及表3。

图2 3组小鼠着床窗口期子宫内膜LIF蛋白表达情况

组别nLIF蛋白LIF mRNA对照组 80.95±0.031.59±0.05中药组70.91±0.021.56±0.04克罗米芬组50.75±0.02a1.37±0.03a F值64.83050.590P值<0.001<0.001
注:与对照组和中药组比较,aP<0.05。
2.3 3组小鼠总妊娠率比较 克罗米芬组、对照组、中药组的总妊娠率分别为50.0%(15/30)、83.3%(25/30)、76.7(23/30),差异有统计学意义(χ2=0.889,P=0.012)。其中克罗米芬组的总妊娠率低于其他两组(P<0.05),而对照组与中药组的总妊娠率比较,差异无统计学意义(P>0.05)。见表4。

表4 3组小鼠妊娠情况(n)
3 讨 论
胚胎的质量和子宫内膜的容受性是影响妊娠率的两个关键因素,其中60%以上的胚胎种植失败与子宫内膜微环境改变及容受性不良有关[3]。克罗米芬作为治疗排卵障碍性不孕症的一线药物,应用过程中其会影响子宫内膜厚度及宫颈黏液的产生,造成子宫内膜出现低容受性而导致妊娠率降低。子宫内膜薄、血流不足、内膜成熟延迟可导致周期妊娠率低。因此,通过增加内膜的厚度及血供,促进内膜成熟,使之与卵泡发育同步化是提高子宫内膜容受性及妊娠率的必要条件。临床中常通过补充雌激素促进子宫内膜生长,并通过口服阿司匹林改善内膜下血流来提高内膜容受性。近年来,有研究显示中医药有助于促排卵,提高临床妊娠率[4-5],这充分显示了中医药在助孕方面的整体优势。一项Meta分析显示,相较于单纯克罗米芬治疗,在克罗米芬促排卵过程中联合补肾中药治疗多囊卵巢综合征,可提高排卵率和妊娠率[6],这为进一步研究补肾中药提高妊娠率的机制提供了证据支持。
寿胎丸出自著名医家张锡纯所著的《医学衷中参西录》[7],其由菟丝子、续断、桑寄生、阿胶四味药物组成,原方用于治疗滑胎和预防流产。作为固肾安胎第一方,该方剂已经成为临床中应用最广、报道最多、疗效最为显著的方剂,用于治疗先兆流产、不明原因反复流产等[8-9]。鉴于寿胎丸的有效性,近年来有学者对该方剂开展了广泛而深入的研究临床及基础[10-11],并延伸到辅助生殖技术领域[12]。研究表明,寿胎丸能增加子宫内膜厚度,提高生育能力和胚胎质量,促进胚胎着床,从而提高体外受精-胚胎移植周期的成功率[13]。另有实验结果表明,寿胎丸加减方可提高超排卵小鼠种植窗期子宫内膜的容受性[14]。此外,寿胎丸的雌激素样活性,可明显降低复发性流产小鼠胚胎丢失率,调节流产小鼠蜕膜组织中多种蛋白质表达,促进早孕期胎盘分泌绒毛膜促性腺激素,调节母胎界面的内分泌及免疫网络分子水平,并提高孕激素水平,从而改善黄体功能,且在合理剂量下对胚胎发育无明显毒性[15-19]。
本研究结果显示,合笼后第4天,中药组小鼠子宫内膜厚度虽不及正常组厚,但较克罗米芬组增厚(P<0.05),提示受抑制的内膜得到了逆转。镜下观察到克罗米芬组子宫内膜腺体排列稀疏,腺上皮呈低柱状,间质致密,部分腺腔内见空泡;而中药组子宫内膜腺体腺上皮呈高柱状,腺腔内见较多空泡,间质疏松,血管延长,腺体数目及成熟度接近对照组。提示中药组小鼠子宫内膜腺体、间质及血管发育较成熟,接近于正常小鼠,说明寿胎丸雌激素样活性,弥补了克罗米芬造成的内源性雌激素不足的缺陷,促进子宫内膜的快速恢复,为胚胎着床提供适宜的子宫内膜厚度和良好的内膜容受性。本研究中,中药组的总妊娠率高于克罗米芬组(均P<0.05),提示寿胎丸对胚胎的黏附和植入过程中的子宫内膜局部微环境有正向调节作用。
LIF是一种多效性的分泌型糖蛋白,属于白细胞介素6超家族的成员,与相应的受体结合后在细胞生长、增殖和分化中发挥广泛的作用,与胚胎种植相关[20]。有实验表明,LIF基因敲除的小鼠不能发生胚胎种植,但将基因敲除的小鼠的胚胎种植在正常小鼠或敲除基因后再给予LIF,仍可使胚胎种植[21]。因此,LIF可影响子宫内膜的容受性。本研究结果显示,克罗米芬组子宫内膜LIF mRNA及蛋白表达均较对照组和中药组下降(均P<0.05),而中药组与对照组差异无统计学意义(P>0.05),这从分子角度证明了克罗米芬对子宫内膜容受性有负面影响,而在克罗米芬促排卵周期中应用寿胎丸有利于改善子宫内膜容受性,从而提高妊娠率。
综上所述,寿胎丸能够改善克罗米芬促排卵后子宫内膜厚度,增强LIF在内膜中的表达。因此,可以在促排卵助孕周期加用寿胎丸作为辅助治疗,以改善着床窗口期子宫内膜容受性,以提高临床妊娠率。

