早期2型糖尿病患者血清补体水平与肥胖、胰岛素抵抗的关系▲
肖丽红 周 玉
(广西柳州市人民医院内分泌科,柳州市 545006,电子邮箱:2979214431@qq.com)
近年来,2型糖尿病患者机体存在慢性低度炎症的观点已被众多研究证实,其中补体活化与2型糖尿病发生发展的关系日益为学者所关注[1-2]。补体活化可导致与肥胖相关的慢性低度炎症,并参与胰岛素抵抗的形成[1-2]。本研究通过检测2型糖尿病患者血清补体C3、C4水平,分析其与体质指数、胰岛素抵抗指数之间的关系,探讨补体活化在2型糖尿病发病机制中的作用。
1 资料与方法
1.1 临床资料 选取2017年6~12月在我科住院被诊断为2型糖尿病的178例患者,其中男90例、女88例,病程≤24个月。纳入标准:2型糖尿病诊断符合2012年美国糖尿病学会制定的糖尿病诊断及分型标准[3];无糖尿病急慢性并发症;肝肾功能正常;入院前均未使用降脂、降压、抗血小板等药物治疗。排除标准:合并心脑血管病史、恶性肿瘤、血液系统疾病、自身免疫性疾病、感染性疾病、慢性阻塞性肺疾病、过敏、应激者。根据2003年《中国成人超重和肥胖症预防控制指南》[4],将入组的2型糖尿病患者按体质指数水平分为正常体质指数组(体质指数≤24.0 kg/m2)45例、超重组(24 kg/m2<体质指数<28.0 kg/m2)63例、肥胖组(体质指数≥28 kg/m2)70例。同时纳入37例体检健康者作为对照组。4组的年龄及性别比较,差异均无统计学意义(均P<0.05),具有可比性,见表1。

表1 4组的一般资料比较
1.2 观察指标的检测 采集所有研究对象空腹肘中静脉血2 mL,糖尿病患者于入院第2天进行抽血。使用罗氏Cobas 8000全自动生化分析仪检测空腹血糖、总胆固醇、三酰甘油、HDL-C、LDL-C水平;采用罗氏Cobas 8000-C702全自动生化分析仪根据免疫比浊法检测血清C3、C4水平,试剂盒购自浙江伊利康生物技术有限公司(批号:170503、170301);采用放射免疫法测定空腹胰岛素(fasting insulin,FINS)。计算稳态模型评估胰岛素抵抗(homeostasis model assessment-insulin resistance,HOMA-IR)指数,HOMA-IR=(FINS×空腹血糖)/22.5。
1.3 统计学分析 应用SPSS 19.0软件进行统计分析。计量资料以(x±s)表示,多组间比较采用方差分析,两两比较采用SNK-q检验;计数资料以例数表示,组间比较采用χ2检验;各指标间相关性采用Pearson相关系数进行分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 4组血清C3及C4水平比较 对照组、正常体质指数组、超重组、肥胖组的血清C3水平依次升高(均P<0.05)。正常体质指数组、超重组、肥胖组的血清C4水平均高于对照组(均P<0.05),但3组间差异无统计学意义(P>0.05)。见表2 。

表2 4组血清C3及C4水平的比较(x±s,g/L)
注:与对照组比较,▯P<0.05;与正常体质指数组比较,#P<0.05;与超重组比较,△P<0.05。
2.2 2型糖尿病患者血清补体水平与体质指数、血脂、HOMA-IR的相关性 2型糖尿病患者血清C3水平与HOMA-IR、体质指数呈正相关(均P<0.05),血清C4水平与体质指数、HOMA-IR无相关性(均P>0.05);血清C3、C4水平与血脂水平均无相关性(均P>0.05)。见表3。
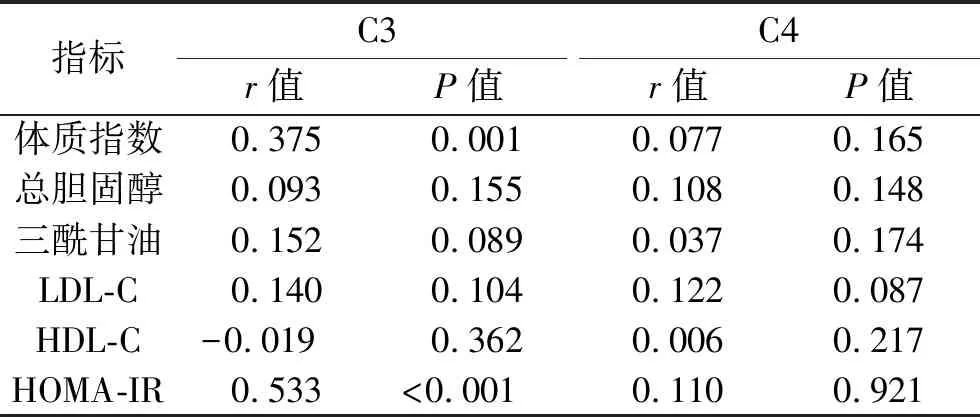
表3 2型糖尿病患者血清补体水平与体质指数、血脂、HOMA-IR的相关性
3 讨 论
补体系统是先天和(或)后天获得的免疫效应物,由30多个血浆和细胞膜蛋白组成,参与机体的特异性和非特异性免疫机制及炎症反应。近年来已有较多研究表明,肥胖、胰岛素抵抗、2型糖尿病患者均伴有免疫系统失调,处于慢性低度炎症状态,而补体系统不仅参与炎症反应,还参与调节糖脂代谢,形成复杂的免疫-内分泌网络[1-2,5],在2型糖尿病发病机制中发挥了重要作用。
补体级联反应包括凝集素途径、经典途径和旁路途径,C3是启动补体活化旁路途径并参与3个途径共同后级联反应的关键分子。除肝细胞外,内源性补体C3还来源于脂肪细胞和巨噬细胞。Barbu等[6]发现,肥胖人群的血清C3以急性期蛋白的形式显著增加,并受白细胞介素1和白细胞介素6的调节。C3裂解片段C3a-deArg具有胰岛素样作用,可促进三酰甘油的代谢,触发细胞/趋化因子反应,从而导致与肥胖相关的慢性低度炎症。Onat等[7]发现C3 mRNA在2型糖尿病肥胖患者的皮下及网膜脂肪组织中表达增高。本研究结果显示,对照组、正常体质指数组、超重组、肥胖组的血清C3水平依次升高,且2型糖尿病患者血清C3水平与体质指数呈正相关(均P<0.05),提示补体C3在2型糖尿病合并肥胖发病中发挥重要作用。
荷兰一项为期7年的队列研究结果显示,C3水平与胰岛素抵抗、糖耐量的变化呈正相关,同时血清C3基线水平对2型糖尿病发病有预测作用[8]。另外,Engström等[9]也发现,健康中年男性血清C3水平与胰岛素抵抗指数呈正相关。本研究中,2型糖尿病患者血清C3水平与HOMA-IR亦呈正相关(均P<0.05),这与上述研究结果相似。C3影响胰岛素抵抗的机制尚不明确,目前认为C3可能是作为脂肪细胞功能紊乱的标志物来调节胰岛素抵抗[8]。
脂肪细胞产生C3并激活其产生C3a和C3的蛋白水解片段-促酰化蛋白(acylation-stimulating protein,ASP),而ASP在某种程度上与胰岛素作用相似,可促进葡萄糖和脂质的贮存[10-11];ASP水平升高后其处于抵抗状态,ASP通过脂肪酸及炎症细胞因子如肿瘤坏死因子α启动,将葡萄糖和脂质重新分配到其他器官,导致肝脏和肌肉组织中的胰岛素抵抗[12-13]。但本研究结果显示,2型糖尿病患者C3水平与血脂水平并无相关性(P>0.05),这可能是因为本课题组采用空腹血检测血脂,而在机体内C3主要与餐后三酰甘油有关[12]。
补体C4是补体活化经典途径凝集素途径的重要环节。AKinlade等[14]发现,2型糖尿病可增加C4的合成,而C4水平升高可减少免疫复合物的形成,然而C4与胰岛素抵抗的相关性不明确。本研究中,2型糖尿病患者血清C4水平高于对照组(P<0.05),但与体质指数、HOMA-IR以及血脂均无相关性(P>0.05)。因此,C4在2型糖尿病合并肥胖及胰岛素抵抗的发生机制中所起的作用还需更加基础的研究来论证。
综上所述,补体C3可能在2型糖尿病合并肥胖的发病中发挥重要作用,并影响胰岛素抵抗。深入研究补体因子与2型糖尿病关系的机制,可为糖尿病治疗提供新的思路。

