酒精性肝硬化患者维生素D受体多态性与病理分期、肝功能的关系
陈城曲,熊利芬,李蜀豫
酒精性肝病是因长期摄入大量酒精所致的肝脏病变,其终末阶段为酒精性肝硬化[1]。研究表明酒精性肝硬化死亡率非常高,且发病机制非常复杂,尚未彻底明确,可能与细胞凋亡、氧应激、细胞因子、免疫介导等因素相关,未来需进一步证实[2-3]。该病尚无特效药物进行治疗,尽早诊断病情对改善预后而言至关重要,有利于缓解病情,使代偿期延长[4-5]。近年来,有研究指出维生素D受体(vitamin D receptor,VDR)多态性对肝脏疾病的评估具有一定作用,VDR是一种亲核蛋白,它能结合于维生素D活性代谢产物,并对其生物学效应进行介导[6-7]。本次研究纳入150例酒精性肝硬化患者为研究对象,分析这类患者维生素D受体多态性与病理进展、肝功能的关系,目的在于进一步了解酒精性肝硬化患者的病理进展特征,为临床治疗提供依据,改善预后,现将研究结果报道如下。
1 资料与方法
1.1 诊断标准
酒精性肝硬化:参考中华医学会肝病学分会脂肪肝和酒精性肝病学组[8]制定的《酒精性肝病诊疗指南(2010年修订版)》进行诊断:①临床症状为食欲减退、乏力、体重下降、鼻出血、牙龈出血、腹痛、营养差、肝掌等;②血常规检查提示白细胞计数下降、血小板水平下降;③病原学检查提示HDV-M/HCV-M/HBV-M呈阴性;④经彩超检查提示肝细胞破坏、肝包膜厚度增加、纤维组织增生、回声增强;⑤CT检查提示肝脏密度下降,伴有脾大、肝门变宽表现;⑥长期饮酒史,规律饮酒史≥15年,男性>40 g/d,女性>20 g/d。
1.2 一般资料
纳入我院2015年2月至2018年2月收治的酒精性肝硬化患者150例,采取回顾性分析,其中男102例,女48例,年龄42~76岁,平均(56.92±10.37)岁;病程2~8年,平均(5.42±1.69)年;Child-Pugh分级A级38例、B级58例、C级54例;血清谷丙转氨酶水平(47.53±12.75)U/L;血清总胆红素水平(15.34±7.42)μmol/L。研究方案经本院伦理委员会通过。
1.3 纳入与排除标准
1.3.1 纳入标准 ①符合上述提及的酒精性肝硬化诊断标准,临床诊断明确;②既往无自身免疫性肝病病史;③既往无药物性肝损伤、嗜肝病毒等病史;④病历资料完整;⑤入院前3个月内无抗肝硬化治疗史;⑥知情同意。
1.3.2 排除标准 ①因肝炎、药物、毒物等其他原因导致的肝硬化;②合并恶性肿瘤;③既往有精神病史、语言障碍史,无法配合研究;④除肝脏外,还合并心、肺、脑等重要脏器损害。
1.4 方法
1.4.1 检测方法 ①仪器:高速离心机、凝胶电泳槽、凝胶成像系统、恒温水浴箱、扩增仪、超净工作台。②试剂:PCR扩增试剂、无水乙醇、双蒸水、电泳级琼脂糖、淋巴细胞分离液、氯仿。③检测过程:所有患者均于入院当日采集2 ml空腹静脉血,置于抗凝管内抗凝,经离心处理后,将淋巴细胞分离,冻存备用,提取DNA。PCT引物序列:上游引物:5’-CAACCAAGACTACAAGTACCGCGTCAGTGA-3’;下游引物:5’-TGGCGGCAGCGGATGTACGTCTGC-3’。PCR反应条件:(94 ℃ 5 min、94℃ 30s、60 ℃ 1 min、72 ℃ 1 min,35个循环),72 ℃ 5 min。经凝胶成像系统对VDR基因型进行判断。BB型:缺乏相应酶切位点,825 bp;bb型:存在相应酶切位点,650 bp、175 bp;Bb型:杂合子,650 bp、175 bp、825 bp。同时进行肝组织病理学检查,取肝组织后10%福尔马林固定5 h,酒精梯度脱水2 h,二甲苯透明4 h,包埋,切片机制备厚度4 μm切片,37 ℃烤干后,72 ℃烤片3 h,采取免疫组织化学法检测肝组织内VDR表达。
1.4.2 分组方法 采取病理组织学检查进行病理组织学分期。Ⅰ期:汇管区胶原增多或扩大,轻度窦周纤维化,轻度静脉周纤维化;Ⅱ期:重度窦周纤维化,小叶内纤维分隔,中度静脉周纤维化;Ⅲ期:多数纤维间隔出现,小叶结构紊乱;Ⅳ期:早期小结节性肝硬化[9]。
1.5 观察指标
比较两组患者的VDR基因型频率,并收集两组临床特征,包括性别、年龄、病程、Child-Pugh分级、基因型以及血清白蛋白、总胆红素、谷草转氨酶、白蛋白/谷草转氨酶水平。
1.6 统计学方法
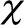
2 结果
2.1 VDR在酒精性肝硬化中表达图片
VDR在酒精性肝硬化中表达见图1,主要在细胞质中表达,呈棕黄色(箭头处),而在细胞核中基本无表达。
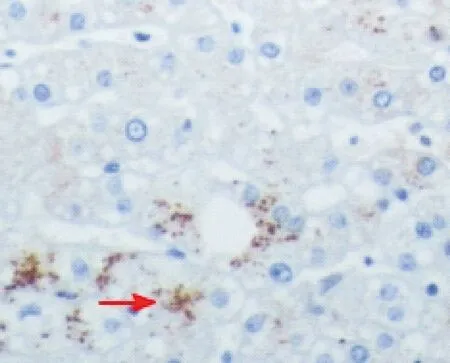
图1 VDR在酒精性肝硬化中表达(免疫组化法图,200×)
2.2 两组临床特征比较
Ⅰ~Ⅱ期组的Child-PughA级、BB基因型频率、谷丙转氨酶<40U/L占比高于Ⅲ~Ⅳ期组,差异有统计学意义(P<0.05),见表1。
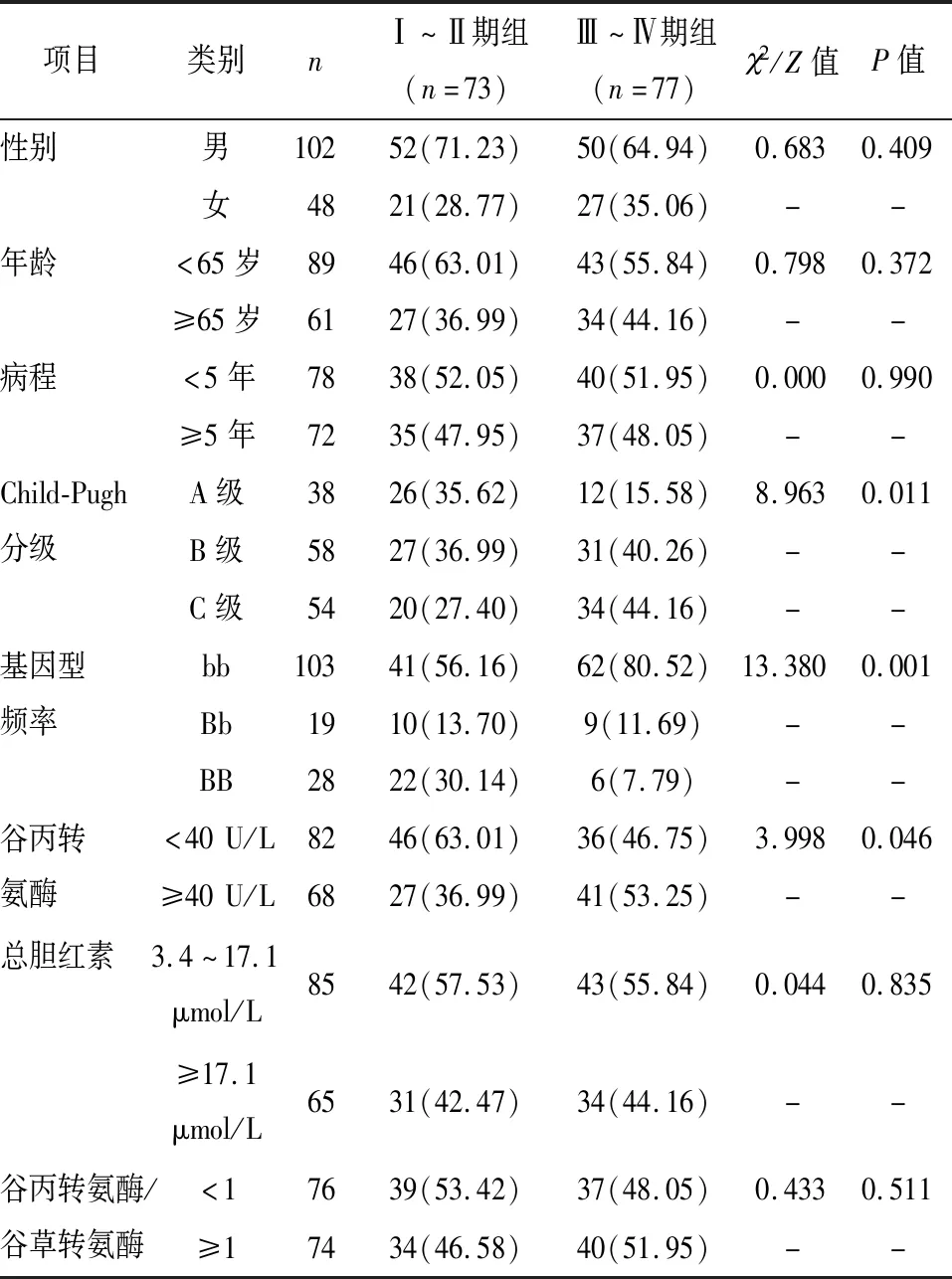
表1 两组临床特征比较 [n(%)]
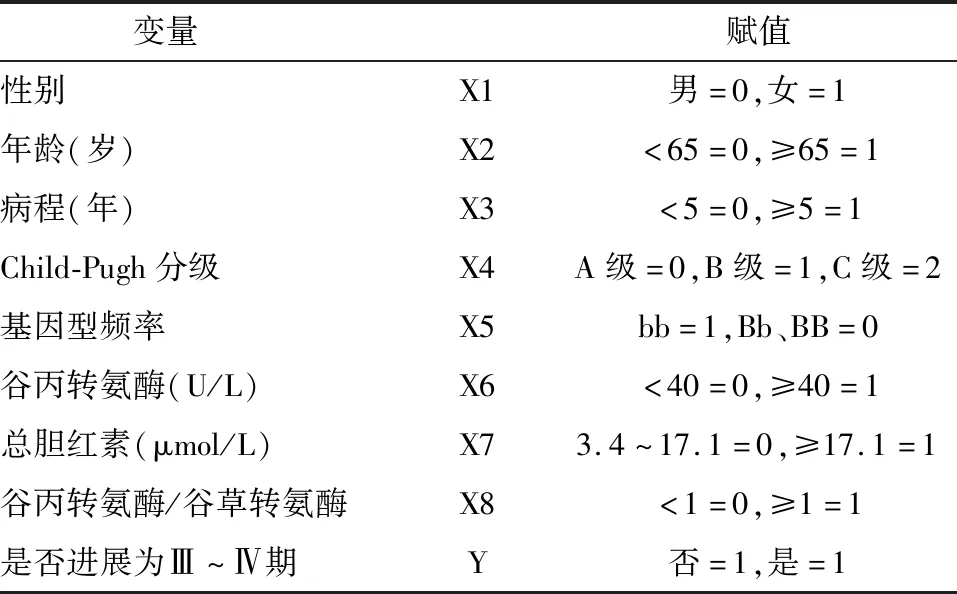
表2 量化赋值表
2.3 酒精性肝硬化患者病理进展的危险因素分析
采用Logistic回归模型对各量表进行量化赋值,见表3,将性别、年龄、病程、Child-Pugh分级、基因型频率、谷丙转氨酶、总胆红素、谷丙转氨酶/谷草转氨酶作为自变量纳入多因素分析,结果提示Child-PughC级、bb基因型频率、谷丙转氨酶≥40 U/L是酒精肝硬化病理进展的独立危险因素(P<0.05),见表3。
2.4 不同VDR基因型频率患者的肝功能指标比较
bb型基因的血清谷丙转氨酶水平高于Bb、BB型基因,差异有统计学意义(P<0.05),三组血清总胆红素、谷丙转氨酶/谷草转氨酶比较无统计学意义(P>0.05),见表4。
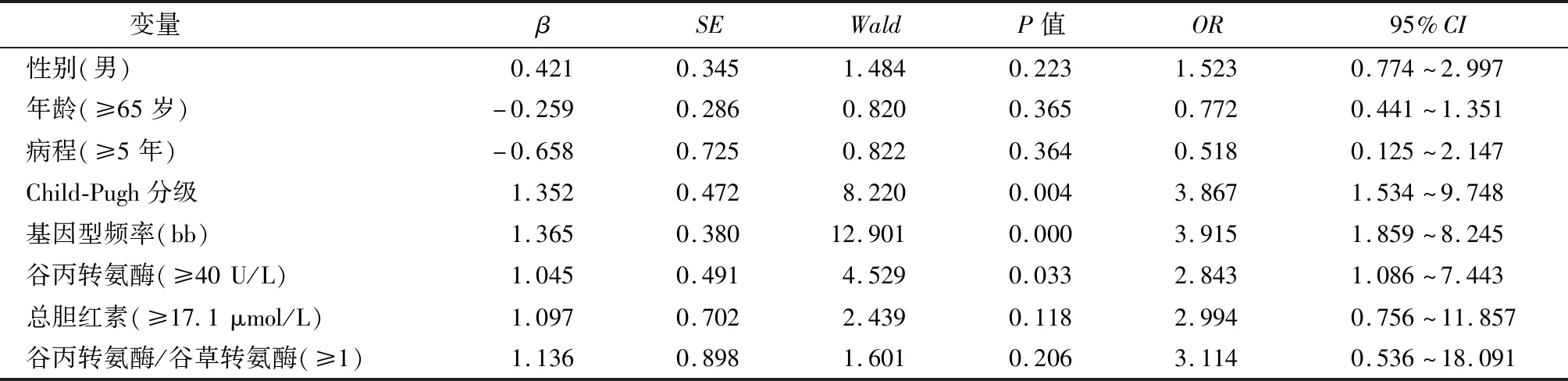
表3 酒精性肝硬化病理进展危险因素Logistic回归分析
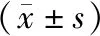
表4 不同VDR基因型频率患者的肝功能指标比较
注:与bb组比较,*P<0.05
3 讨论
酒精性肝硬化具有发病率高、死亡率高等特点,其发病与长期酗酒密切相关[10]。该病以50岁左右男性居多,早期无明显症状,伴或不伴食欲不振、牙龈出血、乏力、体重下降等表现,随着病情进展,患者会出现明显症状[11-12]。研究表明长期酗酒会减少肠粘膜叶酸吸收,与此同时,肝脏摄取量也明显下降,致使机体叶酸含量降低[13-14]。此外,长期酗酒会导致肝脏MS活性受到抑制,影响肝脏微循环,加重肝脏损害[15]。近年来,有研究认为VDR基因多态性参与了多类疾病的进展过程,如肾病、乳腺癌、前列腺癌、乙型肝炎等,并对患者预后影响非常大[16-17]。VDR在很多组织细胞内均存在,它与肾脏、肠粘膜等钙磷代谢密切相关,能调控靶基因转录,充分发挥生物学作用[18]。
本次研究针对酒精性肝硬化患者进行研究,结果提示Ⅰ~Ⅱ期患者的组bb基因型频率低于Ⅲ~Ⅳ期患者,而BB基因型频率高于Ⅲ~Ⅳ期患者,表明患者病情严重度与VDR基因多态性可能存在关联。VDR基因可能对VDRmRNA稳定性、表达水平有调节作用,从而影响VDR活性、数量的变化,使其与DNA结合能力发生改变,促进疾病进展[19-20]。1,25-(OH)2D3是机体维生素D活性形式,既往研究发现它对血磷、血钙水平有调节作用,此外,它还具有调节免疫、抗细胞增殖等功能[21]。另有研究发现它能将巨噬细胞、单核细胞激活,对淋巴细胞增殖存在抑制作用,可促使白介素-1(IL-1)、白介素-2(IL-2)、白介素12(IL-12)、γ干扰素(INF-γ)分泌减少[22]。笔者结合既往研究[23]与本次实践,认为VDR基因多态性可能通过削弱1,25-(OH)2D3的炎症、免疫调节作用,促进酒精性肝硬化患者病情进展,从而加重疾病严重度。
笔者采用Logistic回归模型,证实Child-PughC级、bb基因型频率、谷丙转氨酶≥40U/L是酒精肝硬化病理进展的危险因素。已有研究证实Child-Pugh分级、谷丙转氨酶增高与酒精性肝硬化疾病严重度相关[24],与本研究结论基本吻合。本次研究的创新之处在于证实bb基因型频率也与酒精性肝硬化病理进展密切相关。此外,通过分析患者的肝功能指标,发现bb型基因的血清谷丙转氨酶水平高于Bb、BB型基因,提示bb型基因的患者肝功能损害最重。这可能的机制在于bb基因型利用其对VDRmRNA转录的影响,从而对其功能、表达进行抑制,加重体内免疫反应,而机体部分抗原免耐受功能削弱,导致病情进展[25]。此外,有研究发现VDR基因多态性可促进1,25-(OH)2D3与VDR相结合,从而对机体免疫进行调节,进一步作用于免疫反应,影响其反应类型、反应强度,并调节炎症因子分泌[26]。另有研究提示bb型基因可导致多种炎症因子水平上调,如白介素-6(IL-6)、白介素-1(IL-1)等,这可能是bb型基因促进病理进展的机制之一[27]。
综上,本研究证实随着酒精性肝硬化患者病理进展,其bb基因型频率增高,BB基因型频率下降,且bb基因型频率增高是患者病理进展的危险因素,该基因型会加重患者肝损害程度,临床需对此引起重视,便于为疾病治疗提供依据,改善预后。本次研究的局限性在于因受纳入病例时间、研究经费的影响,导致样本量偏少,未来需扩大样本量进行更深入研究。

