灭活与非灭活条件下植物乳杆菌去除U(VI)的机理
刘金香,蒲亚帅,谢水波,刘迎九,陈子庚,李仕友*
灭活与非灭活条件下植物乳杆菌去除U(VI)的机理
刘金香1,2,蒲亚帅1,谢水波2,刘迎九1,陈子庚1,李仕友1*
(1.南华大学土木工程学院,湖南 衡阳 421001;2.南华大学污染控制与资源化技术湖南省高校重点实验室,湖南 衡阳 421001)
在不同时间,pH值和生物量浓度条件下,进行了灭活与非灭活植物乳杆菌去除水中铀的对比试验,探讨了二者去除水中铀的机理,通过SEM-EDS、FTIR、XPS及XRD分析了铀与菌体表面的微观作用机理以及菌体表面沉积物的特征.结果表明:植物乳杆菌经灭活后,其吸附铀的能力得到显著的提高,当U(VI)初始浓度为10mg/L、pH值为6.0、37℃条件下,120min内灭活菌体对U(VI)的去除率为94.7%,而活菌体的去除率为88.9%.灭活菌体具有更高的铀吸附容量,在生物量浓度为0.06~0.24mg/L,pH值(3.0~7.0)条件下,灭活菌体与活菌体的U(VI)累积容量比均大于1. SEM-EDS、FTIR分析结果表明,活细胞和灭活细胞都可通过细胞表面的羟基、酰基及羧基等官能团吸附、配位络合U(VI). XRD分析表明,活菌体可生物磷酸矿化水中的U(VI).活菌体的XRD谱图在2(18.023,25.492,27.343,40.813°处)有4个明显的磷酸铀酰晶体峰,而灭活菌体的XRD谱图显示为非晶态.XPS结果表明,活菌体可生物还原U(VI).活菌体能谱图中U4f7/2和U4f5/2 轨道出现了结合能为380.20eV和390.65eV的U(VI)分裂峰,而灭活菌体的能谱图中没有出现U(IV)的分裂峰.
植物乳杆菌;U(VI);生物吸附;矿化机理;生物还原
铀矿开采尤其是地浸采铀过程中,产生了大量的铀废渣、尾矿及放射性废水,放射性核素通过地下水向环境扩散,造成更大范围的污染,对人类的健康构成严重威胁.与传统的物理化学法相比,微生物法因具有环境友好、成本低、去除效率高等优点成为研究热点[1-2].微生物可以通过物理静电吸附除铀或利用细胞壁上的官能团通过化学离子交换、络合作用等将铀结合到细胞壁表面.微生物对铀的去除能力与细胞活性有关[3],在生物吸附去除重金属应用研究中,关于活菌体和灭活菌体选择一直存在争议.研究表明,灭活的酿酒酵母细胞比活细胞具有更好的铀吸附能力[4],然而,存在共存离子时,灭活的微生物对目标重金属离子的吸附缺乏选择性.微生物活细胞具有解毒功能,能通过代谢作用与铀形成铀酰磷酸盐矿物或者将U(VI)还原为难溶的U(IV),降低铀的迁移能力,减小铀对环境的危害[5-6].以往的研究主要关注的是微生物活性对吸附能力的影响,关于微生物活性对重金属尤其是放射性重金属的不同去除机制鲜有研究.
植物乳杆菌()是食品级益生菌,属于革兰氏阳性菌,兼性厌氧.最新研究发现乳杆菌具有吸附铅、镉、铬、铀等多种毒性重金属的特性[7-9],同时具有释磷沉淀重金属的功能[10-11].本研究对灭活及非灭活条件下植物乳杆菌去除水中U(VI)进行了对比实验研究,探讨了两种情况下乳杆菌去除铀的不同机理,以期为铀污染水的治理及利用乳杆菌减缓铀的毒性提供理论基础,同时可为铀污染水体的修复策略提供一定的理论指导.
1 材料和方法
1.1 主要试剂与分析测试方法
主要试剂:基准八氧化三铀U3O8(分析纯),标准铀溶液采用GBW04201方法配制;其他试剂均为分析纯,实验用水为超纯水.
U(Ⅵ)的测定:采用5-Br-PADAD可见光分光光度法测定微量铀[12].
pH值的测定:采用上海精密科学仪器有限公司PHS-3C型pH计.
1.2 植物乳杆菌培养和灭活
植物乳杆菌:购自中国菌种保藏中心,编号ACCC11095.
MRS培养基:酪蛋白胨,10g/L;牛肉浸取物, 10g/L;酵母提取液,5g/L;葡萄糖,20g/L;乙酸钠,5g/L;柠檬酸二胺,2g/L;吐温80,1g/L;磷酸氢二钾,2g/L;七水硫酸镁,0.2g/L;七水硫酸锰,0.05g/L.
将植物乳杆菌在MRS液体培养基中培养20h, 8000r/min离心收集细胞,用无菌去离子水洗涤3次.将洗涤的细胞重新悬浮于灭菌的去离子水中得到生物质悬浮液.取一定体积的悬浮液置于105℃的干燥箱内烘干24h,确定生物质浓度.经高压灭活(121℃,20min)后的细胞悬浮液与未灭活的细胞悬浮液均保存于4℃的冰箱内.
1.3 U(VI)去除试验
1.3.1 接触时间对U(VI)去除的影响 取一定体积的细胞悬浮液加入100mL血清瓶中,再加入一定体积的铀储备液,然后加入无菌去离子水定容为100mL,使得溶液中生物质干重为0.15g/L,U(VI)的初始浓度为10mg/L,pH值调至6.0.静置于37℃的生化培养箱内,定时取样,12000r/min离心取上清液测定溶液中U(VI)的剩余浓度. 所有实验组均设置3个平行实验,且取其数据的平均值作为实验结果.
1.3.2 pH值与生物量浓度对U(VI)去除的影响 改变溶液的pH值及细胞悬浮液的体积,重复上述实验步骤.37℃的生化培养箱内静置6h后,取样测定.
U(VI)去除率(%)和生物累积量(mg/g)按下式计算:
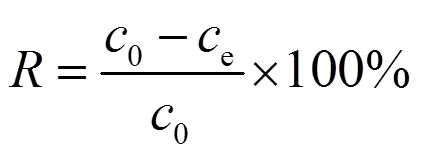
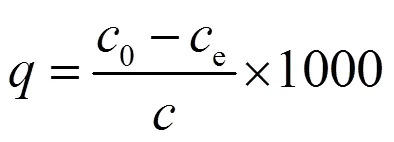
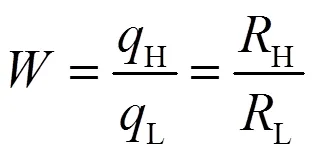
式中:0和e分别是铀细胞混合液中U(VI)的初始浓度和剩余浓度,mg/L;是细胞对U(VI)的生物吸附量,mg/L;是植物乳杆菌的浓度,mg/L;H和L分别是灭活细胞和活细胞对U(VI)的累积容量,mg/L;是U(VI)的去除率;H和L分别是热灭活细胞和活细胞对U(VI)的去除率;是灭活细胞与活细胞对于U(VI)的累积容量比或去除率比.
1.4 表征试验
1.4.1 扫描电镜-能谱(SEM-EDS)表征 试验中U(VI)浓度为100mg/L,植物乳杆菌活细胞及热灭活细胞的浓度为2.7g/L.温度为37℃,接触时间6h. 8000r/min离心10min收集细胞,用0.1mol/L氯化钠溶液(非磷酸盐缓冲液以避免外界磷的添加形成铀酰-磷酸盐沉淀)洗涤3次去除细胞杂质并保持细胞渗透压,用2.5%戊二醛在4℃下(配置使用生理盐水而非磷酸盐缓冲液)固定2h.再次用0.1mol/L氯化钠溶液洗涤,之后每次在4℃分级乙醇(20%,50%,80%)中脱水15min,100%乙醇脱水30min,用纯乙酸异戊酯处理样品2h.再将样品分别置于-20,-50,-80℃各12h,于冷冻干燥器中干燥12h.将样品置于扫描电镜(德国蔡司公司,Sigma)与X射线能谱仪(德国布鲁克公司,Oxford-AZTECx-Max80)下观察细胞形态变化和细胞表面元素变化.
1.4.2 红外光谱(FTIR),X射线衍射(XRD),光电子能谱(XPS)表征分析 将上述方法离心收集的细胞用0.1mol/L氯化钠溶液洗涤3次后,置于-50℃冰箱12h,冷冻干燥器干燥12h.制成样品. 利用傅里叶红外光谱仪(美国赛默飞世尔科技公司Nicolet-460),通过峰位、峰强及峰形的变化分析灭活与非灭活植物乳杆菌结合铀过程中细胞表面的主要作用官能团;利用X射线衍射仪(德国布鲁克公司D8- ADVANCE),通过图谱中晶体峰的间距比照分析活菌体与灭活菌体表面铀沉积物类别;利用X射线光电子能谱仪(美国赛默飞世尔科技公司Escalab 250Xi),通过分峰软件分析沉积物中铀元素的价态.
2 结果与讨论
2.1 时间对灭活与非灭活植物乳杆菌去除U(VI)的影响
如图1所示,反应初期,活细胞与灭活细胞均能快速去除溶液中的U(VI),20min 内,灭活菌体对U(VI)的去除率达92.1%,而活菌体的去除率为82.3%.由于活细胞在高压灭菌过程中细胞产生形变,表面变粗糙,细胞与铀酰离子的接触面积增大,有效作用位点增加,因此反应初期灭活细胞对铀的吸附效果明显优于活细胞.随着接触时间的延长,灭活菌体对U(VI)的吸附速率在120min时平衡,吸附去除率达94.7%;而活性菌体对铀的去除速率随着时间的延长一直慢速增加,在360min时平衡,U(VI)的去除率达94.1%.这是由于灭活细胞对铀的去除是一个代谢独立的快速吸附过程,主要通过菌体表面的物理静电作用和细胞壁的官能团与金属离子的配位络合、离子交换等物理化学吸附作用[2].而活菌体是一个依赖于代谢的缓慢过程,需要菌体细胞代谢调控系统的参与,主要通过细胞内酶作用进行重金属的胞内转移,生物胞内累积.此外有些微生物可以通过缓慢代谢作用对U(VI)进行矿化和还原[5].
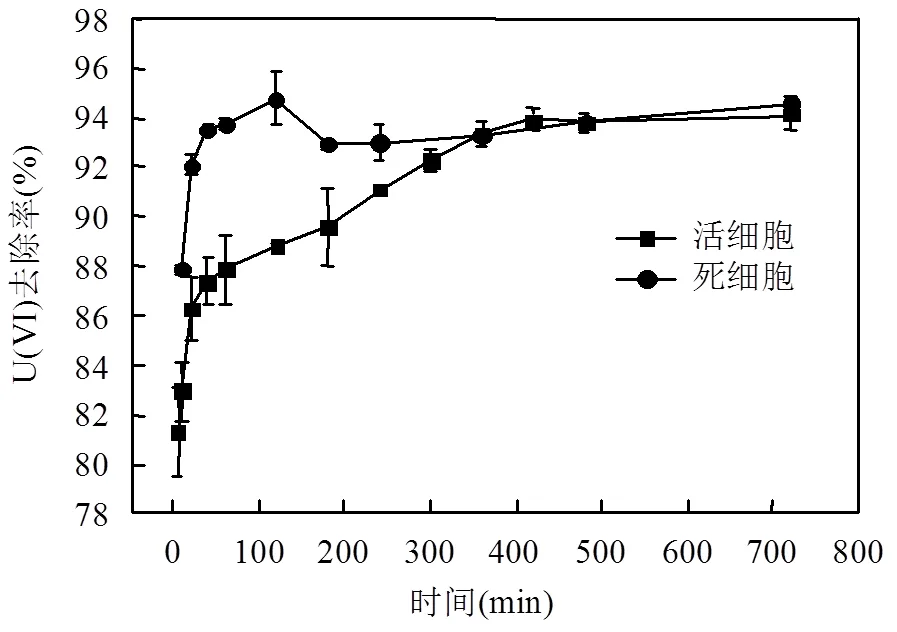
图1 吸附时间对灭活和非灭活植物乳杆菌去除U(VI)的影响
为进一步探讨活细胞与灭活细胞对U(VI) 的吸附机理,运用3种动力学模型(准一级动力学模型,准二级动力学模型和颗粒内扩散模型)对实验数据进行了拟合,拟合结果见表1.活细胞与灭活细胞对U(VI)的吸附均符合准二级动力学方程(2>0.99).说明活细胞和灭活细胞对U(VI)的吸附以化学吸附为主,铀主要通过化学键合作用结合在细胞表面,涉及铀酰离子与菌体表面活性位点的电子共用和电子转移.颗粒内扩散模型拟合结果常数项不为零,表明颗粒内扩散不是主要的速控步骤,活细胞和灭活细胞对U(VI)的吸附过程均为多种机理共同作用的结果.
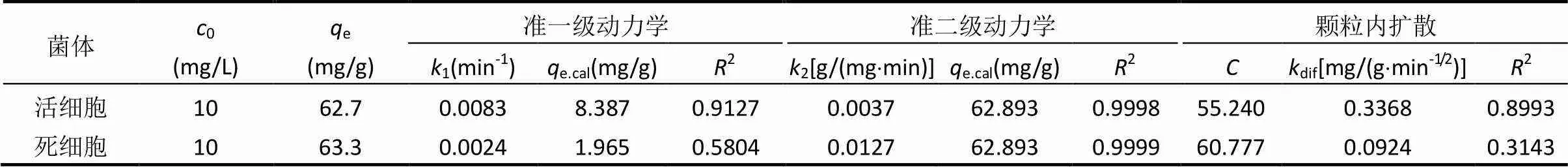
表1 灭活与非灭活植物乳杆菌吸附U(VI)的动力学模型参数
2.2 pH值对灭活与非灭活植物乳杆菌去除U(VI)的影响
溶液的pH值不仅影响活细胞和死细胞表面电荷位点分布和U(VI)在水中的水解及其络合形态,还会影响生物吸附剂表面官能团的结构与性能,进而影响到U(VI)的去除率[8].本实验研究了灭活与非灭活2种条件下,溶液初始pH值(3~7)对植物乳杆菌去除U(VI)的影响.结果如图2.pH值对活细胞和灭活细胞去除U(VI)的效果均有不同程度的影响,当溶液中pH值从3.0增至6.0时,活细胞对U(VI)的吸附率从60.0%提高到81.9%,灭活细胞对U(VI)的吸附率从64.6%提高至85.7%;当pH值继续增至7.0时, 活细胞对U(VI)的吸附率从81.9%降至72.8%,而灭活细胞仅从86.7%降至83.2%.pH值为3~7时,灭活细胞对U(VI)的吸附去除率均高于活细胞,且活细胞对pH值的变化更敏感,这可能是由于pH值的改变导致活细胞的活性及代谢水平的降低,对活细胞内的重金属还原酶(如细胞色素C、还原酶等)和矿化酶(酸性磷酸酶)的活性产生不利影响,减缓了U(VI)的矿化和还原作用,进而对U(VI)的去除产生更加显著的影响[13-14].
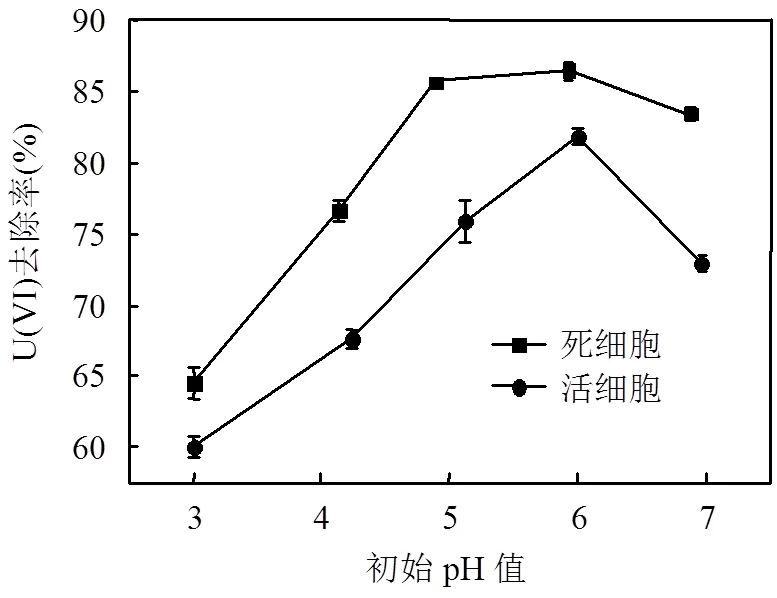
图2 pH值对灭活和非灭活植物乳杆菌去除U(VI)的影响
2.3 生物量对灭活与非灭活植物乳杆菌去除U(VI)的影响
由图3可知,在生物量浓度分别为0.06,0.12, 0.24mg/L条件下,改变溶液中的pH(3.0~7.0),灭活细胞与活细胞的U(VI)累积容量比均大于1,说明植物乳杆菌灭活细胞对U(VI)的累积容量比活细胞的高.这是因为菌体在热灭活过程中损坏了细胞膜,增强了细胞膜通透性,细胞产生形变,表面变粗糙,细胞与铀酰离子的接触面积增大,有效作用位点增加,从而提高了灭活细胞的U(VI)吸附容量.由图3可看出,生物量浓度由0.06mg/L增加至0.12mg/L时,值差异明显,继续增至0.24mg/L时,值差异明显减小.由于菌体浓度增加,失去活性的灭活细胞更易发生团聚,影响灭活细胞与U(VI)结合的有效作用位点,U(VI)吸附量增加较少,而活细胞生物量的增加,与U(VI)作用的菌体数量逐渐增加,U(VI)吸附量增加较多,因此,随着生物投量的增加,灭活细胞与活细胞对U(VI)的累积容量比值差异变小[6,13].在菌体浓度较低时,灭活细胞比活细胞更适合于处理低浓度含铀废水.
在pH值较低时,灭活细胞与活细胞对U(VI)的吸附量比差异较小,表明灭活细胞和活细胞的U(VI)吸附能力相差不明显.在中度酸性(pH4.0~5.0)条件下,灭活细胞与活细胞对U(VI)的累积容量比相差显著,表明灭活细胞的U(VI)吸附能力比活细胞的更强.一方面可能是由于pH值的改变导致了植物乳杆菌活细胞的代谢发生变化,与U(VI)的作用机理发生变化,另一方面也可能与pH值改变后溶液中U(VI)存在形态的改变有关[8].说明在pH值为4.0~5.0时,灭活细胞比活细胞更适合处理低浓度含铀废水.
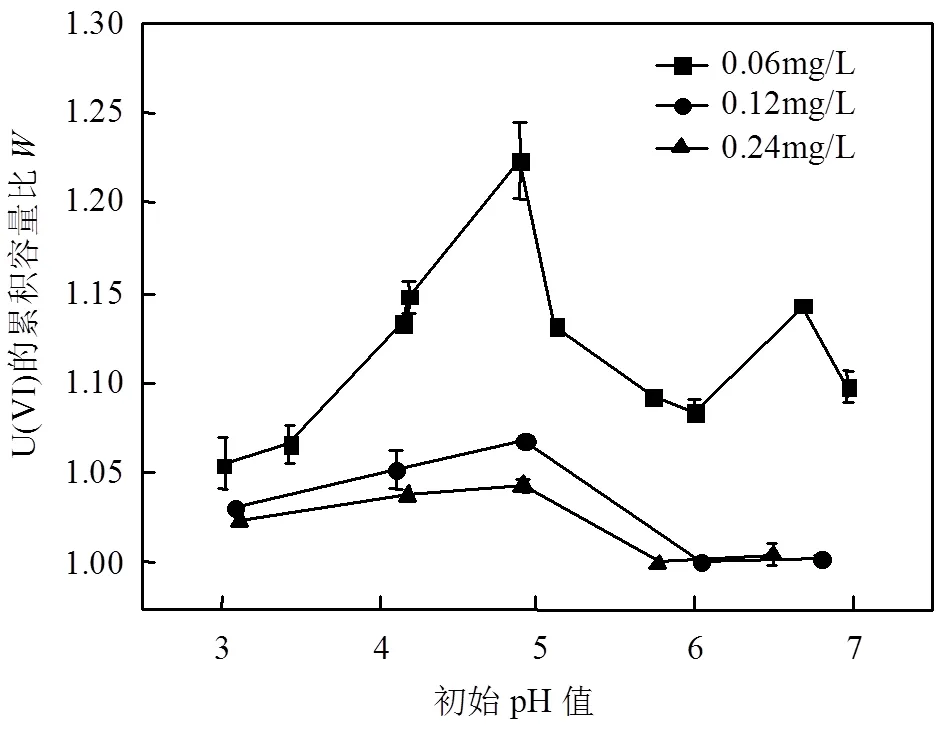
图3 不同pH值和生物量下植物乳杆菌活细胞与灭活细胞对U(VI)的累积容量比
2.4 SEM-EDS结果分析
图4为植物乳杆菌吸附U(VI)前后的扫描电镜图,其中活细胞(图4a)表面平滑,整体呈杆状;而经高温高压灭菌处理后,灭活细胞(图4c)表面变粗糙,有絮状毛层,比表面积增大,这是由于植物乳杆菌细胞表面具有胞外聚合物,主要由多糖和蛋白质组成还具有少量的磷脂,在高温环境中蛋白质发生变性[15-16].
植物乳杆菌与水中U(VI)接触6h后,无论是活细胞还是灭活细胞表面都有明显的铀沉积物 (图4b和图4d),且灭活细胞(图4d)表面U(VI)的累积量明显多于活细胞(图4b)表面U(VI)的累积量,这证实了活细胞的U(VI)累积容量比灭活细胞的低.活细胞表面出现了纳米级球形颗粒状的铀沉淀(图4b中红色圈)及不规则的凝胶块状铀沉淀,而灭活的植物乳杆菌死细胞表面只出现了凝胶块状的铀沉积物,铀沉积形态的差异说明植物乳杆菌活细胞对水中U(VI)的去除作用可能包括非吸附机理(可能为U(VI)的矿化或还原).

图4 植物乳杆菌活细胞及灭活细胞吸附U(VI)前后的扫描电镜图
(a)吸附U(VI)前的活细胞 (b)吸附U(VI)后的活细胞 (c)吸附U(VI)前的灭活细胞 (d)吸附U(VI)后的灭活细胞
(a)活细胞吸附U(VI)后; (b)灭活细胞吸附U(VI)后
灭活与非灭活两种条件下,细胞吸附U(VI)后的EDS能谱图如图5,可以看出,灭活细胞EDS光谱中的铀峰比活细胞更明显,说明灭活细胞表面有更高的铀结合量(灭活细胞铀结合量重量百分比高达17.31,而活细胞铀结合量仅为4.29),说明细胞灭火活后对U(VI)的吸附能力更强,适合作为生物吸附剂.
2.5 FTIR结果分析
植物乳杆菌活细胞吸附U(VI)前(图6b)后(图6c)及灭活细胞吸附U(VI)前(图6a)后(图6d)的红外光谱如图6所示.活细胞与U(VI)作用后,部分峰的峰位、强度及峰形发生了变化.3430.51cm-1处的羟基(—OH)的振动峰[16-17],1650.60cm-1处的蛋白质酰胺I带(C=O,C—N)振动峰,1541.85cm-1处的蛋白质酰胺II带(N—H,C—N)的振动峰[17]与1234.70cm-1处的蛋白质酰胺III带中羧基中的(C—O—C)的弯曲振动和(C—PO32-)中的(P=O)的伸缩振动峰[13,19]的峰位均向低波位数移动,峰强增加,峰形变宽;1059cm-1处的脂羰基(C—O—C)的伸缩振动、脂肪族胺(C—N)的伸缩振动及磷酸酯基的(P—O—C)的反对称伸缩振动,峰位未发生变化,但振动峰强增加,峰型变宽[20].550~1000cm-1范围内峰的位置和强度的变化可归因于铀酰离子的不对称伸缩振动和U(VI)与O缔合后的伸缩振动[21].其中915.91cm-1处出现的新峰归因于铀酰离子的不对称拉伸振动[1,13].峰位、强度和峰形的变化表明活细胞表面的羟基、酰胺、羧基、脂羰基、磷酸酯基等官能团在铀结合过程中起重要作用.
灭活细胞与U(VI)作用后,羟基、酰胺、羧基等基团特征峰的峰位、峰强及峰宽均发生了变化. 3422.04,1650.54,1541.09,1232.75cm-1处的特征峰移动至3406.03,1652.94,1538,1233.47,917.45cm-1出现的新峰为铀酰离子的不对称伸缩振动.与活细胞的特征峰(羟基3430.51cm-1,酰胺II带1541.85cm-1,酰胺III带1234.70cm-1)相比,灭活细胞特征峰(羟基3422.04cm-1,酰胺II带1541.09cm-1,酰胺III带1232.75cm-1)的峰位和强度发生了改变.这表明细胞灭活过程中蛋白质结构受到了破坏.由于灭活细胞比活细胞能吸附更高量的铀,与活细胞的振动峰(图6c)相比,相应的灭活细胞振动峰(图6d)强度更高.
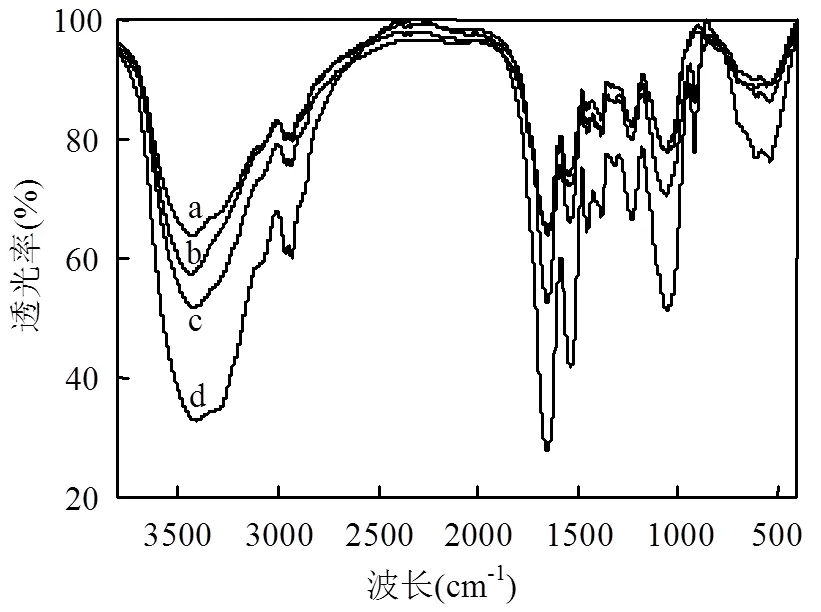
图6 植物乳杆菌灭活细胞和活细胞吸附U(VI)前后的红外光谱图
(a)灭活细胞吸附U(VI)前; (b)活细胞吸附U(VI)前; (c)活细胞吸附U(VI)后; (d)灭活细胞吸附U(VI)后
2.6 XRD结果分析
从图7中观察到,活细胞与铀作用前(图7c)后(图7d)的XRD图谱差异明显;活细胞的XRD图谱显示为非晶态,而接触铀后活细胞的XRD图中发现有明显的晶体峰.相反,灭活细胞与铀作用前(图7a)后(图7b)的XRD图谱均显示为非晶态,未出现显著的晶体峰.活细胞接触铀后的XRD图谱(图7d)在2(18.023, 25.492,27.343,40.813°)处显示出4个不同的峰,分别对应于4.9178,3.491,3.259,2.209Å的晶面间距值.这些间距值与已知化合物数据文件(与ICDD数据库(ICDD,2003)匹配比对, PDF)的比较显示为磷矿物[PDF#35-0194,磷酸铀酰水合物(UO2)3(PO4)2×H2O, PDF#29-0670,氢铀云母H2(UO2)2(PO4)2×8H2O, PDF#29-1284,变钠磷铀云母Na[(UO2)(PO4)]×3H2O] (图8a~c).这说明植物乳杆菌活细胞与U(VI)作用可能形成了晶态磷酸铀酰化合物,在相同条件下的灭活细胞与U(VI)接触后,表面却没有检测到铀的结晶峰,表明植物乳杆菌对U(VI)的生物矿化作用依赖于活细胞的代谢.植物乳杆菌可以产生磷酸酶,且能在降解有机物的同时释放结合的磷酸盐和聚磷酸盐[10,22]. Choudhary等[23]发现铜绿假单胞菌J007将U(VI)矿化为磷酸铀酰化合物.Nedelkova等[24]发现,在铀协迫下微杆菌属(spp.)能释放磷酸盐形成磷酸铀酰沉淀以抵抗铀的毒性.因此推测植物乳杆菌具有类似的功能,当环境中存在铀时,植物乳杆菌活细胞内的磷酸酶发挥作用,细胞代谢产生磷酸盐,促进U(VI)的矿化沉淀,降低环境中的U(VI)浓度.
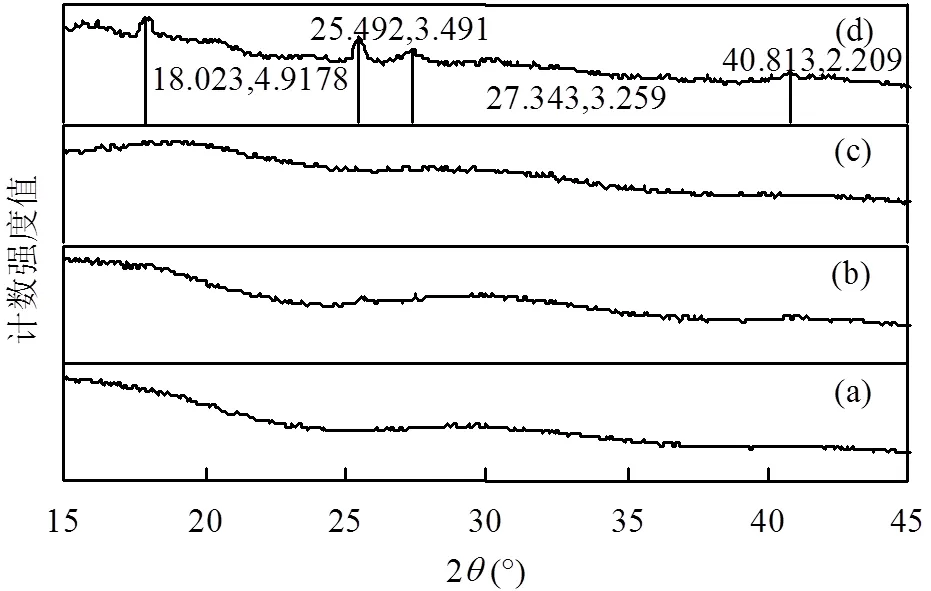
图7 植物乳杆菌活细胞与灭活细胞吸附U(VI)前后的X射线衍射谱图
(a)灭活细胞吸附U(VI)前; (b)灭活细胞吸附U(VI)后; (c)活细胞吸附U(VI)前; (d)活细胞吸附U(VI)后
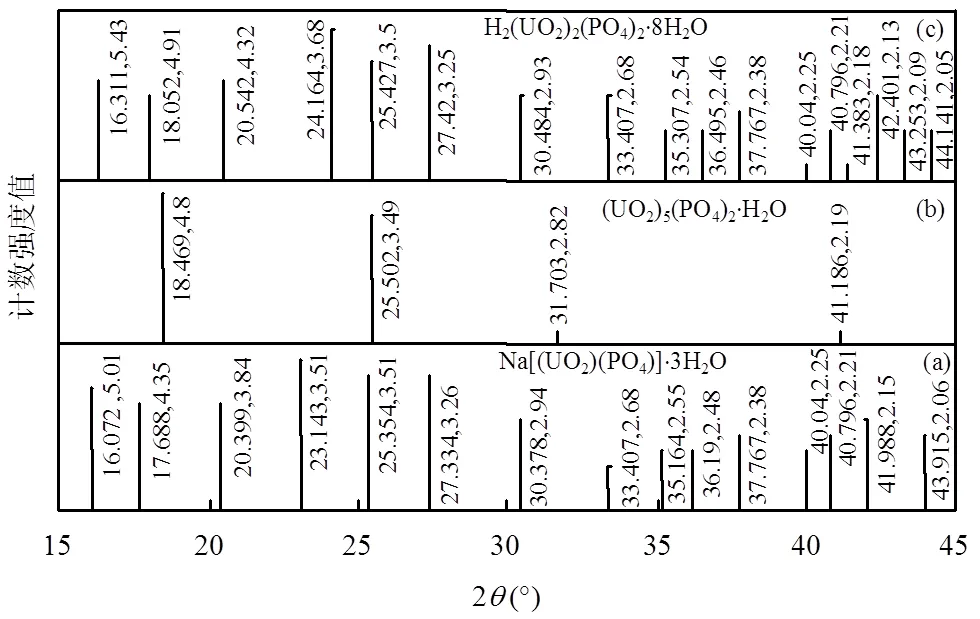
图8 吸附U(VI)的植物乳杆菌活细胞的晶体峰对应的磷酸铀酰化合物PDF卡片
2.7 XPS结果分析
在无氧条件下奥奈达希瓦氏菌可以将U(VI)还原为U(IV)[25],微氧条件下酿酒酵母菌可以将U(VI)还原为U(IV)[13],植物乳杆菌可以将Fe3+还原为Fe2+[26],然而植物乳杆菌能否将U(VI)还原为U(IV),目前还未见报道.运用XPS对植物乳杆菌表面沉积物中铀的价态进行分析,结果如图9所示.由XPS手册得知,381.90,392.65eV附近的强峰分别对应U(VI)的自旋轨道(L-S)分裂峰U4f7/2和U4f5/2[27-28].而在380.20,390.95eV附近则发现了U(IV)的自旋轨道U4f7/2和U4f5/2的分裂峰[29-30].图9a、图9b分别为非灭活和灭活条件下的植物乳杆菌与铀接触后的能谱图,从图9可知,植物乳杆菌活细胞表面的沉积物中存在四价铀和六价铀两种价态,而灭活植物乳杆菌细胞表面只有六价铀.这表明植物乳杆菌活菌对U(VI)具有还原作用,而灭活的植物乳杆菌对U(VI) 没有还原作用.植物乳杆菌还原U(VI)的特性对于阻止U(VI)在环境中的迁移具有重要意义.
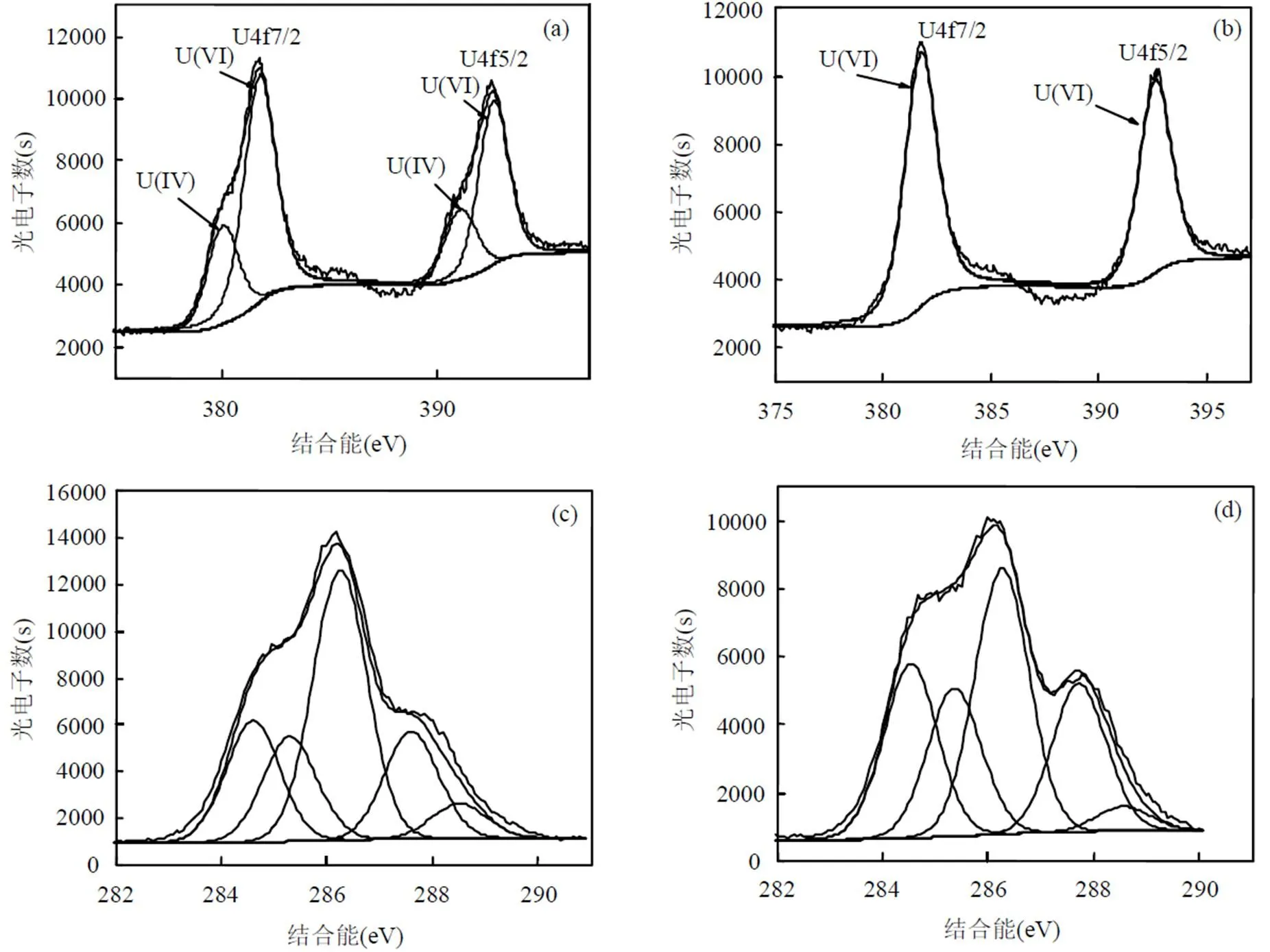
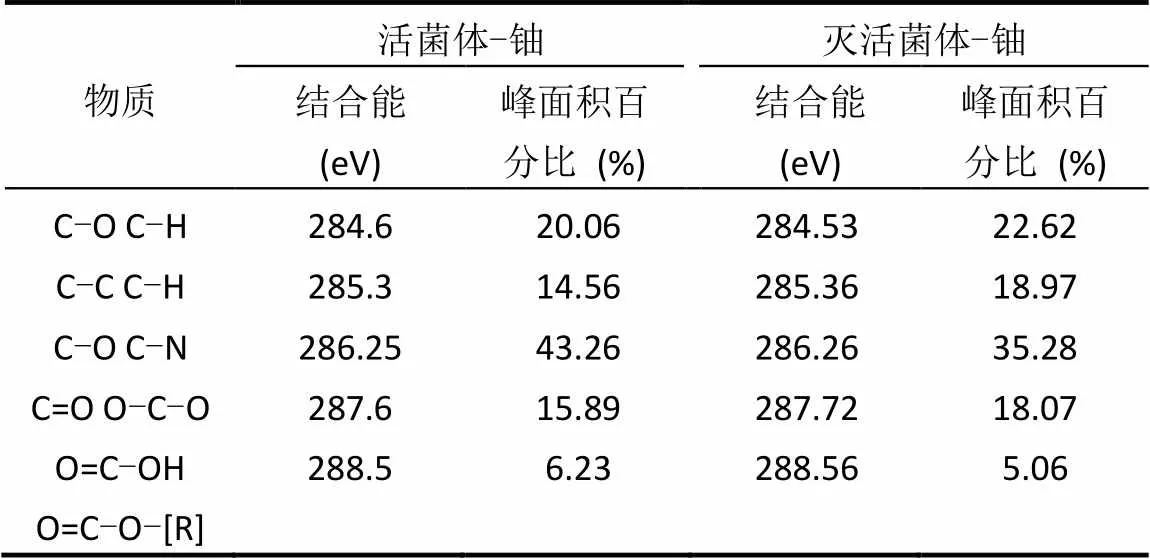
图9 植物乳杆菌活细胞与灭活细胞吸附U(VI)后的XPS分析图 Fig.9 XPS analysis spectra of live and killed Lactobacillus plantarum after adsorption of U(VI)(a)活细胞吸附U(VI)后U元素的能谱图; (b)灭活细胞吸附U(VI)后U元素的能谱图; (c)活细胞吸附U(VI)后C元素的能谱图; (d)灭活细胞吸附U(VI)后C元素的能谱图
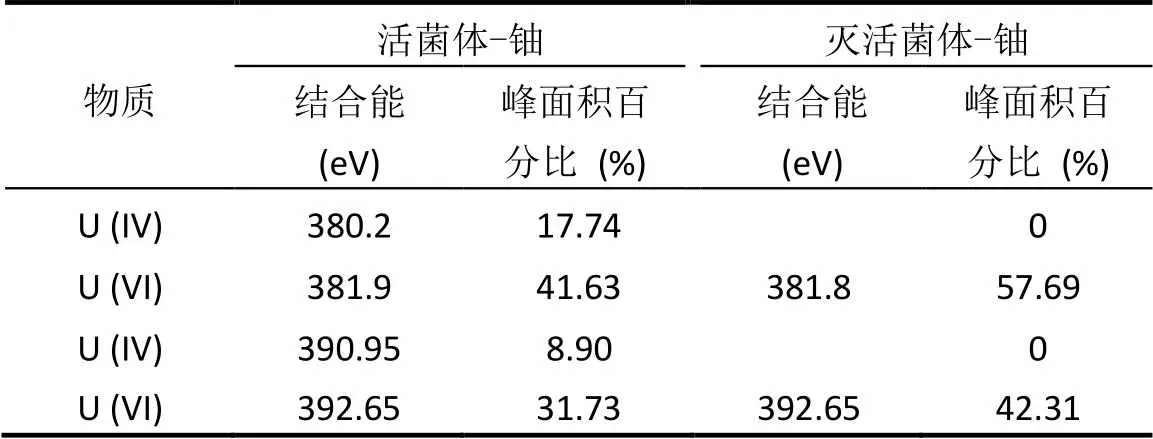
表2 植物乳杆菌活细胞和灭活细胞吸附的U和C元素的参数
续表2
灭活(图9d)与非灭活(图9c)植物乳杆菌吸附U(VI)后C元素的精细XPS谱图(C1s),数据分析结果见表2.活细胞的C1s光谱的峰1,2和3对应于284.6eV(C—O C—H)、285.3eV(C—C C—H)、286.25eV (C—O C—N),这些峰归因于醇、胺或酰胺;4对应于287.6eV(C=O O—C—O)归因于羧酸酯和酰胺;5对应于288.5eV(O=C—CH O=C—O—[R])归因于羧基或脂官能团[13-14,31].活细胞和灭活细胞能谱图的不同是峰值2,3,4(C1s)的面积百分比的变化,这些峰的相对强度和位置的变化表明,官能团如酰胺基或羧酸酯官能团对热灭活细胞的高吸附能力具有重要影响.
2.8 灭活与非灭活植物乳杆菌对U(VI)的生物去除机制
活细胞对水中U(VI)的去除是有代谢作用的吸附.植物乳杆菌表面的静电作用及官能团(如酰胺基,羟基,羧基、磷脂基等)的络合配位等作用与铀酰离子结合,活细胞通过代谢释放磷酸盐沉淀水溶液中的U(VI)或通过细胞表面的还原酶将可溶解态的U(VI) 还原为难溶态的U(IV),在菌体表面形成了鳞片状的磷酸铀酰沉淀,从而减缓铀对细胞的毒性.植物乳杆菌的这种代谢富集机制对于阻止水体中放射性核素的迁移具有重要意义.
灭活细胞对U(VI)的去除是非代谢性的生物吸附作用.灭活菌体通过细胞表面的静电吸附,细胞表面蛋白质或多糖的羟基、蛋白质酰胺基以及羧基、磷酸脂基等络合配位作用与铀酰离子结合.细胞表面结合的铀呈凝胶块状沉淀.灭活过程导致蛋白质,核酸等大分子物质的破坏,细胞形状发生变化,表面粗糙,增大了比表面积,从而增加了热灭活植物乳杆菌的U(VI)生物吸附能力.灭活植物乳杆菌是一种合适的铀生物吸附剂.
3 结论
3.1 灭活与非灭活条件下,植物乳杆菌均可以去除U(VI),灭活细胞吸附U(VI)的能力要高于活细胞.在U(VI)的初始浓度为10mg/L、pH值为6.0、37℃, 120min条件下,灭活菌体的U(VI)去除率达94.7%,活菌体为88.9%.溶液的pH值对活菌体和灭活菌体去除铀的效果有显著影响.pH值为3.0~6.0时,活菌体与灭活菌体对铀的去除率与pH值呈正相关, pH6.0~7.0时,呈负相关.
3.2 与活菌体相比,灭活菌体具有更高的铀吸附容量.在生物量浓度为0.06~0.24mg/L,pH值(3.0~7.0)条件下,灭活菌体与活菌体的U(VI)累积容量比均大于1.
3.3 植物乳杆菌活细胞和灭活细胞表现出不同的U(VI)去除机理.活细胞可以通过吸附、配位络合、生物矿化、生物还原等多种机制去除水中的U(VI);而灭活细胞仅通过单纯的物理化学吸附去除水中的U(VI).
[1] Wang X, Wang T, Zheng X, et al. Isotherms,thermodynamic and mechanism studies of removal of low concentration uranium (VI) by Aspergillus niger. [J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 2017,75(12): 2727-2736.
[2] 黄 荣,覃贻琳,聂小琴,等.大肠杆菌与水体中U(Ⅵ)的作用行为和产物研究[J]. 中国环境科学, 2016,36(6):1780-1787. Huang R, Qin Y, Nie X, et al. The adsorption mechanism and adsorptive products of Escherichia coli and uranium(VI) in water. [J]. China Environmental Science, 2016,36(6):1780-1787.
[3] Soares E V, Coninck G D, Duarte F, et al. Use of Saccharomyces cerevisiae for Cu2+removal from solution: the advantages of using a flocculent strain [J]. Biotechnology Letters, 2002,24(8):663-666.
[4] Lu X, Zhou X J, Wang T S. Mechanism of uranium(VI) uptake by Saccharomyces cerevisiae under environmentally relevant conditions: batch, HRTEM, and FTIR studies. [J]. Journal of Hazardous Materials, 2013,262(8):297-303.
[5] Kulkarni S, Misra C S, Gupta A, et al. Interaction of Uranium with Bacterial Cell Surfaces: Inferences from Phosphatase-Mediated Uranium Precipitation [J]. Applied & Environmental Microbiology, 2016,82(16):4965-4974.
[6] 王永华,谢水波,刘金香,等.奥奈达希瓦氏菌MR-1还原U(VI)的特性及影响因素[J]. 中国环境科学, 2014,34(11):2942-2949. Wang Y, Xie S, Liu J, et al. Characteristics of reducing U(VI) by Shewanella oneidensis MR-1and its impact factors. [J]. China Environmental Science, 2014,34(11):2942-2949.
[7] Yin R, Zhai Q, Yu L, et al. The binding characters study of lead removal by. CCFM8661 [J]. European Food Research & Technology, 2016,242(10):1621-1629.
[8] Takehiko Tsuruta. Removal and recovery of uranium using microorganisms isolated from Japanese uranium deposits [J]. Journal of Nuclear Science & Technology, 2006,43(8):896-902.
[9] 翟齐啸.乳酸菌减除镉危害的作用及机制研究[D]. 无锡:江南大学, 2015. Zhai Q. Effects of lactic acid bacteria against cadmium toxicity and the involved protective mechanisms [D]. Wuxi: Jiangnan University, 2015.
[10] Zamudio M, González A, Medina J A., phytase activity is due to non-specific acid phosphatase [J]. Letters in Applied Microbiology, 2001,32(3):181.
[11] Zhang Y, Xu D, Zhao X, et al. Biodegradation of two organophosphorus pesticides in whole corn silage as affected by the cultured. [J]. Biotech, 2016,6(1):73.
[12] HJ 840-2017 环境样品中微量铀的分析方法[S]. HJ 840-2017 Analytical method for trace uranium in environmental samples [S].
[13] Wang T, Zheng X, Wang X, et al. Different biosorption mechanisms of Uranium(VI) by live and heat-killed Saccharomyces cerevisiae under environmentally relevant conditions. [J]. Journal of Environmental Radioactivity, 2017,167:92-99.
[14] Hufton J, Harding J H, Romero-González M E. The role of extracellular DNA in uranium precipitation and biomineralisation [J]. Physical Chemistry Chemical Physics, 2016,18(42):29101-29112.
[15] Pingitore E V, Pessione A, Fontana C, et al. Comparative proteomic analyses for elucidating metabolic changes during EPS production under different fermentation temperatures by, Q823 [J]. International Journal of Food Microbiology, 2016,238:96- 102.
[16] Ji W, Xiao Z, Zheng T, et al. Characterization of an exopolysaccharide produced byYW11isolated from Tibet Kefir [J]. Carbohydrate Polymers, 2015,125:16-25.
[17] Liu M, Dong F, Yan X, et al. Biosorption of uranium by Saccharomyces cerevisiae and surface interactions under culture conditions. [J]. Bioresource Technology, 2010,101(22):8573-8580.
[18] Gerbino E, Mobili P, Tymczyszyn E, et al. FTIR spectroscopy structural analysis of the interaction between Lactobacillus kefir, S-layers and metal ions [J]. Journal of Molecular Structure, 2011, 987(1):186-192.
[19] Gerbino E, Carasi P, Araujo-Andrade C, et al. Role of S-layer proteins in the biosorption capacity of lead by Lactobacillus kefir [J]. World Journal of Microbiology & Biotechnology, 2015,31(4):583-592.
[20] Pan X, Chen Z, Chen F, et al. The mechanism of uranium transformation from U(VI) into nano-uramphite by two indigenous Bacillus thuringiensis, strains [J]. Journal of Hazardous Materials, 2015,297:313-319.
[21] Martins M, Faleiro M L, Costa A M R D, et al. Mechanism of uranium (VI) removal by two anaerobic bacterial communities. [J]. Journal of Hazardous Materials, 2010,184(1-3):89.
[22] Zeng X, Xia W, Wang J, et al. Technological properties of Lactobacillus plantarum, strains isolated from Chinese traditional low salt fermented whole fish [J]. Food Control, 2014,40(2):351-358.
[23] Choudhary S, Sar P. Uranium biomineralization by a metal resistant Pseudomonas aeruginosa strain isolated from contaminated mine waste. [J]. Journal of Hazardous Materials, 2011,186(1):336-343.
[24] Nedelkova M, Merroun M A, Hennig C, et al. Microbacterium isolates from the vicinity of a radioactive waste depository and their interactions with uranium [J]. Fems Microbiology Ecology, 2007,59(3): 694–705.
[25] Liu J X, Xie S B, Wang Y H, et al. U(VI) reduction by Shewanella oneidensis, mediated by anthraquinone-2-sulfonate [J]. Transactions of Nonferrous Metals Society of China, 2015,25(12):4144-4150.
[26] Szöllősi A, Rezessy-Szabó J M, Hoschke Á, et al. Novel method for screening microbes for application in microbial fuel cell [J]. Bioresource Technology, 2015,179(179C):123-127.
[27] Salomone V N, Meichtry J M, Zampieri G, et al. New insights in the heterogeneous photocatalytic removal of U(VI) in aqueous solution in the presence of 2-propanol [J]. Chemical Engineering Journal, 2015, 261:27-35.
[28] 谢水波,陈 胜,马华龙,等.硫酸盐还原菌颗粒污泥去除U(Ⅵ的)影响因素及稳定性[J]. 中国有色金属学报, 2015,25(6):1713-1720. Xie S, Chen S, Ma H, et al. Influence factors and stability of U(Ⅵ) removal by sulfate reducing bacteria granular sludge [J]. The Chinese Journal of Nonfer rous Metal, 2015,25(6):1713-1720.
[29] Goldik J S, Nesbitt H W, Noël J J, et al. Surface electrochemistry of UO in dilute alkaline hydrogen peroxide solutions [J]. Electrochimica Acta, 2004,49(11):1699-1709.
[30] Senanayake S D, Soon A, Kohlmeyer A, et al. Carbon monoxide reaction with UO[sub 2](111) single crystal surfaces: A theoretical and experimental study [J]. Journal of Vacuum Science & Technology A Vacuum Surfaces & Films, 2005.
[31] Pereira P H F, Voorwald H J C, Cioffi M O H, et al. Sugarcane bagasse cellulose fibres and their hydrous niobium phosphate composites: synthesis and characterization by XPS, XRD and SEM [J]. Cellulose, 2014,21(1):641-652.
Mechanism of U (VI) removal byunder inactivated and non-inactivated conditions.
LIU Jin-xiang1,2, PU Ya-shuai1, XIE Shui-bo1,2, LIU Ying-jiu1, Chen Zi-geng1, Li Shi-you1*
(1.School of Civil Engineering, University of South China, Hengyang 421001, China;2.Hunan Province Key Laboratory of Pollution Control and Resource Reuse Technology, University of South China, Hengyang 421001, China)., 2019,39(7):2880~2888
The uranium removal tests of inactivated and non-inactivatedwere carried out under different pH and biomass concentration conditions, and the mechanism of uranium removal bywas discussed. Based on SEM-EDS, FTIR, XPS, and XRD, the microscopic mechanism of the interaction between uranium and microbial cell surface and the characteristics of sediments on the cell surface were analyzed. The ability ofto adsorb uranium was significantly improved after heat inactivation. With the pH 6.0, 37℃ and the 10mg/L U(VI), the removal efficiency of U(VI) by heat-killed cells was up to 94.7% during 120min, while the removal efficiency was only 88.9% by live cells. The inactivated bacteria had higher uranium adsorption capacity. At the biomass concentration of 0.06~0.24mg/L and pH value of 3.0~7.0, the rate() of accumulative capacity of U(VI) of inactivated bacteria to that of living bacteria is greater than 1. SEM-EDS、FTIR result illustrated the U(VI) could be adsorbed or coordinated on the surface of the active and inactivated cells through functional groups such as hydroxyl, acyl and carboxyl groups. There were 4 distinct crystal peaks of uranyl phosphate compound at 2(18.023, 25.492, 27.343 and 40.813°) in the XRD spectrum of living bacteria, while no crystal peaks in the spectrum of inactivated bacteria. XRD result indicated U(VI) can be precipitated with the form of uranyl phosphate by biological metabolism of live cells. There were the peaks attributed U(IV) at U 4f 7/2 with binding energy of 381.20eV and U 4f 5/2 with 390.95eV in the XPS energy spectrum of living bacteria. While There was no the peaks attributed U(IV) in the spectrum of inactivated bacteria. XPS result indicated that U(VI) can be induced to U(IV) by living bacteria.
;U(VI);biosorption;mineralization mechanism;bioreduction
X172
A
1000-6923(2019)07-2880-09
刘金香(1972-),女,湖南常德人,教授,博士,主要从事(放射性)污染控制与修复、水处理理论与技术等方面的研究.发表论文50余篇.
2018-11-20
国家自然科学基金资助项目(11475080);湖南省南华大学博士科研启动基金项目(2016XQD06)
* 责任作者, 副教授, lsy730723@163.com

